硫化氢和一氧化氮在平邑甜茶幼苗抵抗镉胁迫中的作用
姜倩倩,曹 慧,杨延红,谢 丽
(潍坊学院 山东省高校生物化学与分子生物学重点实验室,山东 潍坊 261061)
作为重要的气体信号分子,一氧化氮(NO)和硫化氢(H2S)在植物体生长发育及胁迫响应中的生理作用受到广泛关注。已有研究表明,NO有调节植物生长发育过程[1-3]和调控植物抗逆应答反应[4-6]的多种生理功能。相对于NO,H2S的研究起步较晚,其生理功能近年来才被逐步发现。研究表明,H2S与NO具有相似的生物学活性,也可参与多种生长发育过程,并通过调节气孔、激活抗氧化系统等提高植物的抗逆性[7-9]。并且,前人在不同物种、不同组织或不同胁迫条件下进行的试验表明,NO和H2S之间存在多方面的生物学联系,可能涉及多种途径,共同调控植物生长发育和逆境胁迫响应过程[10-11]。Zhu等[12]报道,组合施用外源H2S和NO可进一步抑制桃果实的成熟。解梦洁等[13]发现,高温胁迫下外源H2S可缓解内源NO含量的上升,H2S和NO交叉互作提高了大白菜的耐高温能力。Peng等[14]提出,H2S可能作为NO的下游信号分子参与玉米幼苗对水涝低氧胁迫的响应。
镉(Cd)是果园土壤重金属污染的主要来源之一,其毒性强、难分解,是造成果树伤害的非生物胁迫;镉具有极大的迁移性,对果品安全和人类健康构成严重威胁[15]。平邑甜茶(Malushupehensis(Pamp) Rehd. varpinyiensisJiang)是生产上常用的苹果砧木,镉胁迫严重影响其生长[16]。外源NO供体硝普钠(SNP)和H2S供体硫氢化钠(NaHS)均能增强平邑甜茶对镉的耐受能力[16-17]。李燕歌[18]通过研究平邑甜茶根系镉离子流发现,NO和H2S组合处理可减少镉离子吸收,从而缓解镉对植株的伤害。但二者在苹果对镉胁迫中的共同响应关系尚不明确。本研究以平邑甜茶幼苗为材料,利用外源供体和抑制剂处理的方法,检测镉胁迫下平邑甜茶幼苗的生长情况,测定叶片叶绿素荧光参数、根系细胞死亡数量、呼吸速率、呼吸关键酶活性、抗氧化系统活性等变化,探讨二者在调控平邑甜茶抗镉能力时的相互关系,以期为果树抗逆应用研究提供理论参考。
1 材料与方法
1.1 材 料
硝普钠(SNP)、硫氢化钠(NaHS)、H2S清除剂亚牛磺酸(HT)和NO清除剂Carboxy-PTIO盐(c-PTIO)均购于美国Sigma公司。
1.2 试验方法
平邑甜茶种子经精选、消毒、洗净浸泡后,4 ℃环境下湿砂中层积,待种子露白后,播种于装有基质(草炭、珍珠岩和蛭石按照体积比3∶1∶1配制)的营养钵中,培养至5~6片真叶;选取生长基本一致的幼苗,置于Hoagland营养液(pH值6.5)中进行水培,培养至12~13片真叶时,分别进行以下8个试验处理:对照(CK):正常Hoagland营养液;Cd(T1):正常Hoagland营养液中添加200 μmol/L CdSO4;Cd+NaHS(T2):正常Hoagland营养液中添加200 μmol/L CdSO4+200 μmol/L NaHS;Cd+NaHS+HT(T3):正常Hoagland营养液中添加200 μmol/L CdSO4+200 μmol/L NaHS+100 μmol/L HT;Cd+NaHS+c-PTIO(T4):正常Hoagland营养液中添加200 μmol/L CdSO4+200 μmol/L NaHS+100 μmol/L c-PTIO;Cd+SNP(T5):正常Hoagland营养液中添加200 μmol/L CdSO4+100 μmol/L SNP;Cd+SNP+c-PTIO(T6):正常Hoagland营养液中添加200 μmol/L CdSO4+100 μmol/L SNP+100 μmol/L c-PTIO;Cd+SNP+HT(T7):正常Hoagland营养液中添加200 μmol/L CdSO4+100 μmol/L SNP+100 μmol/L HT。
试验时,每个处理先用除CdSO4之外的其他试剂预处理24 h,然后向培养瓶中加 CdSO4溶液使其终质量浓度为 200 μmol/L。每处理5株幼苗,重复3次,处理后第2天取叶片进行叶绿素含量、叶绿素荧光参数等指标测定,取根系进行细胞死亡数量、呼吸速率和抗氧化酶活性等指标测定;处理后第8天取幼苗植株测定株高、茎粗、干质量、鲜质量等生物量指标。
1.3 测定指标与方法
1.3.1 植株生长指标 参考曹慧等[16]的方法测定株高、茎粗以及地上部和地下部鲜质量、干质量。
1.3.2 叶绿素含量 参照赵世杰等[19]的方法,采用乙醇萃取平邑甜茶幼苗第7~8片真叶的叶绿素,用分光光度计比色法测定。
1.3.3 叶绿素荧光参数 采用Imaging-PAM调制荧光成像系统 (德国,Walz),检测获得平邑甜茶幼苗第8片真叶的叶绿素荧光参数:潜在光化学活性(Fv/Fo)、最大光化学效率(Fv/Fm)和实际光化学效率(ΦPSⅡ)。
1.3.4 根系细胞死亡数量 参照Steffens等[20]的方法,称取1 g生长根,用10 g/L的伊文思蓝溶液染色30 min,随后用纯净水洗净根系表面色素后置于甲醇中萃取,用分光光度计测定萃取液在600 nm处的吸光度(A600),用A600值反映根系细胞死亡数量,A600值越大,说明根系细胞死亡数量越多,否则越少。
1.3.6 根系呼吸速率 采用Chlorolab2+液相氧电极自动测定系统(英国,Hansatech)测定。
1.3.7 根系呼吸相关酶活性 苹果酸脱氢酶(MDH)、磷酸果糖激酶(PFK)和葡萄糖-6-磷酸脱氢酶(G-6-PDH)活性采用试剂盒(南京建成生物工程研究所)测定[21]。
1.4 数据处理
采用软件SPSS和Excel 2010进行试验数据统计分析和图表绘制。
2 结果与分析
2.1 H2S和NO对镉胁迫下平邑甜茶幼苗生长的影响
H2S和NO对镉胁迫下平邑甜茶幼苗生长的影响如表1所示。由表1可知,与对照(CK)相比,重金属Cd胁迫显著抑制平邑甜茶幼苗生长。Cd胁迫下,分别添加外源H2S供体NaHS和NO供体SNP均缓解了Cd对平邑甜茶幼苗生长的抑制,其株高、茎粗和植株干、鲜质量均显著增加,二者缓解Cd胁迫的水平相当;Cd胁迫下,添加NaHS的同时添加H2S清除剂HT或NO清除剂c-PTIO,抑制了外源H2S对平邑甜茶幼苗生长的缓解作用,平邑甜茶株高、茎粗、植株干、鲜质量均比Cd胁迫下仅添加NaHS处理的显著下降,与单独Cd胁迫处理的抑制水平相当;Cd胁迫下添加SNP的同时添加c-PTIO,抑制了SNP对Cd伤害的保护效应;Cd+SNP+HT(T7)处理平邑甜茶幼苗的长势与Cd+SNP(T5)处理差异不显著,但明显好于单独Cd胁迫处理(T1)。

表1 H2S和NO对镉胁迫下平邑甜茶幼苗生长的影响Table 1 Effects of H2S and NO on growth of Malus hupehensis Rehd. seedlings under Cd stress
2.2 H2S和NO对镉胁迫下平邑甜茶幼苗叶绿素含量的影响
如图1所示,与CK相比,单独Cd胁迫处理(T1)平邑甜茶幼苗叶绿素含量显著降低。与单独Cd胁迫处理相比,添加NaHS、SNP均能显著提高平邑甜茶幼苗叶片叶绿素含量,叶绿素a和叶绿素b含量分别增加了22.84%,29.66%和16.29%,29.52%;Cd+NaHS处理时,添加H2S清除剂HT或NO清除剂c-PTIO均抑制了Cd胁迫下NaHS对叶绿素的保护,叶绿素a和叶绿素b含量与单独Cd处理差异不显著;Cd+SNP处理,添加NO清除剂c-PTIO,抑制了Cd胁迫下SNP对叶绿素的保护;但添加H2S清除剂HT对Cd胁迫下SNP的作用几乎无影响,叶绿素a和叶绿素b含量比单独Cd胁迫处理显著增加了19.63%和26.82%。
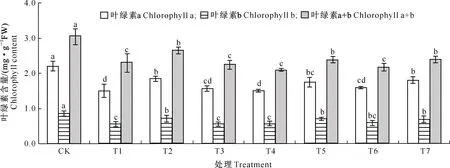
图柱上标不同小写字母表示处理间差异显著(P<0.05),下图同 Different lowercase letters indicate significant differences among treatments at the level of P=0.05, the same below图1 H2S和NO对镉胁迫下平邑甜茶幼苗叶绿素含量的影响Fig.1 Effect of H2S and NO on chlorophyll content of Malus hupehensis Rehd. seedlings under Cd stress
2.3 H2S和NO对镉胁迫下平邑甜茶幼苗叶绿素荧光特性的影响
H2S和NO对镉胁迫下平邑甜茶幼苗叶绿素荧光特性的影响如图2所示。由图2可知,与CK相比,单独Cd胁迫下平邑甜茶幼苗潜在光化学活性(Fv/Fo)、最大光化学效率(Fv/Fm)和实际光化学效率(ΦPSⅡ)均显著下降,分别降低了57.51%,31.99%和55.36%。Cd胁迫下分别添加外源NaHS或SNP均明显抑制了平邑甜茶幼苗Fv/Fo、Fv/Fm和ΦPSⅡ的降低,二者之间差异不显著。Cd+NaHS处理时,添加HT或c-PTIO均显著抑制了Cd胁迫下NaHS对平邑甜茶叶片光合电子传递性能的保护作用。Cd+SNP处理时,添加c-PTIO也抑制了SNP的缓解作用;但添加HT对Cd胁迫下SNP的作用几乎无影响,Fv/Fo、Fv/Fm和ΦPSⅡ比单独Cd胁迫处理分别显著提高了25.22%,18.02%和30.66%。

图2 H2S和NO对镉胁迫下平邑甜茶幼苗叶绿素荧光特性的影响Fig.2 Effect of H2S and NO on chlorophyll fluorescence characteristics of Malus hupehensis Rehd. seedlings under Cd stress
2.4 H2S和NO对镉胁迫下平邑甜茶幼苗根系细胞死亡的影响
由图3可知,与CK相比,Cd处理导致平邑甜茶幼苗根系严重损伤。外源添加NaHS或SNP可显著降低Cd胁迫下根系细胞的死亡数量,根系细胞死亡数量比单独Cd胁迫处理分别减少了44.63%和33.64%。

图3 H2S和NO对镉胁迫下平邑甜茶幼苗根系细胞死亡数量的影响Fig.3 Effect of H2S and NO on cell death quantity in roots of Malus hupehensis Rehd. seedlings under Cd stress
由图3还可知,在Cd+NaHS处理时分别添加HT和c-PTIO,或Cd+SNP处理时添加c-PTIO,均可明显促进根系细胞死亡,抑制NaHS或SNP 对根系镉损伤的缓解作用,根系细胞死亡数量分别比单独Cd胁迫处理减少了13.96%,15.43%和21.33%。Cd+SNP处理时添加HT,SNP对根系镉损伤的保护效应未受影响,根系细胞死亡数量比单独Cd胁迫处理减少了32.38%。
2.5 H2S和NO对镉胁迫下平邑甜茶幼苗根系呼吸代谢的影响
植物根系的呼吸作用与植物的能量代谢和物质吸收运输密切相关。如图4-A所示,与CK相比,Cd胁迫处理平邑甜茶幼苗根系呼吸速率显著降低了44.21%。Cd胁迫下添加NaHS或SNP均显著提高了根系呼吸速率,分别比单独Cd胁迫处理增加了46.33%和44.93%,但二者之间差异不显著。而在Cd胁迫下进行NaHS或SNP处理时,添加NO清除剂c-PTIO,可显著抑制NaHS和SNP的缓解效用;添加H2S清除剂HT也显著抑制了Cd胁迫下NaHS对根系呼吸速率的保护,根系呼吸速率比单独Cd胁迫处理降低了1.78%,而HT对SNP的保护效应影响无显著变化。
生物体内有多条呼吸代谢途径,MDH、PFK和G-6-PDH是调节各呼吸途径呼吸速率的关键酶,其活性的高低直接影响呼吸速率的强弱。
由图4-B和4-C可知,与CK相比,单独Cd胁迫处理下平邑甜茶幼苗根系PFK、MDH活性均显著下降,分别比CK处理降低了18.19%和37.14%;添加NaHS或SNP处理PFK、MDH活性分别较单独Cd胁迫处理提高了11.29%,27.17%和13.70%,17.48%。与单独Cd胁迫处理相比,Cd+NaHS+c-PTIO处理PFK、MDH活性无显著变化;而Cd+SNP+c-PTIO处理MDH活性无显著变化,PFK活性显著降低了12.71%;Cd+NaHS+HT处理PEK活性无显著变化,而MDH活性显著提高12.54%,比Cd+NaHS处理降低了7.81%,但二者之间差异不显著。Cd+SNP+HT处理PFK、MDH活性与单独Cd处理相比分别提高了6.95%和14.64%,与Cd+SNP处理相比均无显著变化。
由图4-D可知,与CK相比,单独Cd胁迫处理G-6-PDH活性显著提高了19.59%。Cd+NaHS和Cd+SNP处理G-6-PDH活性较单独Cd胁迫处理分别降低了13.82%和16.98%。Cd胁迫下进行NaHS或SNP处理时,添加NO清除剂c-PTIO或H2S清除剂HT与否,G-6-PDH活性均无显著变化。
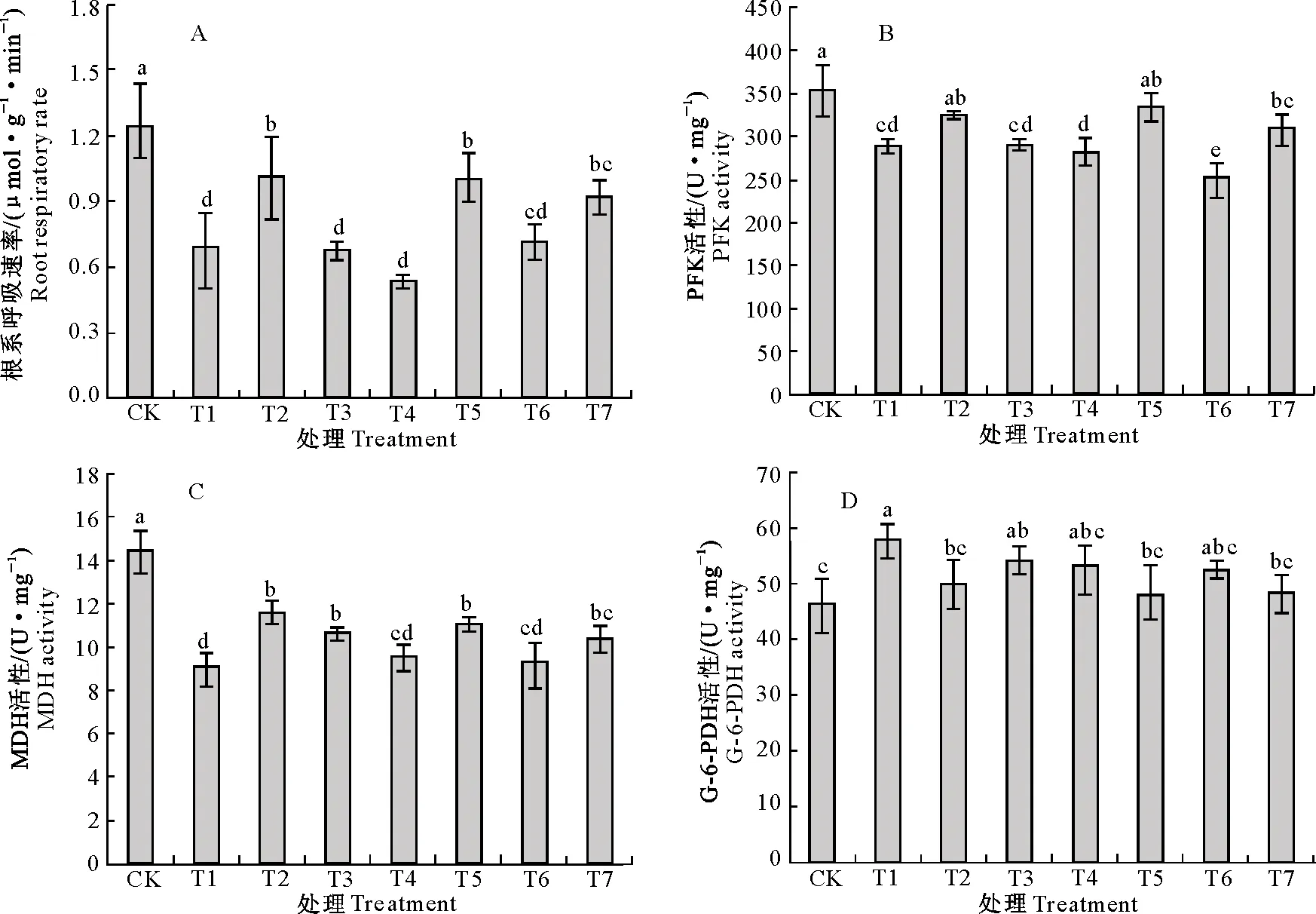
图4 H2S和NO对镉胁迫下平邑甜茶幼苗根系呼吸速率和关键酶活性的影响Fig.4 Effect of H2S and NO on respiration rate and key enzyme activities in roots of Malus hupehensis Rehd. seedlings under Cd stress
2.6 H2S和NO对镉胁迫下平邑甜茶幼苗根系产生速率和H2O2含量的影响
由图5还可知,各处理平邑甜茶根系H2O2含量变化与超氧阴离子产生速率的变化趋势基本一致。单独Cd胁迫处理根系H2O2含量较高;Cd+NaHS和Cd+SNP处理H2O2含量分别比单独Cd处理显著降低了27.49%和26.66%,但二者之间差异不显著;Cd+NaHS+HT、Cd+NaHS+c-PTIO处理H2O2含量比Cd+NaHS处理分别显著提高了23.96%和20.38%。Cd+SNP+c-PTIO处理H2O2含量比Cd+ SNP处理显著提高了22.52%,而Cd+SNP+HT处理H2O2含量与Cd+ SNP处理相比无显著变化。Cd胁迫下用NaHS或SNP处理时,添加了HT或c-PTIO后根系H2O2含量均显著低于单独Cd胁迫处理。

图5 H2S和NO对镉胁迫下平邑甜茶幼苗根系产生速率和H2O2含量的影响Fig.5 Effect of H2S and NO on production rate and H2O2 content in roots of Malus hupehensis Rehd. seedlings under Cd stress
2.7 H2S和NO对镉胁迫下平邑甜茶幼苗根系抗氧化酶活性的影响
如图6所示,与CK相比,单独Cd胁迫致使平邑甜茶根系SOD、POD和CAT活性均显著升高,分别比CK提高了74.73%,300.7%和77.06%;与单独Cd胁迫处理相比,Cd+NaHS或Cd+SNP处理平邑甜茶根系SOD、POD和CAT活性分别显著提高了41.52%,82.22%,49.29和34.87%,98.90%,78.72%。在Cd+NaHS处理时添加HT和c-PTIO,或Cd+SNP处理时添加c-PTIO,均可显著降低平邑甜茶根系SOD、POD和CAT活性。Cd+SNP+HT处理平邑甜茶根系SOD活性较Cd+SNP处理略有下降,但二者之间差异不显著,POD和CAT活性分别较Cd+SNP处理显著降低了19.43%和17.30%。

图6 H2S和NO对镉胁迫下平邑甜茶幼苗根系SOD、POD、CAT活性的影响Fig.6 Effect of H2S and NO on SOD,POD and CAT activities in roots of Malus hupehensis Rehd. seedlings under Cd stress
3 讨 论
镉胁迫会影响植物根系活动,导致叶片失水,进而影响光合色素生成,加速叶绿素分解,最终植株黄化、生长缓慢,直至死亡[16]。本试验中,用200 μmol/L CdSO4胁迫2 d后,平邑甜茶幼苗叶片叶绿素含量及光合能力均下降,根系细胞大量死亡,幼苗生长受到抑制。作为气体信号分子,H2S与NO可以通过调节气孔、激活抗氧化系统等提高植物的抗逆性[7-9],单独施用生理浓度的外源H2S和NO都可缓解植物的非生物胁迫伤害[6,10]。在镉胁迫条件下,H2S信号可激活植物体内的抗氧化酶促和非酶促系统,以清除细胞内H2O2。H2S对Cd2+转运和液泡区式化的调节,降低了体内Cd2+的浓度,通过抑制镉离子内流降低拟南芥体内的镉毒性[22]。本研究结果表明,外源添加H2S或NO均可减轻镉胁迫对平邑甜茶幼苗的损伤和生长抑制作用。这表明,气体信号分子H2S和NO参与了平邑甜茶幼苗对重金属镉的胁迫响应。

根系呼吸是植物地下部代谢的中心,与根系功能和胁迫响应等密切相关。植物体内存在多条呼吸代谢途径,其中,以糖酵解途径(EMP)进入三羧酸循环(EMP-TCA)途径为主,为植物提供生长发育所需的能量和物质[21,24]。当EMP-TCA途径受阻时, 另一重要途径戊糖磷酸途径(PPP)可代替正常的有氧呼吸,协调植物对环境的适应,其与各种逆境胁迫密切相关[25]。在植物呼吸代谢中,磷酸果糖激酶(PFK)、苹果酸脱氢酶(MDH)和葡萄糖-6-磷酸脱氢酶(G-6-PDH)分别作为调控EMP途径、TCA途径和PPP途径的关键酶,其活性与呼吸速率高低密切相关。本试验中,与CK相比,Cd胁迫导致PFK、MDH活性显著下降了18.19%和37.14%,G-6-PDH活性则显著升高了19.59%,说明镉胁迫导致平邑甜茶根系基础呼吸途径发生改变,EMP-TCA途径受阻,而PPP途径发挥重要作用,以响应镉胁迫。Cd胁迫下添加外源H2S和NO时,PFK、MDH活性分别较单独Cd胁迫提高了11.29%,27.17%和13.70%,17.48%;G-6-PDH活性分别降低了13.82%和16.98%。这说明H2S和NO减轻了镉胁迫对平邑甜茶幼苗主要呼吸途径的抑制,在一定程度上使呼吸代谢恢复正常,提高平邑甜茶幼苗对镉胁迫的适应能力。
解梦洁等[13]研究表明,H2S和NO交互作用参与大白菜抵御高温胁迫,且H2S对高温胁迫的响应优先于NO,外源H2S会抑制NO的产生,而NO对H2S的含量变化无明显影响。而Shi等[26]指出,草坪草狗牙根在响应镉胁迫时,NO的产生先于H2S,NO会通过上调H2S的合成增强植物的抗镉性。本研究中,施用NO清除剂c-PTIO能抑制外源H2S和NO对平邑甜茶幼苗镉损伤的缓解;施用H2S清除剂HT仅能抑制外源H2S对镉胁迫下平邑甜茶幼苗的保护效应,而对外源NO的作用基本无影响。这表明平邑甜茶幼苗遭受镉胁迫时H2S和NO有交互作用,H2S的产生先于NO,这与李燕歌[18]的研究结果相吻合。由此推测,气体信号分子H2S和NO并不是简单的上下游关系,二者的相互作用在不同植物中的响应机制有差异。

