小儿消积止咳提取过程中近红外定量模型研究△
李因坤,魏瑞霞,2a,李艳芳,2,范建伟,2,刘庆丰,2,关永霞,2*
1.鲁南厚普制药有限公司,山东 临沂 276006;
2.鲁南制药集团股份有限公司/中药制药共性技术国家重点实验室,山东 临沂 276006
小儿消积止咳口服液是由炒山楂、槟榔、枳实、瓜蒌、连翘等10 味中药加工制成的中药复方制剂,具有清热肃肺、消积止咳的功能[1],可用于小儿支原体肺炎[2]、小儿咳嗽变异性哮喘[3]、小儿上呼吸道感染后咳嗽[4]等疾病的治疗,临床疗效确切。
小儿消积止咳口服液生产过程由提取、浓缩、醇沉等多个工序组成。提取作为工业化生产的首要环节,目的在于将中药饮片中有效成分转移到溶媒中,确保有效成分在规定范围内。因此,提取环节直接影响着药品的质量与疗效[5]。在实际生产中,常存在批间有效成分含量波动大的问题,原因在于提取环节的控制仍以人工主观判断和离线检测分析为主,其结果常严重滞后,无法进行有效的数据跟踪及分析。近红外(NIR)光谱能够确切反映提取过程中物料有效成分的溶出状态,更好地监控提取过程的质量波动,是目前主流的过程分析技术工具之一[6-8],已有学者为保证药品质量稳定性,将NIR 技术应用于中药的提取过程[5,9]。
本研究模拟小儿消积止咳提取过程,收集多批提取液中共116 个样品,采用傅里叶变换NIR 光谱仪结合积分球漫反射方式对样品进行NIR 光谱的采集,并应用偏最小二乘法(PLS)将高效液相色谱法(HPLC)定量分析结果与NIR光谱相关联,建立辛弗林、柚皮苷、新橙皮苷和连翘苷4个成分的NIR定量分析模型,以预测未知样品中4 个成分的含量,从而为实现小儿消积止咳口服液提取过程的质量监控提供参考。
1 材料
1.1 仪器
2695 型高效液相色谱仪(美国沃特世公司),配有2998 型二极管阵列检测器(PDA)、Epower 3色谱工作站;MPA Ⅱ型多功能傅里叶变换NIR 光谱仪(德国布鲁克公司),配有OPUS 8.1 光谱采集和处理软件;H1650-W 型台式微量高速离心机(长沙湘仪离心机仪器有限公司);KS-5200DE型液晶超声波清洗器(昆山洁力美超声仪器有限公司);TNH-200型提取罐(温州市金榜轻工机械有限公司)。
1.2 试药
对照品辛弗林(批号:110727-201809,纯度:99.5%)、连翘苷(批号:110821-201816,纯度:95.1%)、柚皮苷(批号:110722-201815,纯度:91.7%)、新橙皮苷(批号:111857-201804,纯度:99.4%)均购于中国食品药品检定研究院;乙腈、甲醇为色谱纯(美国天地有限公司);高氯酸为分析纯(南京化学试剂股份有限公司);水为超纯水。
实验用药材经鲁南制药集团有限公司范建伟高级工程师鉴定为正品,来源见表1,均符合《中华人民共和国药典》(以下简称《中国药典》)2020年版一部相关项下要求。
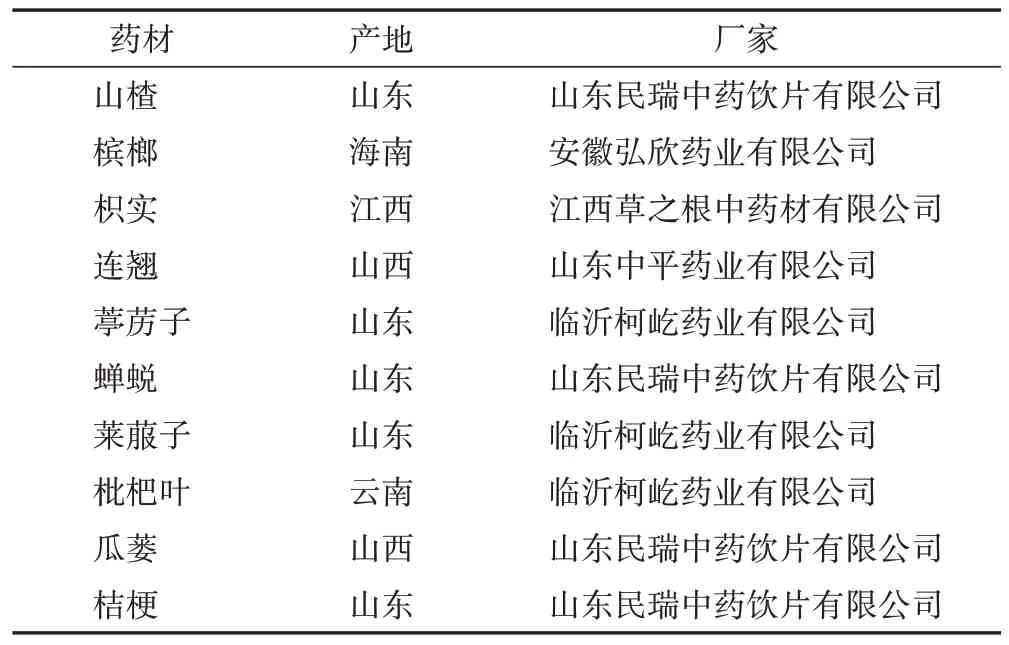
表1 小儿消积止咳口服液药材产地及厂家
2 方法与结果
2.1 样品收集
分别取山楂、槟榔等10 味中药,按照实际生产工艺对其进行加工炮制。参照《中国药典》2020 年版(一部)中“小儿消积止咳口服液”【处方】项,按其制剂处方10 倍量,分别称取所需饮片,顺序投入200 L 提取罐中,加水煎煮2 次,待药液沸腾后,调小蒸气,保持微沸状态。从沸腾开始取样,每隔10 min放药取样1次,每次100 mL,经300目电力纺滤过,分别在煎煮第一汁时取样16 次,第二汁时取样13次。重复4个批次,共得到116份提取过程中的样品溶液。
2.2 NIR光谱的采集
取2.1项下的样品溶液各40 mL,于直径为51 mm石英杯中,置小型样品旋转器内,采用NIR 光谱仪以积分球漫反射方式采集各样品的原始光谱,扫描的光谱范围为12 500~4000 cm-1,扫描数64 次,分辨率16 cm-1。为保证样品的稳定性,自取样至检测完毕,整个过程保证在30 min 以内,所得NIR 原始光谱图见图1。
图1 小儿消积止咳提取液的NIR光谱图
2.3 辛弗林、柚皮苷、新橙皮苷和连翘苷的含量测定
2.3.1 色谱条件 色谱柱为Phenomenex Luna®PFP(2)(250 mm×4.6 mm,5 µm);流动相A 为0.1%高氯酸,流动相B 为乙腈-甲醇(9∶1),梯度洗脱(0~5 min,100%A;5~10 min,100%~98%A;10~15 min,98%~95%A;15~35 min,95%~80%A;35~55 min,80%~75%A;55~80 min,75%~60%A;80~81 min,60%~100%A;81~90 min,100%A);柱温为35 ℃;进样量为10 µL;流速为0.8 mL·min-1;检测波长为225 nm。
2.3.2 溶液的制备
2.3.2.1 对照品溶液的制备 精密称取对照品辛弗林16.70 mg、柚皮苷24.03 mg、新橙皮苷15.53 mg和连翘苷21.78 mg,置于同一25 mL 量瓶中,加入50%甲醇,超声溶解,作为混合对照品储备液。精密移取上述混合对照品储备液各1 mL置25 mL量瓶中,加水稀释至刻度,摇匀,滤过,即得对照品溶液。
2.3.2.2 供试品溶液的制备 供试品溶液Ⅰ:取2.1项下第一汁水煎煮液样品各5 mL置于10 mL量瓶中,加超纯水稀释至刻度,以转速12 000 r·min-1高速离心10 min(离心半径为63.4 mm),取上清液,用0.22µm微孔滤膜滤过,即得。供试品溶液Ⅱ:取2.1 项下第二汁煎煮液样品以转速12 000 r·min-1高速离心10 min(离心半径为63.4 mm),取上清液,用0.22µm微孔滤膜滤过,即得。
2.3.2.3 阴性溶液的制备 按小儿消积止咳口服液中药材的提取方法分别制成不含枳实与连翘的煎煮液,按供试品溶液Ⅰ、供试品溶液Ⅱ的制备方法制成阴性溶液Ⅰ和阴性溶液Ⅱ。
2.3.3 方法学考察
2.3.3.1 系统适用性与专属性试验 分别精密吸取空白溶剂,对照品溶液,供试品溶液Ⅰ、供试品溶液Ⅱ,阴性溶液Ⅰ、阴性溶液Ⅱ各10µL,按2.3.1项下色谱条件进样,记录色谱图(图2)。结果供试品色谱中辛弗林、柚皮苷、新橙皮苷、连翘苷的色谱峰与对照品色谱峰保留时间一致,且各有效成分的色谱峰与其相邻其他成分的分离度均大于1.5,空白溶剂与阴性溶液在待测色谱峰相应保留时间处均无干扰。
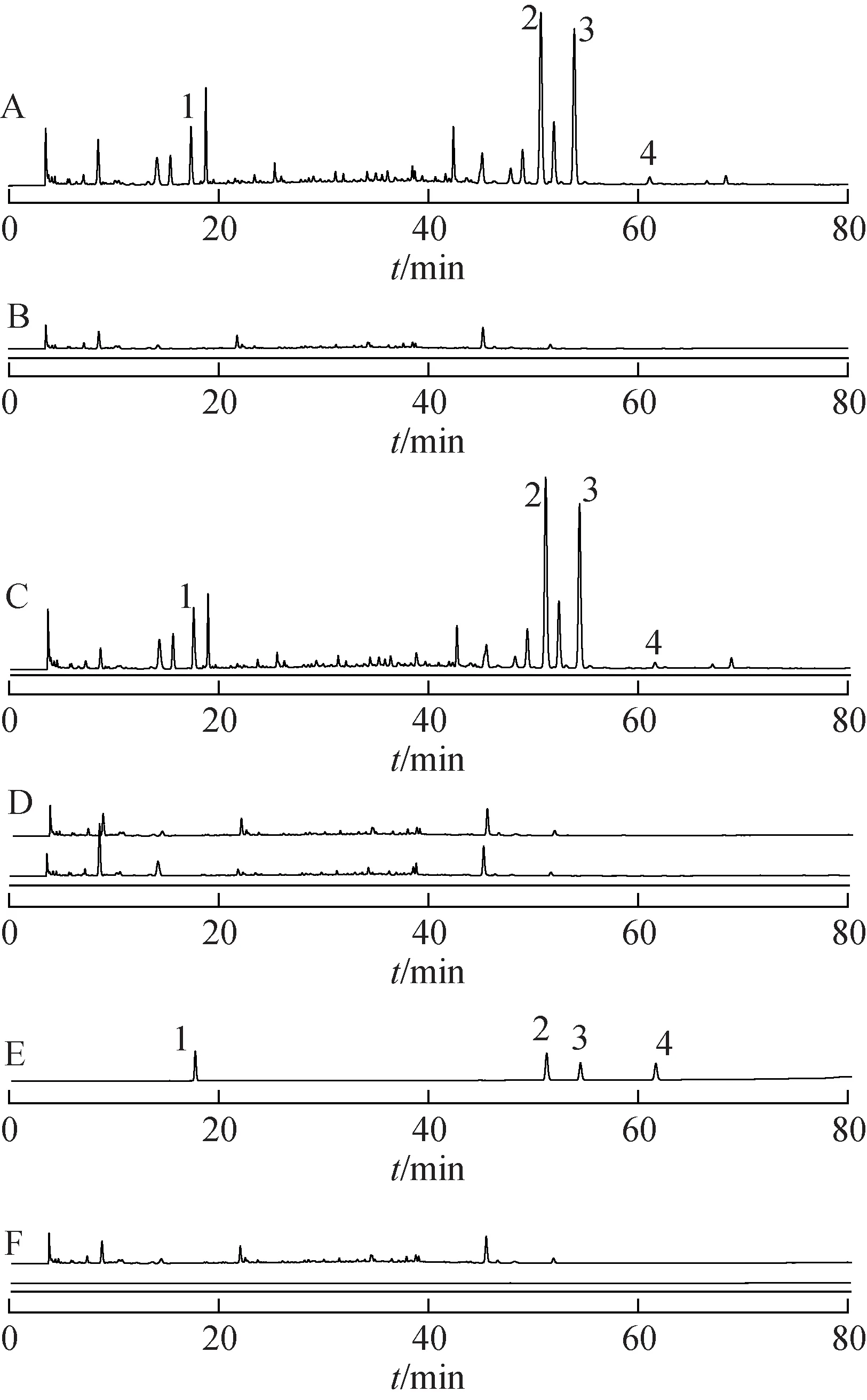
图2 小儿消积止咳各溶液的HPLC图
2.3.3.2 精密度试验 精密吸取2.3.2.1 项下的对照品溶液10µL,连续进样6 次,测得辛弗林、柚皮苷、新橙皮苷、连翘苷的色谱峰保留时间RSD 分别为0.05%、0.04%、0.04%、0.03%,其色谱峰峰面积的RSD 分别为0.09%、0.18%、0.22%、0.07%,结果表明仪器的精密度良好。
2.3.3.3 线性关系考察 分别精密移取2.3.2.1 项下的混合对照品储备液0.04、0.08、0.20、0.40、0.80、2.00、4.00、8.00 mL 置10 mL 量瓶中,加水稀释至刻度,摇匀,制成系列质量浓度的混合对照品溶液。精密吸取各混合对照品溶液10µL,注入液相色谱仪,依法测定,以峰面积为纵坐标(Y),以各对照品质量浓度为横坐标(X),得各指标成分的回归方程、线性范围及相关系数,结果见表2。
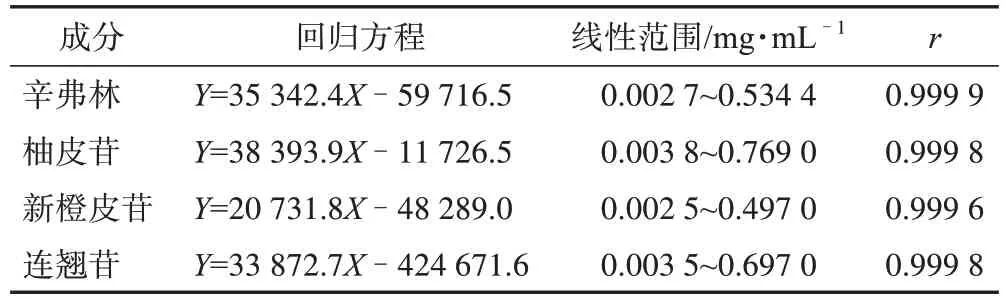
表2 小儿消积止咳提取液4个指标成分的线性关系
2.3.3.4 重复性试验 取同一第一汁煎煮液样品,按2.3.2.2项下方法平行配制6份供试品溶液并依法测定。结果显示,辛弗林、柚皮苷、新橙皮苷、连翘苷含量的RSD 分别为0.12%、0.90%、0.54%、0.30%,表明该方法具有较好的重复性。
2.3.3.5 稳定性试验 取同一供试品溶液Ⅰ,分别精密吸取配制后0、3、6、9、12 h的供试品溶液10µL,注入色谱仪中,测得各成分的峰面积,计算辛弗林、柚皮苷、新橙皮苷、连翘苷峰面积的RSD分别为0.33%、0.11%、0.07%、0.62%。表明供试品溶液Ⅰ在12 h内稳定。
2.3.3.6 加样回收率试验 精密量取6 份已知含量的第一汁煎煮液样品2.5 mL,分别加入相当量的对照品储备液,按照2.3.2.2 项下方法配制供试品溶液,进行加样回收率试验。测得的辛弗林、柚皮苷、新橙皮苷、连翘苷的平均回收率分别为101.5%、98.63%、101.3%、91.02%,RSD 分别为0.52%、1.6%、1.3%、0.71%,表明该方法的准确度良好。
2.3.4 样品测定 分别精密吸取混合对照品溶液、供试品溶液各10µL,注入高效液相色谱仪,记录色谱图,以外标法计算含量,结果见表3。
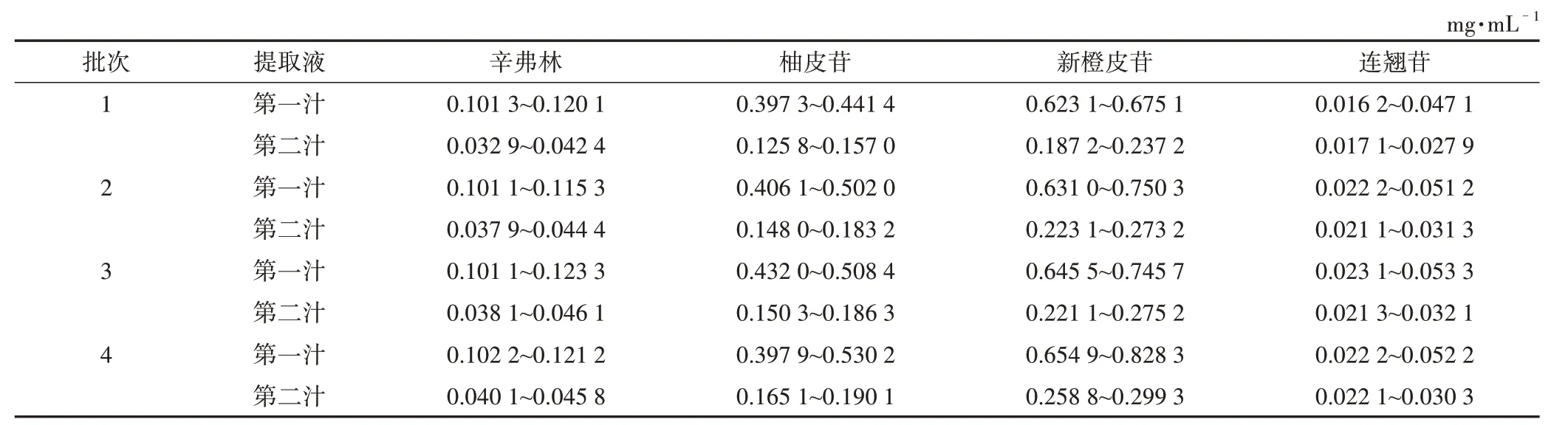
表3 小儿消积止咳提取液提取过程中4个指标成分的含量测定结果
2.4 NIR光谱定量分析模型的建立与优化
以HPLC 测得的指标成分含量作为化学真值,代入OPUS 8.1定量处理软件与NIR扫描得到的谱图相对应,采用Kennard-Stone 法将116 个样本的75%作为校正集,其余25%为验证集,进行PLS 定量分析,建立NIR 光谱与辛弗林、柚皮苷、新橙皮苷、连翘苷4 个成分的定量校正模型。同时作交叉验证,并以交叉验证均方根误差(RMSECV)和内部交叉验证决定系数(Rν2)作为评价参数,RMSECV 越小,Rν
2越大,则模型越稳定,预测性能越好[10]。采用预测集进一步检验模型的预测能力,其评价参数为预测均方差(RMSEP)、外部验证决定系数(Rp2)和RPD,当相对预测偏差(RPD)>3%时认为模型具有较好的预测能力,可以进行指标的定量控制[11]。
2.4.1 光谱预处理方法选择 由于NIR 光谱得到的光谱信息里包含了过多冗余信息,为提高分析模型预测的精度,消除噪音、杂散光、仪器及样品状态等各种因素的干扰。在建模过程中,采用OPUS 8.1软件中自带的优化功能对无光谱预处理、消除常数偏移值、矢量归一化(SNV)、最小-最大归一化、多元杂散光校正、一阶导数、一阶导数+多元散射校正(SMC)、减去一条直线8 种不同的光谱预处理方法进行合理的选择,以降低上述干扰的影响,提高模型的稳定性。
2.4.2 光谱波段的选择 透射光谱法多指短波NIR区,其波数一般为14 000~9000 cm-1,而反射光谱法多指长波NIR区,其波数一般在9000~4000 cm-1。小儿消积止咳煎煮液样品是采用积分球漫反射方式采集的NIR 光谱,在光谱波段的选择中,虽然检测样品为液体,同时兼具透射和反射,但因提取液为浑浊液,光谱仍以反射波段为主。另外光谱在6944、5155 cm-1附近形成2大“水峰”,即5500~4000、7500~6500 cm-1波段[11],所以还应尽可能避免采用上述2个波段进行NIR光谱分析。
2.4.3 最佳模型的建立 经过不同光谱预处理方法和不同建模波段对样品中辛弗林、柚皮苷、新橙皮苷、连翘苷含量模型进行对比研究,并剔除异常样品,得出最佳的光谱预处理方法、建模波段,建立4 个成分的定量分析模型,结果见表4,其中评价指标RMSECV 均较小,Rv2均大于0.95,说明模型性能良好。

表4 小儿消积止咳提取液NIR光谱预处理和波段选择结果
2.4.4 外部检验验证 采用所建模型对验证集样品中4 个成分含量的预测结果进行外部验证,外部检验集由116 个样品中规律抽取而成,每个成分含量的检验均采集数据28 个。预测显示,辛弗林、柚皮苷、新橙皮苷和连翘苷的Rp2分别为0.968 3、0.968 1、0.959 5和0.951 1,RMSEP分别为0.006 4、0.028 8、0.050 1 和0.003 2,RPD 分别为9.99%、5.97%、5.19%、4.13%,均大于3%,可满足提取过程中含量预测的精度要求。
将NIR 光谱模型预测值与HPLC 实测值进行比较,结果见图3。从图3中可以看出,模型的预测值与实测值非常接近,变化趋势一致,表明采用NIR光谱模型对小儿消积止咳提取过程中辛弗林、柚皮苷、新橙皮苷、连翘苷的含量预测结果可靠。同时,预测结果反映了小儿消积止咳提取过程中成分的溶出规律,在提取过程中,枳实中的3 个成分呈快速平衡状态,而连翘的成分在溶液中溶出相对较慢,其原因可能与枳实、连翘的加工方式有关。
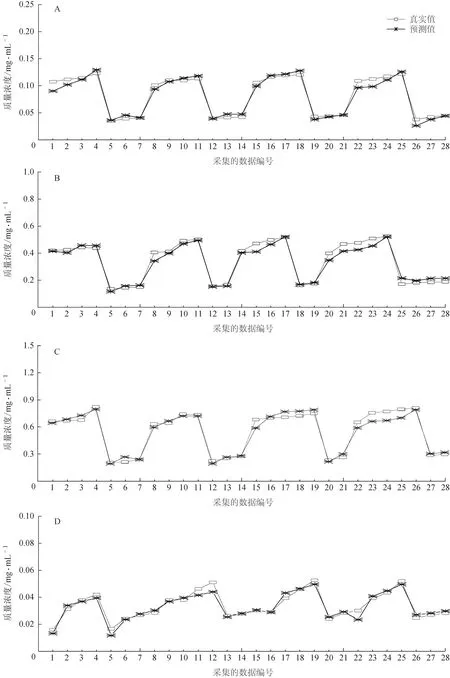
图3 小儿消积止咳提取液4个批次中4个成分预测值与实测值的比较
3 讨论
小儿消积止咳提取过程NIR 定量分析模型的建立,是利用PLS 将NIR 光谱与HPLC 分析数据进行关联,HPLC分析数据越准确,NIR模型的准确度越高。因此,HPLC 分析方法色谱条件的选择非常重要。在色谱条件的选择中,以五氟苯基(PFP)柱为色谱柱,分别考察了乙腈-水、甲醇-0.1%乙酸水溶液、乙腈-0.1%磷酸水溶液、甲醇-0.1%磷酸水溶液、乙腈-甲醇-0.1%磷酸水溶液、乙腈-甲醇-0.1%高氯酸水溶液等多种流动相,综合分离度、保留强度、分析时间等因素,最终选取乙腈-甲醇-0.1%高氯酸水溶液为流动相,避免了测定辛弗林时常采用的流动相中添加离子对试剂的模式,防止离子对试剂及色谱柱造成不可逆伤害,减少色谱柱的平衡时间,同时使辛弗林在色谱柱上的保留增强,成功实现了HPLC 对小儿消积止咳提取过程中辛弗林、柚皮苷、新橙皮苷和连翘苷4 个指标成分含量的同时测定。通过PDA对对照品混合液进行190~400 nm全波长扫描,结果显示,在225 nm 处4 个成分均有较大吸收,灵敏度较高、基线较平稳,故选择225 nm作为吸收波长。
研究中为了更接近工业生产过程,在提取时应用多功能提取罐,并以制剂处方量10 倍量进行提取。由于水提取液为浑浊液,使得NIR 光不能完全穿透样品,因此,选取漫反射方式进行光谱扫描。在建模过程中,柚皮苷、新橙皮苷无需进行光谱预处理,辛弗林和连翘苷仅需进行消除常量偏移值的光谱预处理,即可实现提高模型稳定性的目的,可见,采用积分球漫反射方式扫描光谱图比较适合小儿消积止咳提取过程中4 个成分建模的要求。在模型评价指标中,RMSECV 和RMSEP 较为接近,代表建模样品及验证样品均具有代表性,模型信息拟合较佳,与HPLC 分析方法的准确度相当。
小儿消积止咳口服液由10 味中药配伍而成,提取中所有饮片一起煎煮,成分复杂,《中国药典》2020 年版中小儿消积止咳口服液项下质量控制方法仅以辛弗林为指标性成分进行了含量测定[12],较难满足中药生产过程中质量控制的需求。本研究以辛弗林、柚皮苷、新橙皮苷、连翘苷作为指标成分,建立了小儿消积止咳提取过程中4 个成分的含量预测模型,兼顾了同一药材不同性质的成分及不同药味的指标成分,能够快速地、较全面地反映其提取过程中的质量变化。
4 结论
本研究中建立的小儿消积止咳提取过程NIR 定量分析模型,预测性能良好、准确度高,可为监测提取过程中多指标成分的动态变化、异常情况的判断提供参考。

