基于生物活性导向分离及灰色关联度分析的山楂核干馏液抗炎和抗菌作用物质基础研究△
张鹭,钱大玮,唐志书*,宋忠兴,王明耿,刘峰,陈衍斌,许刚,许洪波
1.陕西中医药大学 陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西中药产业技术研究院,陕西 咸阳 712083;
2.南京中医药大学 江苏省方剂高技术研究重点实验室/江苏省中药资源产业化过程协同创新中心,江苏 南京 210023;
3.山东步长制药股份有限公司,山东 菏泽 274000;
4.陕西国际商贸学院 陕西省中药绿色制造技术协同创新中心,陕西 咸阳 712046
山楂核(山楂种子)是山楂加工业的主要副产品,占山楂果实干质量的30%。随着山楂产品产量的增加,世界各地每年产出大量山楂核(仅中国每年就生产约150万t)。化学成分研究结果表明,山楂核主要含有木脂素类成分,通过干馏技术可将山楂核中的木脂素等大分子裂解为大量酚类单体和低聚物,即干馏液[1]。前期关于山楂核干馏液的药理作用研究表明,其具有显著的抗炎及抗菌活性,已被开发成抗菌药品(如红核妇洁洗液)[2-3],用于治疗由白色念珠菌感染后引发的霉菌性阴道炎,临床疗效较好。
此前,研究者采用气相色谱-质谱法(GC-MS)对山楂核干馏液的化学组成进行了分析,共鉴定了90 余个化合物,主要为小分子酚、醛、呋喃类[4-6]。目前,有关山楂核干馏液质量控制的指标性成分多选择糠醛和愈创木酚[7]。前期研究表明,这2 个成分不是山楂核干馏液的特征性成分,同时其结构不稳定[8]。截至目前,山楂核干馏液抗炎和抗菌作用的物质基础尚不明确。本研究通过建立山楂核干馏液4个流分的GC-MS 明晰其主要成分,并使用灰色关联度分析法计算主要色谱峰与其抗炎、抗菌作用的关联度,从而明确其发挥抗炎、抗菌作用的化合物,为山楂核干馏液的临床应用及其相关产品质量标准的制定提供参考。
1 材料
1.1 细胞与菌株
小鼠腹腔巨噬细胞RAW264.7 购自中国科学院上海生命科学院生物化学与细胞生物学研究所;白色念珠菌(菌株编号:ATCC 10231)购自中国普通微生物菌种保藏管理中心。
1.2 仪器
5977-7890A 型气相色谱-质谱联用仪,HP-5MS型毛细管色谱柱均购自安捷伦科技有限公司;XS205DU 型十万分之一电子分析天平(美国梅特勒-托利多仪器公司);ICO240 型恒温培养箱(美国Thermo Fisher Scientific 公司);HYQ240S 型全温双层摇床(中国常州爱华仪器公司);Synergy™H1 型多功能微孔板检测仪(美国伯腾公司);SW-CJ-2FD型超净工作台(苏州安泰净化设备有限公司);BX53F 型倒置显微镜(日本奥林巴斯公司);5804R型高速冷冻离心机(德国艾本德公司)。
1.3 试药
山楂核购自山东步长制药股份有限公司,并经过陕西中医药大学中药鉴定教研室胡本祥教授鉴定为山楂Crataegus pinnatifidaBge.的干燥成熟种子。
RPMI 1640 培养基(批号:2049224)、胎牛血清(批号:2001003)、胰蛋白酶(批号:2043176)、磷酸盐缓冲液(批号:2031104)均购于Biological Industries公司;酵母提取物(批号:20201118)、蛋白胨(批号:20200918)、麦芽提取物(批号:20200812)和葡萄糖(批号:20200918)均购自北京奥博星生物技术公司;两性霉素B(AMB,批号:K1919038)购自阿拉丁试剂有限公司;N-硝基-L-精氨酸甲基酯盐酸盐(L-NAME,批号:WXBC9273V)和脂多糖(LPS,批号:L4391)来源于大肠杆菌0111:B4,购自Sigma 公司;正构烷烃混合对照品C8~C40(批号:E129360,美国Sigma-Aidrich公司)。
2 方法
2.1 山楂核干馏液的制备与分离
将山楂核1170 g 置于蒸馏釜中,升温至150 ℃保持60 min,以除去水分和挥发性成分。之后,将温度升至270 ℃,收集蒸馏出的液体产物(干馏液)300 g。取干馏液20 g,经D101型大孔吸附树脂色谱柱分离,依次用体积分数为30%、50%、70%的甲醇水溶液和甲醇洗脱,得到4 个流分Fr.A(6 g)、Fr.B(4 g)、Fr.C(1.1 g)和Fr.D(3.3 g)。
2.2 细胞活力检测
将对数生长期的RAW264.7细胞,以1×105个/孔接种于96 孔板中,放置培养箱孵育4 h 后,设置对照组、模型组、阳性药(L-NAME)组、山楂核干馏液组及4 个流分组。对照组加入培养基;模型组加入终质量浓度为1µg·mL-1的LPS;阳性药组加入L-NAME(终质量浓度为26~400 µg·mL-1的5 个梯度)和终质量浓度为1µg·mL-1的LPS;给药组分别加入山楂核干馏液[0.1%二甲基亚砜(DMSO)稀释使终 质量浓度 为3~240 µg·mL-1的7 个梯度]、4 个亚流分(0.1% DMSO 稀释使终质量浓度为2~300µg·mL-1的8个梯度)和终质量浓度为1µg·mL-1的LPS。每个质量浓度设有3 个复孔,培养24 h。弃去上清液,加入噻唑蓝(MTT)0.5µg·mL-1,孵育4 h;弃去上清液,加入DMSO 溶解后,用酶标仪于492 nm 检测吸光度(A)并按照公式(1)计算细胞活性,空白中只加入了培养液。

2.3 一氧化氮(NO)检测
LPS 刺激炎症模型已被广泛用于研究各种天然衍生物的抗炎活性。NO抑制作用已普遍用作抗炎效果的指标,L-NAME是精氨酸的类似物,能抑制NO产生,故用作阳性对照[9]。将RAW264.7 细胞以1×105个/孔接种于96 孔板中,培养过夜。将细胞与质量浓度均同2.2 项下的山楂核干馏液、L-NAME和4个流分孵育2 h,再加入终质量浓度为1 µg·mL-1的LPS 刺激处理20 h,每个质量浓度设有3 个复孔,采用Griess 法检测细胞生成NO 的量,每组实验重复3次。
2.4 抗菌活性测试
AMB 是多烯类真菌抗生素,其通过与真菌细胞膜中的麦角固醇结合,从而改变膜通透性来引起真菌生长停止或者死亡,对白色念珠菌有较强的抑制作用[10],可作为抗菌作用的阳性对照。采用微量稀释法测定AMB、山楂核干馏液和4 个流分的抗菌活性。设置对照组、阳性药组、山楂核干馏液组及4个流分组。取制备好的菌悬液(5×106CFU·mL-1)100µL 分别加入96 孔板中,对照组加入培养基;阳性药组加入AMB 终质量浓度为0.5~75.0 µg·mL-1的8 个梯度;给药组分别加入山楂核干馏液和4 个亚流分(0.1% DMSO 稀释使终质量浓度为0.16~23 mg·mL-1的8个梯度质量浓度),每个质量浓度设有3个复孔,在30 ℃下培养48 h。每孔加入MTT20µL,避光培养4 h,弃上清液,每孔再加入DMSO 150 µL,用酶标仪在492 nm 处测定A,以不加测试样品组为空白对照,每组实验重复3次,按公式(1)计算抗菌活性。
2.5 GC-MS分析
2.5.1 供试品制备 分别称取Fr.A、Fr.B、Fr.C和Fr.D 各10 mg,分别置于4个10 mL量瓶中,再加无水乙醇溶解并稀释至刻度,制得质量浓度为1µg·mL-1的供试品溶液,过0.22µm微孔滤膜,取续滤液,即得。
2.5.2 色谱条件 色谱柱为HP-5MS 型毛细管色谱柱(30 m×250 µm,0.25 µm);载气为氦气;体积流量为1.0 mL·min-1;进样口温度为250 ℃;检测器温度为300 ℃;进样量为2 µL,不分流;升温程序见表1。
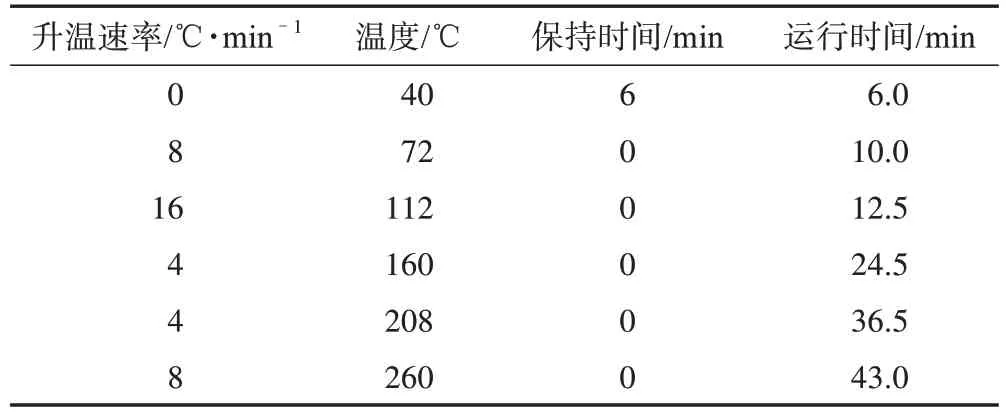
表1 供试品GC-MS升温程序
2.5.3 质谱条件 电喷雾离子源(ESI);离子源温度为250 ℃;四极杆温度为150 ℃;溶剂延迟5 min;质谱扫描模式为全扫描;质量扫描范围m/z45~650;所得数据经美国国家标准与技术研究所数据库2014(NIST 2014)质谱数据库检索匹配,根据匹配度、保留指数及文献已报道物质进行核对。保留指数(RI)的测定采用相同的气相色谱条件测定正构烷烃(C8~C40)的保留时间,按公式(2)计算出4个流分中各挥发性化合物的RI。
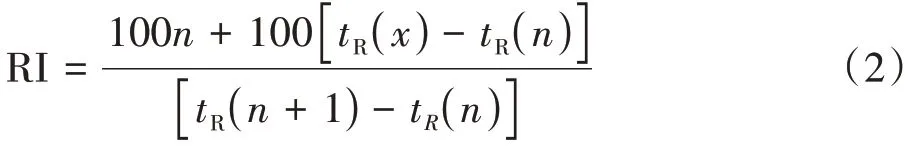
tR(x)、tR(n)、tR(n+1)分别表示待测化合物,含碳数n和碳数n+1 的正构烷烃的保留时间且tR(n)<tR(x)<tR(n+1)。
2.6 灰色关联度分析
2.6.1 原始数据的无量纲化处理 原始数据的变换采用均值变换法。变换的母序列记为{X0(t)},子序列记为{Xi(t)}。将山楂核干馏液4 个流分的抗炎(抗菌)活性的药效指标作为母序列,山楂核干馏液4个流分的特征峰峰面积作为子序列。
2.6.2 绝对差序列及关联系数的计算 在t=k时(k为峰号),母序列记为{X0(k)},子序列记为{Xi(k)},按公式(3)计算母序列与子序列的绝对差序列Δ0i(k)。按公式(4)计算在t=k时母序列与子序列的关联系数η(k)。

m为4个流分,Y0(k)为山楂核干馏液4个流分抗炎(抗菌)药理药效指标;Yi(k)为山楂核干馏液4 个流分各特征峰峰面积归一化数值;k为峰号;ρ为分辨系数,作用是削弱最大绝对差数值的失真,提高关联系数之间的显著性差异,ρ∈(0,1),本实验中ρ取0.5;∣Y0(k)-Yi(k)∣为母序列与子序列的绝对差值;|Y0(k) -Yi(k)|为绝对差值的最小值,又记为Δmin;Y0(k) -Yi(k)|为绝对差值的最大值,又记为Δmax。
2.6.3 关联度的计算 按公式(5)计算关联度(r),r是对时间序列几何关系的比较,是母序列与子序列各个时刻的关联系数的平均值,n为子序列的数据个数。

2.6.4 结果分析 通过Graph pad 8.0 统计学软件处理数据。取4 个流分中化合物的含量为独立变量,4 个流分的50%最低抑菌浓度(MIC50)作为因变量计算关联度。如果灰色关联度分析的值较低,则该化合物对白色念珠菌的MIC50较小,表明其可能具有较强抗菌活性。同理对其抑制NO 生成的活性结果进行分析。
3 结果
3.1 山楂核干馏液和4个亚流分的细胞活性
细胞活力测试结果(图1)表明,当L-NAME质量浓度为269.70µg·mL-1时,与对照组比较,对LPS 刺激的RAW264.7 细胞造成的损伤已经基本恢复,故用作山楂核干馏液细胞活性实验的阳性药组质量浓度;山楂核干馏液在实验范围内(质量浓度不超过240µg·mL-1)时对LPS刺激RAW264.7细胞不产生损伤,L-NAME、Fr.A、Fr.B、Fr.C、Fr.D质量浓度分别不超过404.55、149.50、67.13、16.50、36.69µg·mL-1时对LPS刺激RAW264.7细胞不会造成损伤。同时山楂核干馏液、L-NAME 和4 个亚流分在各自质量浓度范围内对LPS 刺激的RAW264.7细胞造成的损伤尚具有一定的恢复作用。

图1 山楂核干馏液和4个亚流分对LPS刺激的RAW264.7细胞活性的影响(,n=3)
3.2 山楂核干馏液和4个亚流分体外抗炎活性
NO 测试结果(图2)表明,L-NAME 对LPS 刺激的RAW264.7 细胞生成NO 量的半数抑制浓度(IC50)为(193.01±27.66)µg·mL-1,质量浓度为269.70µg·mL-1时NO产生量与模型组相比差异具有统计学意义,结合L-NAME 细胞活性测试结果,选择269.70µg·mL-1作为山楂核干馏液抗炎活性实验的阳性药组质量浓度;山楂核干馏液显著抑制了LPS刺激的RAW264.7 细胞生成NO 的量,其IC50为(31.93±1.95)µg·mL-1,表明山楂核干馏液有较好的抗炎活性。4 个亚流分(Fr.A、Fr.B、Fr.C、Fr.D)对LPS 刺激的RAW264.7 细胞生成NO 均有一定的抑制作用,且呈现剂量依赖性,LPS 刺激的RAW264.7 细胞生成NO的IC50分别为10.86±0.76)、(6.25±0.81)、(5.57±0.70)、(19.20±0.42)µg·mL-1;其中Fr.C 和Fr.B 的IC50均较低,两者抑制LPS 刺激的RAW264.7 细胞生成NO 作用明显强于山楂核干馏液和L-NAME,抗炎活性佳,结合细胞活性测试结果,Fr.C 约从33µg·mL-1开始产生细胞毒性,而Fr.B 约从67.13 µg·mL-1开始产生细胞毒性,综合考虑Fr.B抗炎活性和安全性最佳。

图2 山楂核干馏液和4个亚流分对LPS激活的RAW264.7细胞中NO产生的影响(,n=3)
3.3 山楂核干馏液和4个亚流分体外抗菌活性
体外抗菌实验结果(图3)表明,AMB 抑制白色念珠菌生长的MIC50为(2.65±0.52)µg·mL-1,在其质量浓度为4.69 µg·mL-1时,较2.34 µg·mL-1时的抑菌效果更佳,故作为山楂核干馏液抗菌活性实验的阳性药组质量浓度;山楂核干馏液对白色念珠菌的生长有抑制作用,其MIC50为(2.72±0.03)mg·mL-1,且在测试质量浓度范围内,抑制作用呈现较好的剂量依赖性。Fr.A、Fr.B、Fr.C、Fr.D 对白色念珠菌均具有一定的抑制作用,且呈现剂量依赖性,MIC50分别为(2.98±0.54)、(0.91±0.03)、(3.42±0.13)、(2.40±0.08)mg·mL-1,4 个流分中Fr.B 的抗菌活性最为显著,其抑制白色念珠菌的作用明显强于山楂核干馏液。
3.4 山楂核干馏液亚流分的GC-MS分析结果
为了进一步研究并分析出山楂核干馏液中发挥体外抗炎和抗菌作用的主要有效成分。利用GC-MS测得山楂核干馏液4个亚流分的气相色谱图(图4)。结果发现山楂核干馏液4 个亚流分有12 个共有峰。对抗炎抗菌活性较高的Fr.B 流分谱图进行分析,主要呈现13 个色谱峰,其峰面积总和占到总峰面积的87.67%,具体质谱信息见表2。

表2 山楂核干馏液4个亚流分GC-MS图谱峰的指认结果
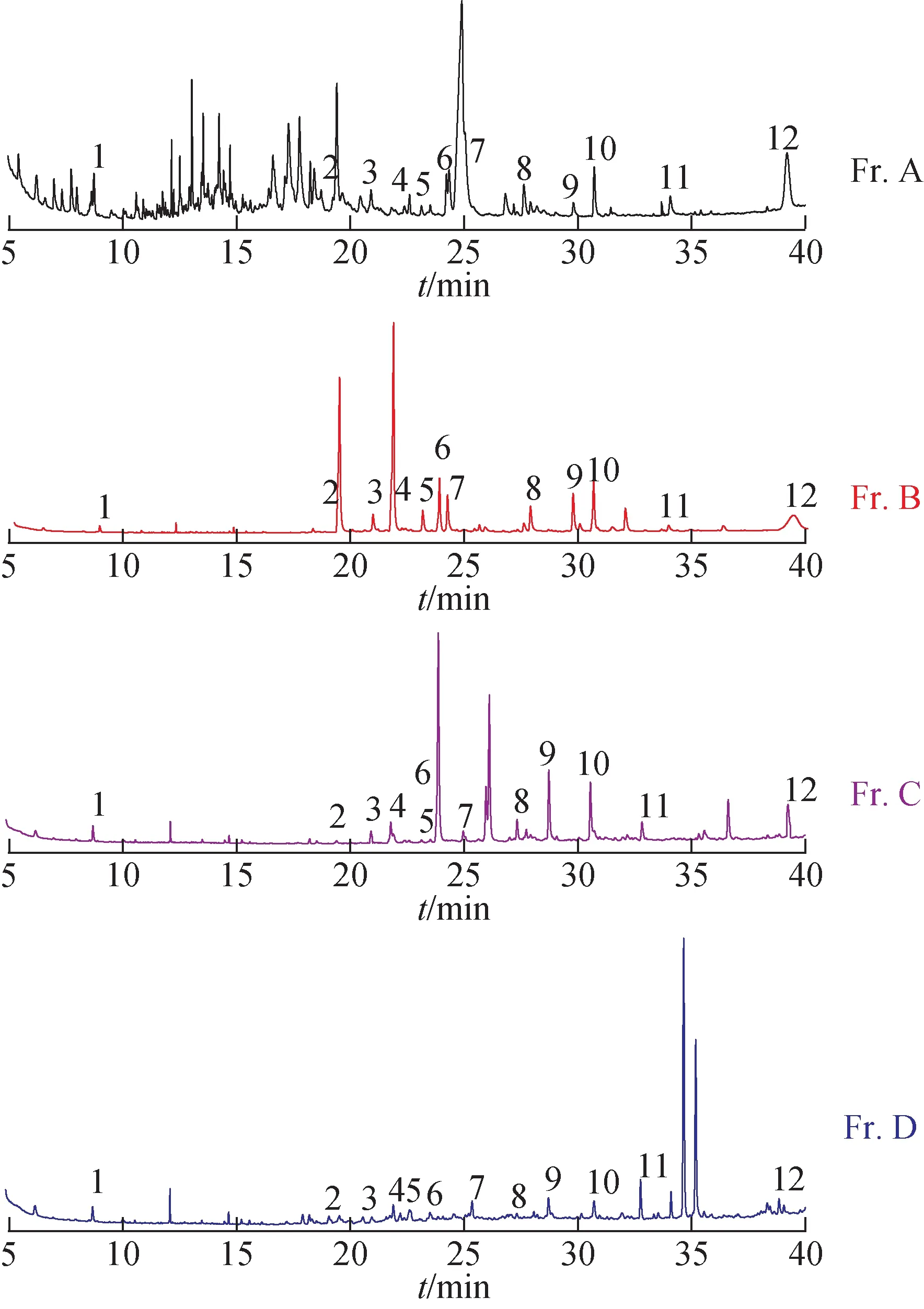
图4 山楂核干馏液4个亚流分的气相色谱图
3.5 山楂核干馏液抗炎灰色关联度分析
采用灰色关联度分析法研究山楂核干馏液中发挥体外抗炎和抗菌作用的主要有效成分。以3.4 项下12 个共有成分峰面积为独立变量,以4 个亚流分抑制LPS 诱导的RAW264.7 细胞生成NO 的作用结果为因变量,进行灰色关联度分析。所选的评价指标与药效呈负相关,r越低,抑制LPS 刺激的RAW264.7 细胞生成NO 的IC50越小,表明该化合物具有较强抗炎活性。结果显示(表3),12 个成分对抗炎作用贡献大小顺序为4>6>2>9>8>3>7>5>11>12>10>1,其中,色谱峰4、6、2 和9 号对山楂核干馏液抗炎作用贡献较大。
3.6 山楂核干馏液抗菌灰色关联度分析
在本研究中所选的评价指标与药效呈负相关,r越低,化合物对白色念珠菌的MIC50较小,表明该化合物具有较强抗菌活性。山楂核干馏液体外抑制白色念珠菌的灰色关联度分析结果(表3)表明,12个成分对抗菌作用贡献大小顺序为4>2>9>11>7>6>5>8>10>12>3>1,其中化合物4、2、9 和11 对山楂核干馏液抗菌作用贡献较大。

表3 抗炎、抗菌活性关联度分析
通过热图对4 个亚流分抗炎和抗菌灰色关联结果进行可视化分析(图5),结果表明,2,6-二甲氧基-4-甲基苯酚、1,2,5-三甲氧基-3-甲基苯、2,6-二甲氧基苯酚和乙酰丁香酮可能是山楂核干馏液抑制LPS 诱导的RAW264.7 细胞生成NO 作用的关键活性成分;2,6-二甲氧基-4-甲基苯酚、2,6-二甲氧基苯酚、乙酰丁香酮和二氢芥子醇可能是山楂核干馏液抑制白色念珠菌的关键活性成分。

图5 山楂核干馏液4个亚流分12个共有峰峰面积与其抗炎IC50和抗菌MIC50活性的热图分析
4 讨论
中药谱效关系研究是将中药化学成分谱图与中药药效活性有机结合,采用相关性分析、灰色关联度分析、主成分分析等多种数学分析模型,可多角度、更全面地进行中药药效物质基础研究、中药质量评价、中药有效部位筛选等[11-14]。灰色关联度分析方法强调因素间相关程度的顺序,其“几何对应”的特点也可使动态指标的原始信息得到充分的利用。该方法对样本数量和数据规律性的要求较低,适用于评价中药化学成分与药效之间的关联程度,筛选功效成分[15-16]。
迄今为止,山楂核干馏液抗炎和抗菌作用的物质基础尚不清楚,本研究中以LPS 诱导的RAW264.7 细胞生成NO 模型评价4 个亚流分的抗炎作用,用微稀释法评估其体外抑制白色念珠菌活性,采用GC-MS 对山楂核干馏液的4 个亚流分进行分析,得到了12 个共有化合物,其中4-乙基-2-甲氧基苯酚可抑制生物膜的形成,从而抑制细菌的生长[17];4-甲氧基-3-羟基苯乙酮具有抗炎活性,可防止醋酸引起的结肠损伤[18];丁香醛是一种酚类化合物,有抑制环氧合酶-2(COX-2)活性的作用,IC50为3.5 µg·mL-1[19]。糠醛还具有多种生物学活性[20],如增加活性氧的形成,对细胞器、核酸和蛋白质造成损害,并干扰微生物的进化[21-22]。此外,其还可以抑制初级代谢中的酶,如乙醇脱氢酶,进而影响白色念珠菌的生长[23]。实验又使用灰色关联度分析法建立化学成分和抗炎抗菌作用的谱效关系,得出山楂核干馏液中各成分对抗菌抗炎作用贡献的大小,并且筛选出山楂核干馏液中2,6-二甲氧基-4-甲基苯酚、1,2,5-三甲氧基-3-甲基苯、2,6-二甲氧基苯酚和乙酰丁香酮4 个成分为其体外抗炎作用的关键活性成分;2,6-二甲氧基-4-甲基苯酚、2,6-二甲氧基苯酚、乙酰丁香酮和二氢芥子醇为其抗菌作用的关键活性成分。其中2,6-二甲氧基苯酚在抑制白色念珠菌的生长中起重要作用,该结果与Rao 等[24]的研究一致。实验结果表明,2,6-二甲氧基-4-甲基苯酚抗炎作用和抗菌作用均较强,因此其可能是治疗霉菌性阴道炎的主要活性化合物,但体内作用有待于进一步实验验证。
本研究结果为阐明山楂核干馏液抗炎和抗菌作用的物质基础及山楂核干馏液质量控制和质量标准的制定提供了科学依据,同时为开发具有抗炎和抗菌作用的山楂核干馏液新产品提供了参考。

