关于乙醇与钠反应产生气体成分的实验探究
陈林






摘要:围绕基本问题“如何探究乙醇与钠反应产生的气体成分”将实验探究分为3个组成部分:制备并收集气体、改进气体检验装置和优选气体净化装置,并依次展开实证研究;实验表明:用注射器作为乙醇与钠反应的简易装置,并在针头位置安装填充浸有酸性K2Cr2O7溶液硅胶的尖嘴导管可以有效地除去气体中的乙醇蒸汽,用CO2传感器可以更准确评估乙醇蒸汽的净化效果从而确定气体的成分。
关键词:实验探究;注射器;CO2传感器;酸性K2Cr2O7溶液
文章编号:1008-0546(2022)02x-0085-04
中图分类号:G632.41
文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.02x.022
一、研究背景
乙醇是必修2“生活中常见的有机物”的典型代表物质,乙醇与钠的反应是乙醇的重要化学性质。人教版新教材必修2中阐述了“在试管内完成乙醇与钠反应,塞上带有尖嘴导管的橡皮塞,然后通过点燃法以检验产生的氢气”的实验方案[1]。该方案能较好地观察乙醇与钠反应部分实验现象,但点燃气体之前须多次验纯,操作较为繁琐。郑志萍和衷明华[2]、李猛和王世存[3]、杨晓洁和程萍[4],谢惠春和李共佳[5],都对乙醇与钠反应的简易装置做了深入研究,分别建议用注射器、青霉素瓶子和尖嘴导管、烧杯和连有针头的干燥管做乙醇与钠反应的微型容器。还有不少研究指出,乙醇与钠反应产生的气体中含有乙醇蒸汽并对吸收乙醇蒸汽的药品做了探究。周如磊[6]建议在反应的试管后分别连接装有水和浓硫酸的试管以除去乙醇蒸汽并干燥气体;吴国锋[7]建议用装有无水CaCl2的干燥管连接在试管上、谢惠春和李共桂[5]提出用浸有酸性重铬酸钾的硅胶填充干燥管,以除去乙醇蒸汽。
以上研究为乙醇与钠反应的实验教学研究奠定了基础,通过重复实验,笔者发现上述改进装置省略了验纯,能很好地解决教材实验中气体不易点燃的问题;但谢惠春和李共佳[5]提出用浸有酸性重铬酸钾的硅胶或无水CaCl2填充干燥管以除去乙醇蒸汽,重复实验的结果却不尽如人意:填充无水CaCl2或浸有酸性重铬酸钾的硅胶后,氢气气流不通畅、点燃获得的火焰极微弱、易熄灭,不能客观评估乙醇蒸汽的净化效果。“科学、严谨地验证乙醇与钠反应产生的气体成分”的问题并未得到妥善解决。
二、研究思路
实验教学是知识教学的一部分,应当承担知识教学的本体价值和素养发展价值[8]。新课标内容要求“以乙醇为例认识有机化合物中的官能团”,“认识乙醇的结构及其主要性质与应用,知道氧化等有机反应类型”。教材中首次提出官能团概念。可见,高一必修阶段乙醇的实验教学,应以发展研究有机物的结构与性质的一般思路为中心,以实验探究乙醇的结构与性质的关系为载体,建立官能团的概念并帮助学生深化对官能团与有机物性质关系的理解。
于乙醇与钠反应而言,则需宏观比较乙醇、水分别与钠反应的实验现象、微观辨析两者结构特点,预测气体产物为氢气并加以实验验证,从而推理出乙醇与乙烷的性质差异是由羟基的存在决定的,进而深入理解官能团对有机物性质的决定作用,发展宏观辨识与微观探析、证据推理、科学探究与创新意识等素养目标。
为落实以上教学功能,可围绕“探究乙醇与钠反应产生的气体成分”中心问题展开实验教学。具体而言,需要回答:如何简便地制备并收集气体?怎样高效地净化气体和可靠地检验气体?等3个子问题。
三、实验研究过程
1.探索易点燃的反应装置
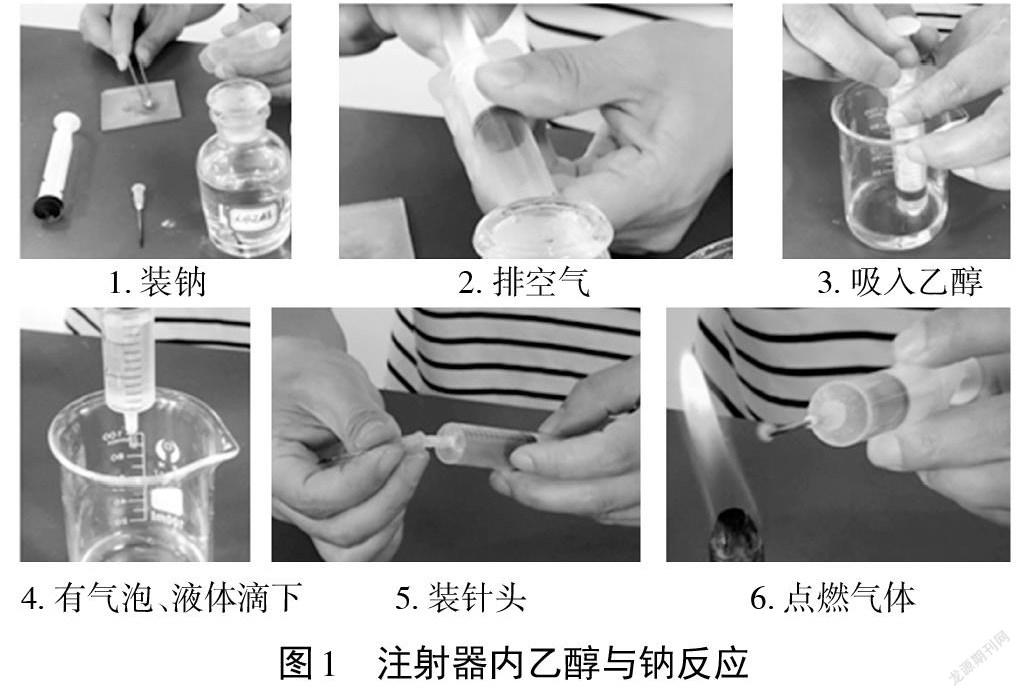
【实验1】用注射器收集乙醇与钠反应产生的气体并点燃(见图1)。
【实验仪器和药品】
无水乙醇、钠、镊子、小刀、滤纸、玻璃片、酒精灯、火柴、100mL烧杯、注射器、针头。
【实验步骤及现象】
(1)取一个10mL的注射器,拔出活塞和针头,向针筒中加入一块刚从煤油中取出并吸干表面煤油、切除氧化层的黄豆大小的金属钠,塞上活塞,推到底以排尽针筒内的空气。
(2)向100mL烧杯中倒入少许无水乙醇,用针筒吸入6mL无水乙醇,发现金属钠表面立即有大量气泡,钠沉入乙醇底部并上下浮动;有液体滴入烧杯内,针筒内液面下降。
(3)待液体排尽后,装上针头;点燃气体,一只手缓慢推动活塞直至底部,气体安静燃烧,火焰呈亮黄色。
【实验结论】用注射器做乙醇与钠的反应容器,相较于试管反应无需验纯、操作简单安全、实验现象显著、成功率高,通过调节推动活塞的速度,可以获得稳定的气流以支持气体的燃烧;且注射器有刻度,通过调节吸入无水乙醇的体积可以控制收集气体的体积,能满足定量分析和比较研究的需求。
另外,还可以选用青霉素瓶子和尖嘴导管、烧杯和连有针头的干燥管作反应容器,但这2种实验方案存在以下现象:随着反应的进行,钠变小,反应速率减慢,气体燃烧的火焰不稳定,甚至钠很大,火焰也会熄灭;若装上净化装置,气流不通畅,难以持续燃烧。故本研究选择注射器作为乙醇与钠的反应装置进行气体成分探究。
2.改进气体的检验装置
【实验2-1】“澄清石灰水”法检验气体燃烧的产物。
【实验仪器和药品】无水乙醇、钠、镊子、小刀、滤纸、玻璃片、酒精灯、火柴、100mL烧杯、注射器、针头、澄清石灰水、胶头滴管。
【实验步骤及现象】用注射器作为反应容器收集产生的气体,点燃气体并在火焰上方罩一个干冷的小烧杯,烧杯内壁有水雾,迅速正立烧杯,加入1mL澄清石灰水,振荡未看到石灰水变浑浊,但是30秒左右石灰水显著变浑浊,见图2。
【质疑】是空气中的CO2使石灰水变浑浊吗?
【验证实验】在培养皿中滴入1mL澄清石灰水,静置,观察实验现象。片刻后,石灰水表層出现“膜”,摇一摇培养皿,变浑浊,见图3。
【实验结论】空气中CO2可以使少许石灰水变浑浊,因而在空气中用少许澄清石灰水来检验可燃性气体燃烧产物中是否含二氧化碳,结论并不可靠。那么转换思路:能否测量点燃气体前后CO2的浓度变化以排除空气中CO2的干扰?
【实验2-2】“CO2传感器”法检验气体燃烧的产物
【实验仪器和药品】无水乙醇、钠、镊子、小刀、滤纸、玻璃片、酒精灯、火柴、100mL烧杯、注射器、针头、CO2传感器、数据采集器、电脑、漏斗、铁架台、导管和橡皮管若干。
【实验步骤及现象】
(1)将CO2传感器、数据采集器、电脑用导管和橡皮管连接在漏斗上,如图4所示,打开朗威DISLab软件,开始采集数据,此时测得数据为空气中CO2的浓度,其值为375ppm左右;
(2)用注射器吸入6mL无水乙醇,与金属钠反应,收集产生的气体;
(3)点燃气体,并将火焰移进已连接好CO2传感器的漏斗下方,同时缓缓推动活塞,使气体持续燃烧;
(4)观察现象:片刻后漏斗有明显“水雾”。CO2传感器数据表明,点燃气体后,CO2浓度陡升至700ppm;火焰熄灭后,CO2浓度缓慢回落至初始值(见图4)。
【实验结论】
(1)点燃后CO2浓度显著增大证明该气体燃烧生成了大量的CO2,间接说明氢气中可能存在大量乙醇蒸汽。若要检验氢气的存在,应该在气体点燃前增加气体净化装置,吸收其中的乙醇。
(2)采用CO2传感器测量CO2的浓度变化,不仅可以排除空气中CO2对氢气检验的干扰,而且测量灵敏、数据可靠,能从CO2浓度的变化了解气体中乙醇含量大小,可以作为评价除去乙醇蒸汽效果的依据之一。
3.优选气体的净化装置
【实验3】比较水、无水CaCl2、酸性K2Cr2O7溶液吸收乙醇蒸汽的效果。
【实验仪器和药品】蒸馏水、无水CaCl2、酸性重铬酸钾溶液(0.5mol/LK2Cr2O7溶液与49%硫酸1∶1混合)、棉花、硅胶、培养皿、短尖嘴导管、生料带和镊子,其余同实验2-2。
【实验因素控制】为比较不同试剂及装置去除乙醇蒸汽的效果,需要控制一些实验要素:
(1)收集相同体积的气体,可通过吸入等体积的乙醇(6mL)与足量钠反应;
(2)使用相同大小的尖嘴导管;
(3)使用同一套CO2传感器装置检测气体燃烧产生的CO2浓度;
(4)气体燃烧时,用相似的速度推送注射器活塞使气体的流速大致相同。
【净化装置的构成】以酸性K2Cr2O7溶液净化装置为例,在尖嘴导管中依次填充干燥的棉花、浸有酸性重铬酸钾溶液的硅胶和棉花。前端干燥的棉花的作用除了干燥氢气以外,还能防止硅胶堵塞尖嘴以致气流不畅,吸收多余溶液,防止推动活塞时有液体喷出使火焰熄灭。后端的棉花主要用于防止试剂或药品堵塞注射器出口,也能吸收部分乙醇蒸汽。无水CaCl2固体和水作净化试剂具体填充方式如图5所示。
【实验步骤】
(1)用注射器吸入6mL无水乙醇与足量金属钠反应并收集气体;
(2)在尖嘴导管中用镊子依次装上干燥的棉花、浸有酸性重铬酸钾溶液的硅胶和棉花,如图6;
(3)待气体收集完毕,将尖嘴导管连接在注射器针头位置;
(4)点燃气体,缓推注射器活塞;立即将火焰移至已连接好CO2传感器等装置的漏斗下方;
(5)观察现象。重复实验2-3次,并录制视频,保存数据;
(6)更换步骤2净化试剂为“水”、“无水CaCl2”,重复实验,比较它们净化乙醇蒸汽的效果,实物图见图6。
【评价指标】
(1)气体燃烧时火焰的颜色与大小;
(2)漏斗上水雾大小;
(3)CO2传感器测得的点燃前后CO2浓度的变化。
其中,CO2传感器测得的数据为定量指标,是评价3种净化装置效果的最为有效的重要依据。
【实验现象及结论】
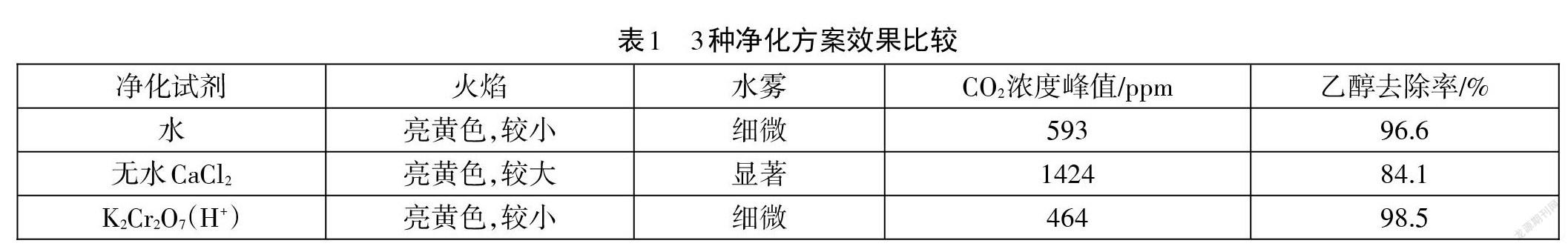
当净化装置填充的是浸有酸性K2Cr2O7溶液的硅胶和棉花时,点燃气体,火焰仍呈亮黄色,但较未加净化装置的小一些,漏斗上有细微水雾;浸有酸性K2Cr2O7溶液的棉花中有气泡,1.5min后橙色的棉花及硅胶转变为灰绿色,这一现象直接证明了气体中乙醇蒸汽的存在;CO2传感器测得其浓度由空气中的366ppm左右,点燃气体后缓慢升高至464ppm,最后缓慢回落,见图7,可见该净化方案乙醇去除率高达98.5%。另外从传感器测得的数据及水雾的程度来看:无水CaCl2去除乙醇的效果不及水理想,二者乙醇去除率分别为84.1%和96.6%。(见表1)
说明:(1)未使用净化装置6mL气体燃烧CO2传感器测得的数据为7000ppm,此时空气中CO2测得的数据为366ppm左右;(2)多次实验操作致使空气中CO2浓度基础值会有稍许上下浮动,实验过程中要静待传感器数值回归366ppm左右开始实验;(3)乙醇去除率计算方法:(7000-安装净化剂后测得CO2浓度峰值)(/7000-366)*100%。
四、教学建议
1.设计实验问题情境,激发认知冲突
没有问题,就没有探究与创新。在探究乙醇与钠反应产生的气体成分的过程中会生成许多真实情境问题,如“乙醇与钠反应生成氢气,为什么其气体燃烧能使澄清石灰水变浑浊?”、“CO2传感器数据表明乙醇与钠反应产生的气体燃烧后产生大量的CO2,为什么?”,教师可深入挖掘、细化问题的发现和分析过程,帮助学生体验真实问题的发现与分析过程,强化问题意识,走好探究的第一步。
2.实验操作与证据推理并重
实验教学中教师不仅要关注学生的实验操作过程及水平,更要带领学生体验如何将实验方案设想转变为实验事实,如何处理预设与证据之间的“冲突”;基于证据的分析推理过程应注重思维的科学性、严谨性及系统性,当证据不足时,如何创造条件以获取证据。实验中实验操作与科学思维紧密结合、相互促进,使探究步步深入、引人入胜,促进实验深度教学的发生。
3.以评价促反思,以反思促创新
客观地记录数据并进行比较评价,能帮助我们更好地反思实验过程,有利于发现问题并培养创新意识。比如为了获得更客观地数据,比较不同净化试剂对乙醇蒸汽的净化效果,研究中对每一个试剂的净化实验都采用多次实验并录制视频加以观察的方式。只有认真地落实科学探究中的基于证据的评价与反思,才能将实验中的问题意识和创新意识的孕育落到实处!
五、遗留问题
经反复实验,发现:不论乙醇与钠反应产生的氢气是否经过净化,其燃烧的火焰均呈亮黄色,而非淡蓝色;浸有酸性重铬酸钾溶液的棉花或滤纸条在实验室环境中放置的过程中会自发缓慢变成绿色,其变色比直接与乙醇作用要慢,而浸泡在酸性重铬酸钾溶液的硅胶却不易变色。这些问题仍值得我们进一步探讨与研究。
参考文献
[1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中教科书(化学必修第二册)[M].北京:人民教育出版社,2019.
[2]郑志萍,衷明华.无水乙醇与金属钠反应的微型实验改进[J].中学化学教学参考,2016(18):64.
[3]李猛,王世存.用微型化实验探究乙醇和金属钠的反应[J].中小学实验与装备,2015,25(4):19-20.
[4]杨晓洁,程萍.数字化实验与化学教学的融合[J].化学教与学,2017(10):80-84.
[5]谢惠春,李共佳.乙醇与金属钠反应的实验改进[J].广州化工,2019(6):139-141.
[6]周如磊“.乙醇与钠的反应”实验改进[J].化学教育,2011,32(6):60.
[7]吴国锋.乙醇与金属钠反应实验的改进[J].化学教学,2011(3):41.
[8]肖中荣,周萍.再談碳酸钠和盐酸反应的实验改进[J].化学教学,2019(10):57.
2930500520216

