百香果茎基腐病病原菌鉴定及其生物学特性
黄艳花,宁 平,黄远光,欧善生,张燕杏,覃潮妮,蒙 成
(1. 广西农业职业技术大学,南宁 530007;2.广西梧州市长洲区倒水镇农业技术推广站,广西 梧州 543006)
【研究意义】百香果(PassifloraedulisSims)学名西番莲,为西番莲科西番莲属热带、亚热带多年生常绿藤本浆果类果树,具有很高的营养价值和药用价值[1-2]。近年来,随着百香果种植年限的延长和规模的不断扩大,百香果茎基腐病也在逐年蔓延,个别果园发病率、死亡率达80%~90%,造成果园缺株严重、园相零乱、挂果面少、产量低[3]。笔者于2020年4—8月深入广西5个生态区10个百香果种植基地开展田间调查,发现该病发病率较重,部分一年生果园发病率在30%以上,连作果园病株死亡率达50%~60%,多地已出现因该病蔓延而导致荒废的果园。百香果茎基腐病的病原菌研究目前虽有相关报道,但研究结果不一致,不同地区病原菌种类存在差异。因此,鉴定百香果茎基腐病病原菌及分析其生物学特性,对百香果茎基腐病的科学防控及广西百香果产业持续快速发展具有重要意义。【前人研究进展】近年来,我国已有不少研究人员开展百香果茎基腐病病原菌鉴定研究,但研究结果不尽相同。黄盈等[4]、陈星等[5]分别进行福建和广西防城港西番莲茎基腐病病原菌鉴定,并确定该病原菌为尖孢镰孢菌(FusariumoxysporumSchlecht)。李德福等[6]将福建、宋晓兵等[7]将广东的西番莲茎基腐病病原菌鉴定为腐皮镰孢菌[F.solani(Mart) Sacc]。詹儒林等[8]将海南琼海西番莲茎基腐病病原菌鉴定为烟草疫霉菌(PhytophthoranicotianaeBreda de Haan)。邱金忠[9]研究认为,百香果茎基腐病病原菌单独或与多种病原菌联合侵染导致植株茎基部和根部腐烂,其中镰刀菌(Fusarium)和腐霉菌(Pythium)为主要病原菌。林泗海等[10]、黎静[11]研究发现,百香果茎基腐病的病原菌为茄镰刀菌。在发病规律研究方面,林泗海等[10]调查发现,百香果茎基腐病在3—12月均可发生为害,发病高峰期在5—7月,该时期的高温高湿为病菌繁殖提供了有利气候条件。李德富等[12]调查认为,高温、高湿季节加上不良环境条件、不适栽培管理措施及种植感病品种是百香果茎基腐病发生的主要因素。黄志巧等[13]研究发现,65%代森锌和80%多菌灵对西番莲茎基腐病防控均具有显著效果;林泗海等[10]研究表明,于百香果茎基腐病发病高峰期,在植株根颈部涂抹或淋施70%甲基托布津可湿性粉剂500倍液,每10~15 d防治1次,连续防治3次,可有效预防和控制百香果茎基腐病的发生和蔓延为害;黎静[11]研究提出,百香果茎基腐病的综合防治技术包括正确选择种植地、进行科学化管理、科学选择种植品种、及时清理病死植株和及时进行药剂防治等。【本研究切入点】至今,在广西不同生态区开展百香果茎基腐病病原菌及生物学特性鉴定研究鲜见报道,对引致百香果茎基腐病的主要病原菌仍未明确。【拟解决的关键问题】通过百香果茎基腐病病原菌分离、形态特征观察、致病性测定和rDNA-ITS序列分析,对百香果茎基腐病病原菌及其生物学特性进行鉴定,以明确引致百香果茎基腐病的病原菌及其生物学特性,为百香果茎基腐病的科学防控提供理论依据。
1 材料与方法
1.1 试验材料
试验于2020年4—8月在广西农业职业技术大学进行。于广西百香果茎基腐病发生高峰期,分别从广西梧州市、来宾市、上林县、都安县和南宁市郊区等百香果种植基地采集症状典型、病斑新鲜的台农1号百香果茎基腐病病株带回实验室,用于病原菌分离。
1.2 试验方法
1.2.1 病原菌分离与纯化 采用植物病原真菌常规分离法进行病原菌分离[14]。切取百香果病株茎基部病健交界处的组织块,经75%酒精消毒1 min、5%次氯酸钠消毒3 min、无菌水漂洗4次后接种至PDA培养基,置于28 ℃恒温培养,培养1~2 d长出菌丝后,挑取菌落边缘接种至PDA培养基进行纯化,获得的纯培养物保存于PDA斜面培养基上,4 ℃保存备用。
1.2.2 病原菌致病性测定 茎节离体接种:将纯化保存的病原菌活化后接种至PDA培养基上28 ℃培养3 d,用直径6 mm的打孔器打取菌丝块。剪取长势一致的健康百香果茎节,先用无菌水清洗干净,75%酒精浸泡2 min滤干,待表面残留的水分干后,用一次性医用针头轻扎3个距离小于1 cm孔,然后挑取制备好的菌丝块置于刺伤部位,带菌丝的面接触枝条,置于铺有3层纱布保湿的瓷盆,用保鲜膜密封后28 ℃恒温培养。接种发病后从病斑上再次分离病原菌。
植株活体接种:分别选择在苗圃扦插培育的3月龄健康小杯苗及6月龄健康盆栽苗(品种均为紫香),将纯化保存的病原菌活化后接种至PDA培养基上28 ℃培养3 d,用一次性医用针头刺伤茎基部的表皮数处,以直径6 mm的打孔器打取菌丝块接种至伤口处,用医用脱脂棉浸泡无菌水后缠绕接种部位,外包保鲜膜保湿,接种后每天淋水保湿7 d。设3次重复,每重复接种5株植株,以不带菌的PDA培养基块为对照组,待发病后重新分离病原物,进行柯赫氏法则验证。
1.2.3 病原菌鉴定 形态学鉴定:将直径5 mm的菌丝块接种在PDA培养基上,置于28 ℃光照培养箱恒温培养,观察、描述菌落颜色和形态,定期观察菌落生长情况,在光学显微镜下观察病原菌的菌丝和孢子形态,查阅真菌分类鉴定工具书,初步确定病原菌分类地位。
分子生物学检测:提取病原菌基因组DNA、PCR扩增、测序及比对委托广西南宁国拓生物科技有限公司完成。病原菌DNA采用Biospin真菌基因组DNA提取试剂盒提取,采用真菌生物核糖体DNA通用引物ITS1 5′-TCCGTAGGTGAACCTGCGG-3′和ITS4 5′-TCCTCCGCTTATTGATATGC-3′对rDNA-ITS区域进行PCR扩增。PCR反应程序:95 ℃预变性3 min;95 ℃ 15 s,56 ℃15 s,72 ℃ 30 s,进行35个循环;72 ℃延伸5 min。将测序及拼接结果在NCBI中进行BLAST比对,用DNA序列检索其匹配序列,进行同源性比较。以近缘菌株构建系统发育进化树,确定病原菌的分类地位。
1.2.4 病原菌生物学特性观测 温度、光照和pH对菌丝生长的影响:参考朱迎迎等[15]的方法,将病原菌接种于PDA培养基上,分别置于5、10、15、20、25、28、30、35和40 ℃培养箱培养40 h,以十字交叉法测量菌落直径,计算菌丝生长量;将病原菌接种于PDA培养基上,进行全黑暗(0 lx)、半光半暗(200 lx 12 h/0 lx 12 h)和全光照(200 lx)3种光照环境处理,全黑暗处理使用4层锡箔纸包裹遮光,置于30 ℃恒温培养40 h,测定菌落直径;用盐酸和氢氧化钠溶液将PDA培养基的pH分别调配为3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00和11.00,将病原菌接种其上,置于30 ℃恒温培养40 h,测定菌落直径。每处理均为4次重复。
培养基对菌丝生长的影响:参考梁萍等[16]的方法并略加修改,制备PDA培养基(马铃薯200.0 g、葡萄糖20.0 g、琼脂20.0 g、水1000.0 mL)、Czapek培养基(硝酸钠3.0 g、磷酸氢二钾1.0 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸铁0.01 g、蔗糖30.0 g、琼脂20.0 g、水1000.0 mL)、OA培养基(燕麦片30.0 g、琼脂20.0 g、水1000.0 mL)、CMA培养基(玉米粉30.0 g、琼脂20.0 g、水1000.0 mL)、汁液培养基(健康新鲜百香果枝叶200.0 g,水熬煮30 min,琼脂20.0 g,水1000.0 mL)和WA培养基(琼脂15.0 g,补足水至1000.0 mL)。上述6种培养基的pH自然。将病原菌分别接种于上述培养基上,置于30 ℃恒温培养40 h,测定菌落直径。每处理4次重复。
碳和氮源对菌丝生长的影响:参考胡美姣等[17]的方法并略加修改,以Czapek培养基为基础培养基(硝酸钠3.0 g、磷酸氢二钾1.0 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸铁0.01 g、蔗糖30.0 g、琼脂20.0 g、水1000.0 mL),分别用等质量的麦芽糖、乳糖、葡萄糖、D-果糖、D-木糖、木糖醇、甘露醇、山梨醇、甘油和淀粉置换蔗糖,配制成10种含不同碳源的培养基;用等质量的L-精氨酸、DL-丙氨酸、L-赖氨酸、甘氨酸、氯化铵、磷酸二氢铵、牛肉膏、酵母粉、蛋白胨和尿素置换硝酸钠,配制成10种氮源的培养基,并设无碳源、无氮源培养基为对照。挑取直径为6 mm的菌饼接种至上述不同碳、氮源培养基平板中央,置于30 ℃恒温暗培养40 h,采用十字交叉法同时测定各处理的菌落直径。每处理4次重复。
致死温度测定:预备试验取菌饼置于含5.0 mL灭菌水的离心管中,分别于40、45、50、55、60和65 ℃恒温水浴10 min,取出菌饼置于PDA培养基上30 ℃倒置培养2 d,观察有无菌丝生长。按相差1 ℃再试验,最终确定致死温度。
1.3 统计分析
试验数据采用Excel 2010进行整理,以Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 百香果茎基腐病病害症状及发病情况
受茎基腐病病原菌为害的百香果植株初期茎基部皮层呈暗黑色、水渍状、腐烂,后逐渐扩展至韧皮部和木质部,病部组织易与木质部分离,剥开皮层后木质部也有湿腐现象。为害轻时植株仍能正常生长,当形成腐烂圈时,叶片失水萎蔫,此时叶片仍为绿色,根系完好,最后病斑逐步在茎部向上、向下扩展,导致整株植株茎枝褐色干腐,萎蔫死亡。在病部看到明显的黑色小颗粒即为病原菌分生孢子器。
2.2 百香果茎基腐病病原菌致病性测定结果
在实验室对采自广西各百香果种植基地的典型百香果茎基腐病症状植株病部进行分离,均分离到同一形态真菌,命名为32-WUB3菌株。菌株离体接种致病性测定结果(图1-A,1-C)显示,接种1 d后,百香果接种部位开始出现水渍状病斑,随后病斑沿茎部呈条形扩展,最后整条枝条腐烂,而对照百香果枝条的茎节无发病症状;发病后从病斑上再次分离获得与接种病原菌相同的菌株;菌株活体3月龄小杯苗和盆栽6月龄大苗接种致病性测定结果(图1-D~G)显示,接种3 d后,接种部位开始出现暗黑色、水渍状腐烂,接种5~7 d植株叶片失水萎蔫,10~15 d后整株萎蔫枯死,在病部看到明显的黑色小颗粒即为病原菌分生孢子器,而对照组植株健康,无感病症状出现(图1-H);植株发病后从病斑上再次分离获得的病原菌其菌落形态及菌体特征与接种病原菌完全一致。
2.3 百香果茎基腐病病原菌的形态特征及分类地位
2.3.1 形态学特征 32-WUB3菌株在PDA培养基上于28 ℃条件下培养,菌丝生长迅速,36~48 h可铺满整个培养皿(d=90.00 mm),初期生长稀疏,呈白色至灰白色,气生菌丝发达呈放射状,菌落圆形或近圆形,边缘整齐,背面白色(图2-A),后期菌丝逐渐变为灰黑色至黑色,背面黑色(图2-B),有时呈束状直立生长(图2-C);在PDA培养基上产孢极少,在OA培养基(图2-D)、田间和回接病原菌的发病植株(图1-G)上肉眼可见黑色粒状小点,在显微镜下可见分生孢子器;分生孢子器近球形或不规则形,黑色,分生孢子椭圆形或卵形,初期单胞无色,老熟后呈褐色,近中部有一个横隔膜(图2-E,2-F),其大小为(21.28~28.50)μm×(12.30~16.10)μm,平均为25.23 μm×14.01 μm。根据菌落及分生孢子形态学特征,参考现有的文献[21]初步将32-WUB3菌株鉴定为子囊菌门座囊菌纲葡萄座腔菌目葡萄座腔菌科毛色二孢属(Lasiodiplodia)。
2.3.2 分子生物学鉴定结果 对32-WUB3菌株进行PCR扩增,采用双向测序并进行拼接,将病菌的rDNA-ITS序列测序结果在NCBI中进行BLAST比对,结果发现所测序列与可可毛色二孢菌(L.theobromae)相关序列的相似性达99%。查找相似物种的同一基因序列,使用MEGA 6.0对相似性较高的菌株及同属不同种菌株进行聚类,构建系统发育进化树,结果(图3)表明,32-WUB3菌株与L.theobromaeIRNBS73(MN634044.1)菌株聚在同一分枝上,进一步证实可可毛色二孢菌是百香果茎基腐病的病原菌。
2.4 百香果茎基腐病病原菌的生物学特性
2.4.1 不同温度、光照和pH下的菌丝生长特性 从图4可看出,菌丝在10~35 ℃均可生长,在10~28 ℃的生长速度随着温度的升高而提高,在28~35 ℃的生长速度随着温度的升高而降低,低于10 ℃和高于35 ℃时菌丝生长均受到严重抑制,温度为5和40 ℃时菌丝不生长。其中,菌丝在28和30 ℃时生长较快,菌落直径分别为8.27和8.31 cm,二者差异不显著(P>0.05,下同),但均极显著高于其他温度条件下的菌落直径(P<0.01,下同);在25 ℃条件下菌丝生长也较快,其菌落直径极显著高于除28和30 ℃条件外其他温度条件下的菌落直径。说明32-WUB3菌株的菌丝生长最佳温度为28~30 ℃。
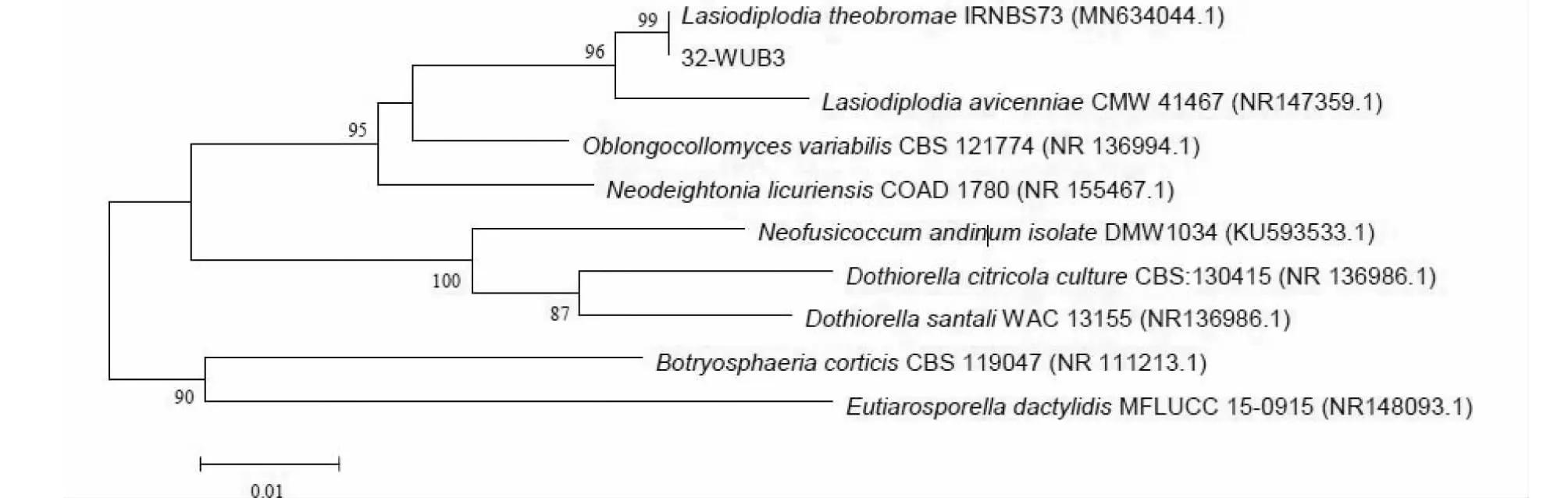
图3 基于rDNA-ITS序列构建的32-WUB3菌株系统发育进化树Fig.3 Phylogenetic tree of 32-WUB3 strain constructed based on rDNA-ITS sequence
从图5可看出,32-WUB3菌株对光照条件敏感,其中,在全光照条件下生长最快,菌落直径达8.49 cm,极显著高于全黑暗条件下的菌落直径,显著高于半光半暗条件下的菌落直径(P<0.05,下同);在半光半暗条件下的菌落直径为8.13 cm,显著高于全黑暗条件下的菌落直径;在全黑暗条件下生长最慢,菌落直径仅6.97 cm。说明全光照是最适宜32-WUB3菌株菌丝生长的光照条件。
从图6可看出,32-WUB3菌株对pH的适应范围较广,其中,在pH 3.00~11.00时菌丝均可生长,在pH 3.00~8.00时菌丝生长较快,菌落直径达8.10~8.44 cm,各pH处理间差异不显著,但均显著或极显著高于pH 9.00~11.00处理的菌落直径;pH 9.00和pH 10.00条件下的菌落直径分别为7.17和7.09 cm,二者间无显著差异,但均极显著高于pH 11.00时的菌落直径(2.83 cm)。说明最适宜32-WUB3菌株菌丝生长的pH为3.00~8.00。
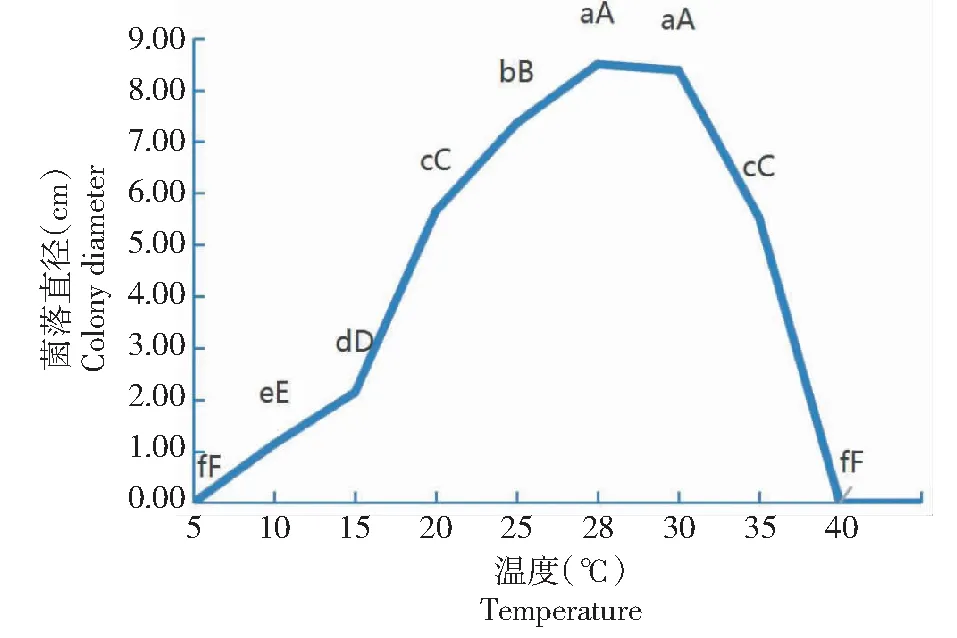
图4 不同温度对32-WUB3菌株菌丝生长的影响Fig.4 Effects of different temperature on mycelial growth of 32-WUB3 strain
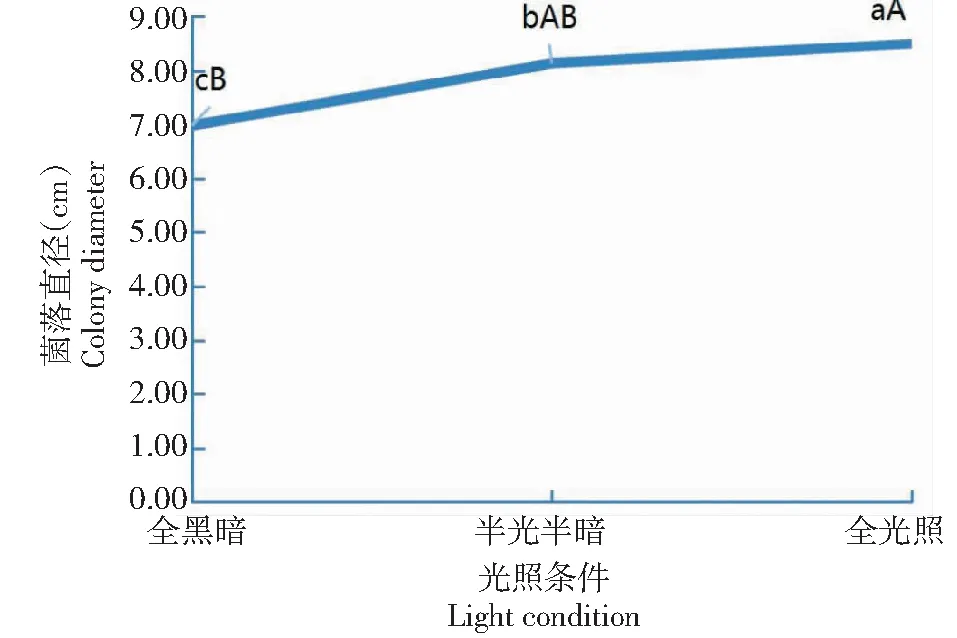
图5 光照条件对32-WUB3菌株菌丝生长的影响Fig.5 Effects of light condition on mycelial growth of 32-WUB3 strain
2.4.2 菌丝在不同培养基中的生长特性 从图7可看出,32-WUB3菌株在6种培养基中均能生长,其中,在PDA培养基中生长最快,菌落直径达9.00 cm,极显著高于其他培养基的菌落直径;其次为OA培养基,其菌落直径极显著高于除PDA培养基外的其他培养基;在CMA培养基中菌丝生长最慢,其菌落直径均极显著小于其他培养基。说明PDA培养基是最适宜32-WUB3菌株菌丝生长的培养基。
2.4.3 菌丝在不同碳和氮源中的生长特性 从图8可看出,32-WUB3菌株在10种碳源上均可生长,但菌丝生长速度在不同碳源间存在差异。其中,以葡萄糖为碳源时菌丝生长最快,菌落直径达7.78 cm,显著高于其他碳源的菌落直径;菌丝生长较快的碳源依次有D-果糖、甘油和山梨醇,其菌丝生长状况较佳,菌落直径在4.98~6.39 cm,相互间无显著差异;以D-木糖、乳糖、木糖醇和麦芽糖为碳源时
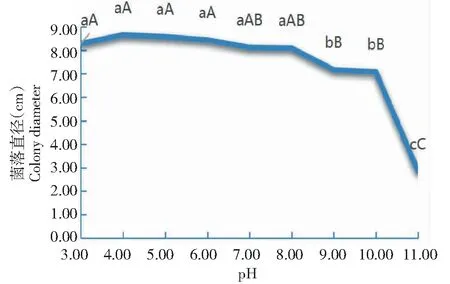
图6 不同pH对32-WUB3菌株菌丝生长的影响Fig.6 Effects of different pH on mycelial growth of 32-WUB3 strain
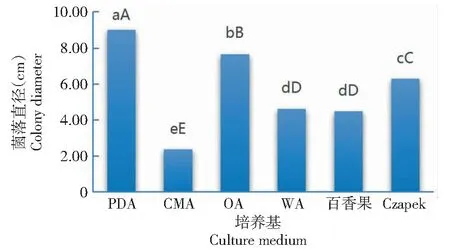
图7 不同培养基对32-WUB3菌株菌丝生长的影响Fig.7 Effects of different medium on mycelial growth of 32-WUB3 strain
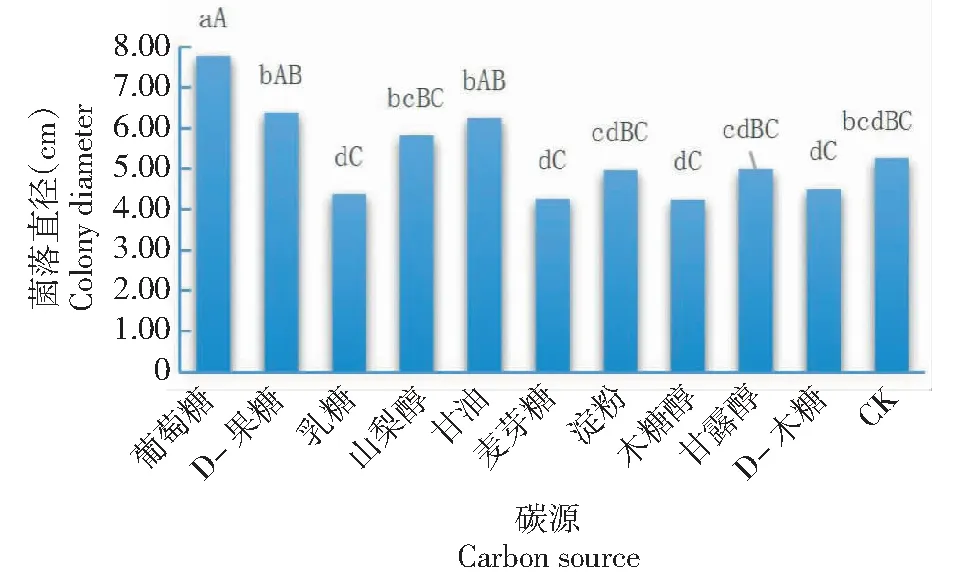
图8 不同碳源对32-WUB3菌株菌丝生长的影响Fig.8 Effects of different carbon source on mycelial growth of 32-WUB3 strain
菌丝生长较慢,菌落直径均低于4.60 cm,相互间无显著差异,但均与以D-果糖、甘油和山梨醇为碳源的菌落直径存在显著或极显著差异。说明葡萄糖是最适宜32-WUB3菌株菌丝生长的碳源。
从图9可看出,菌株32-WUB3在10种氮源上均可生长,但菌丝在不同氮源上的生长速度存在差异。其中,菌丝在以酵母粉、蛋白胨、DL-丙氨酸、L-精氨酸和甘氨酸为氮源时菌落生长较快,菌落直径均高于6.00 cm(尤其以酵母粉为氮源的菌落直径达7.13 cm),且相互间无显著差异,但均显著或极显著高于以牛肉膏为氮源的菌落直径,极显著高于以尿素、磷酸二氢铵、氯化铵、L-赖氨酸和CK为氮源的菌落直径;在以牛肉膏为氮源时菌丝生长也较好,菌落直径为5.13 cm,显著高于以尿素、磷酸二氢铵、氯化铵、L-赖氨酸和CK为氮源的菌落直径;在以尿素、磷酸二氢铵、氯化铵、L-赖氨酸和CK为氮源时菌丝生长较慢,菌落直径均小于3.50 cm,且相互间无显著差异。说明酵母粉是最适宜32-WUB3菌株菌丝生长的氮源,其次为蛋白胨、DL-丙氨酸、L-精氨酸和甘氨酸。
2.4.4 病原菌的致死温度测定结果 菌株32-WUB3的病原菌分别经40、45和50 ℃处理10 min仍能在PDA培养基上生长,而在55 ℃及以上温度时不能生长。再以50、51、52、53和54 ℃进行测试,结果发现在52、53和54 ℃时培养皿中未见长出菌丝。因此,确定该病原菌的致死条件为52 ℃处理10 min。
3 讨 论
本研究对采自广西不同生态区百香果种植基地的百香果茎基腐病病株的病菌进行形态特征观察、致病性测定和分子鉴定等,首次发现可可毛色二孢菌是百香果茎基腐病的病原菌。该病原菌主要为害百香果成株期茎基部,严重时从茎基部向茎秆上部扩展蔓延;人工接种可侵染百香果苗茎基部,导致百香果苗整株叶片在短期内失水萎蔫、下垂,茎基部皮层呈暗黑色、水渍状腐烂,后逐渐扩展至韧皮部和木质部,最后病斑逐渐从茎部向上扩展,导致整株植株茎枝褐色干腐,最后整株彻底枯死。可可毛色二孢菌是一种重要的植物病原菌,可导致热带、亚热带地区植物发生病害,包括茶树、橡胶树、猕猴桃和春芋叶斑病[18-21],桉树、白木香、肉桂枝枯病[22-24]、南洋楹溃疡病[25]、栾树裂皮病[26]和毛葡萄穗轴褐腐病[27],造成巨大经济损失。
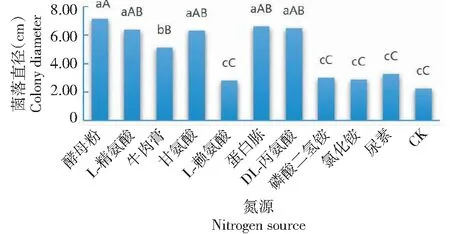
图9 不同氮源对32-WUB3菌株菌丝生长的影响Fig.9 Effects of different nitrogen sources on mycelial growth of 32-WUB3 strain
本研究结果表明,百香果可可毛色二孢茎基腐病病原菌喜高温不喜低温,温度低于10 ℃难以生长,在35 ℃时仍然生长良好,最适宜生长温度为28~30 ℃,与戴利铭等[19]报道的橡胶树叶斑病可可毛色二孢菌相似,与该病易在5—7月大发生的发病规律[10]相符,说明该菌是一种高温适生菌,容易造成百香果发病急、发病重,防治难度大,因此,生产上应采取预防为主、综合防治的防控措施;该菌生长的pH范围与薛振南等[24]的报道相似,适宜生长的pH范围较广,pH为3.00~8.00时均能良好生长,土壤和雨水的pH均不会阻碍其侵染和传播;该病菌菌丝生长的最适合光照条件为全光照,在半光半暗条件下也能生长良好,全黑暗环境不利于其病原菌侵染,与石金巧等[20]报道的猕猴桃叶斑病致病病原菌可可毛色二孢菌最适光照条件一致;可可毛色二孢茎基腐病病原菌对营养要求不高,很多能培养真菌的培养基和碳、氮源均能满足其生长需求,其中,菌丝生长的最适培养基为PDA培养基,最适碳源为葡萄糖,与戴利铭等[19]报道的橡胶树叶斑病可可毛色二孢菌相似,其次为D-果糖、甘油和山梨醇,以D-木糖、乳糖、木糖醇和麦芽糖为碳源时,菌丝生长较缓慢;最适氮源为酵母粉,与石金巧等[20]对猕猴桃叶斑病致病病原菌可可毛色二孢菌的研究结果一致,其次是蛋白胨、DL-丙氨酸、L-精氨酸和甘氨酸,以尿素、磷酸二氢铵、氯化铵和L-赖氨酸为氮源时菌丝生长较缓慢;百香果可可毛色二孢茎基腐病病原菌菌丝致死温度条件为52 ℃处理10 min,与戴利铭等[19]报道的橡胶树叶斑病可可毛色二孢菌相似。
本研究明确可可毛色二孢菌为百香果茎基腐病的病原菌,并对其生物学特性进行了探究,但可可毛色二孢菌在百香果上的发生规律和防治技术还需进一步观察分析。
4 结 论
可可毛色二孢菌是百香果茎基腐病的病原菌,适宜其菌丝生长的温度为28~30 ℃,pH为3.00~8.00,光照条件为全光照,最佳培养基为PDA,最佳碳源为葡萄糖,最佳氮源为酵母粉,其致死条件为52 ℃处理10 min。

