不同基因型水稻适应低磷和水分胁迫的生理调控特征
田 仓,吴龙龙,张 露,黄 晶,朱练峰,虞轶俊,张均华,武美燕,曹小闯,金千瑜
(1.长江大学农学院湿地生态与农业利用教育部工程中心,湖北 荆州 434025;2.中国水稻研究所水稻生物学国家重点实验室,杭州 311400;3.浙江省耕地质量与肥料管理总站,杭州 310020)
【研究意义】磷是植物生长发育所必需的大量营养元素之一,在能量传递、信号传导、光合作用、酶促反应、物质代谢和抗逆调控中起着重要的作用[1]。但是,由于土壤中磷的移动性差和扩散速率低等特性,造成磷易被土壤固定、生物有效性低[2],磷肥当季利用效率只有5%~20%[3],造成了严重资源、环境和健康压力。适宜的水分管理能够促进土壤磷形态转化及其向根表迁移,并可通过“蒸腾流”提高养分的吸收和运输效率[2];而磷营养也能够通过提高植物对干旱适应性及其水分利用效率提高作物产量[5]。同时,水分与磷素在提高作物水分和磷利用效率过程中存在显著的互作机制。【前人研究进展】水稻在长期的进化过程中,可主动形成了一套高效吸收利用磷素的生理和分子调控机制,如构建良好根系形态结构以扩大对外部磷的吸收;促进根际环境有机磷的水解,增强水稻根系对磷的高效吸收利用;改变体内各生理反应适应低磷胁迫,提高自身的磷利用效率[6-7]。生理水平上,低磷和水分胁迫显著诱导水稻体内MDA升高、活性氧代谢失衡,导致细胞膜脂过氧化,抑制水稻的生长发育[8-9]。水稻可通过提高体内脯氨酸含量、增强体内抗氧化保护酶(SOD、POD、CAT)活性,来维持细胞膜的稳定性和提高植株的抗胁迫能力,减轻逆境胁迫伤害[10]。前人通过对水稻[11]、小麦[12]、玉米[13]、大豆[14]等研究发现,低磷胁迫可显著抑制植株根系、地上部干重及总重;且水分胁迫下,水稻可以通过磷营养改善根系水分,提高根部水势,增加蒸腾蒸发量进而促进地下部生长和磷吸收[15]。郭玉春和李永夫等[16-17]研究表明,缺磷条件下水稻可通过显著提高根系酸性磷酸酶含量促进土壤磷酸盐溶解,增加土壤有效磷含量。【本研究切入点】水稻生长发育受品种遗传背景和环境条件的共同影响。前期研究发现,与粳稻“Nipponbare”(Nip)相比,籼稻“Kasalath”(Kas)根中特有耐缺磷基因Pstol1可通过促进水稻根系生长、提高磷吸收和耐低磷胁迫适应能力[33]。当前,人们对不同基因型水稻低磷和水分胁迫响应特征仍不清楚,进一步了解水稻适应性调控机制可为在缺磷土壤中筛选磷高效水稻品种提出新的理论依据。【拟解决的关键问题】采用水培培养方法,研究不同磷水平和水分胁迫对不同基因型水稻生长发育、磷吸收利用的影响及其适应性生理调控特征,以期为通过抗逆新品种选育提高集约化稻田水磷资源利用效率提供理论依据。
1 材料与方法
1.1 试验设计
以粳稻“Nipponbare”(Nip)、籼稻“Kasalath”(Kas)和旱稻502(Uplandrice,U502)为供试材料,水稻种子在 30 ℃ 恒温培养箱中催芽48 h,然后置于人工气候室生长。试验采用水培培养法,待幼苗长到3叶期(10~14 d)时采用1/2浓度营养液培养,3 d后采用完全营养液培养。营养液组成如下:1.43 mmol/L NH4NO3(2.86 mmol/L N)、0.32 mmol/L KH2PO4、0.34 mmol/L K2SO4、1.00 mmol/L CaCl2、1.70 mmol/L MgSO4、 9.10 μmol/L MnCl2、0.52 μmol/L (NH4)6MoO24、18.00 μmol/L H3BO3、0.15 μmol/L ZnSO4、0.16 μmol/L CuSO4、36.00 μmol/L FeCl3和70.00 μmol/L 柠檬酸。继续培养7 d后,进行不同磷浓度和水分处理,试验设 2个磷水平,即低磷(Low P-LP,0.016 mmol/L)、正常磷(Normal P-NP,0.32 mmol/L),除磷外其它营养元素完全相同;2个水分处理,以10% PEG 6000 模拟中度水分胁迫(PEG,约-0.33 MPa),以不加10% PEG 6000 营养液为非水分胁迫对照处理。采用1 L塑料桶培养,每桶种5株,以海绵固定水稻幼苗,每处理种植5桶。水稻幼苗置于人工气候室中,白天/晚上温度控制28 ℃/23 ℃,光量子通量密度(PPFD)600 μmol/(m2·s),光照周期 12 h (7:00—19:00)。每3 d更换1次营养液,营养液 pH(5.50±0.05)。每次更换营养液时交换各盆的位置,以消除边际效应。
1.2 测定指标与方法
1.2.1 水稻干物重 胁迫处理7 d后,各处理随机选取4株长势一致的水稻幼苗,分成地下部和地上部,105 ℃杀青30 min,随后75 ℃烘干至恒重后称重、粉碎;同时,另外取4株水稻地上、地下部新鲜样品用以水稻生理指标测定。
1.2.2 植株磷含量和酸性磷酸酶活性 水稻地上部、根系全磷含量采用钼锑抗比色法测定[18]。叶片和根系酸性磷酸酶活性采用对硝基苯磷酸二钠法[19],具体如下:首先称取 0.10 g鲜样,加入4 mL醋酸钠缓冲液 (pH 5.8)研磨提取,离心(12 000 r/min,20 min),取上清液0.4 mL加入1 mL 0.05 mol/L对硝基磷酸二钠(p-NPP)30 ℃下黑暗反应30 min,然后加入1 mL 2 mol/L NaOH终止反应,405 nm处测定吸光值,同时作对硝基苯酚(p-NP)的标准曲线。
1.2.3 水稻生理指标测定 胁迫处理7 d后,水稻丙二醛含量采用硫代巴比妥酸显色法测定[20]:称取0.10 g样品,加入4 mL Na2HPO4-NaH2PO4磷酸缓冲液(pH 7.8),离心(4000 r/min,10 min),取1 mL上清液加入2 mL 0.5% TBA,混合后沸水浴15 min,用酶标仪测定450、532和600 nm处吸光值,按公式C(μmol/L)=6.45(A532-A600)-0.56A450计算丙二醛含量。
水稻脯氨酸含量采用磺基水杨酸提取酸性茚三酮显色法测定[20]:首先称取0.10 g水稻鲜样,加入2 mL 3%的磺基水杨酸浸提,吸取1 mL提取液,加入1 mL的冰醋酸和酸性茚三酮,沸水浴30 min,冷却后加入1 mL甲苯萃取,测定萃取液在520 nm处的吸光度,通过标曲查得脯氨酸含量;花青素含量采用分光光度法测定,称取0.10 g研磨好的鲜样,加入l mL甲醇溶液(含1% HCl体积比),提取12 h后,加入1 mL H2O和2 mL氯仿,混匀,离心(3000 r/min,2 min),530 nm处测定吸光值,用测得的吸光度值表示花青素的相对含量[18]。
新鲜水稻叶片和根系水势采用W4P 露点水势仪进行测定。
1.2.4 抗氧化保护酶活性 过氧化物酶(POD,Peroxidase)活性采用愈创木酚法测定[20],用pH 7.0的Na2HPO4-NaH2PO4磷酸缓冲液研磨、离心(3000 r/min,10 min),取0.3% H2O21 mL、0.2%愈创木酚0.95 mL、pH 7.0的磷酸缓冲液1 mL,在470 nm处测吸光值。超氧化物歧化酶(SOD,Superoxide dismutase)活性采用氮蓝四唑NBT法测定[20],pH 7.8的Na2HPO4-NaH2PO4磷酸缓冲液研磨、离心(10 000 r/min,20 min)。过氧化氢酶(CAT,Catalase)活性采用紫外分光光度法测定[20],用pH 7.8的Na2HPO4-NaH2PO4磷酸缓冲液提取、离心(4000 r/min,10 min),在240 nm处用分光光度计测定吸光值。
1.3 统计分析
所有数据均采用Microsoft EXCEL 2010和SPSS数据分析软件包进行数据整理和方差分析,不同处理间显著性检验采用LSD0.05(Least significant difference test)进行比较。采用Origin 8.0进行绘图。
2 结果与分析
2.1 不同水分和磷水平处理对不同基因型水稻生物量的影响
如表1所示,不同基因型水稻生物量对水分胁迫、磷水平的响应特征不同。与非水分胁迫相比,水分胁迫显著降低Nip水稻幼苗地上部、根系(正常磷水平除外)、整株生物量以及低磷水平下根冠比。水分胁迫对Kas水稻根系生物量无显著影响,但显著降低地上部生物量,进而显著增加其根冠比。不同的是,水分胁迫对U502水稻幼苗地上部、根系(除低磷水平)和整株生物量均无显著影响,但水分胁迫显著提高低磷水平下水稻根冠比。
无论水分胁迫与否,低磷较正常磷水平显著降低Nip和Kas水稻幼苗地上部和整株生物量,显著提高Nip和Kas水稻根冠比,且水分胁迫和低磷水平复合胁迫处理水稻地上部、根系和整株生物量最低。与正常磷水平相比,低磷水平显著降低U502水稻地上部、根系和整株生物量。
2.2 不同水分和磷水平处理对不同基因型水稻水势和氧化损伤的影响
如图1所示,水分胁迫显著降低Nip、Kas和U502的水稻叶片和根系水势。无论水分胁迫与否,磷水平对Nip水稻叶片和根系、Kas水稻根系水势均无显著影响;但是,Kas水稻叶片水势在水分胁迫条件下随磷水平降低而显著降低。相反,除了非水分胁迫根系外,低磷较正常磷水平均显著降低了U502水稻叶片和根系水势。
如图2所示,水分胁迫显著提高了Nip和Kas叶片和根系MDA含量,对U502叶片和根系MDA含量无显著影响。除了非水分胁迫下Kas水稻根系,不论是否水分胁迫,低磷较高磷处理均显著提高了Nip、U502和Kas水稻根系MDA含量,且LP+PEG处理均显著高于其他各处理。相反,磷水平对Nip和Kas水稻叶片MDA含量无显著影响,但显著增加了Kas水稻叶片MDA含量。
2.3 不同水分和磷水平处理对不同基因型水稻磷含量的影响
如表2所示,与非水分胁迫相比,水分胁迫显著降低Kas水稻地上部、根系(除了正常磷水平)和整株总磷含量;同时,显著降低了正常磷水平Nip水稻地上部、根系和整株磷含量,增加了低磷水平下U502水稻根系和整株总磷含量,但对低磷水平Nip水稻、正常磷水平U502水稻地上部和整株磷含量均无显著影响。正常磷水平下,水分胁迫对Nip和U502水稻地上部和根系磷分配比例无显著影响,但显著增加了低磷水平Nip和U502水稻根系磷分配比例;相反,水分胁迫对低磷水平Kas水稻各器官磷分配无显著影响,但显著增加正常磷水平Kas水稻根系磷分配比例。
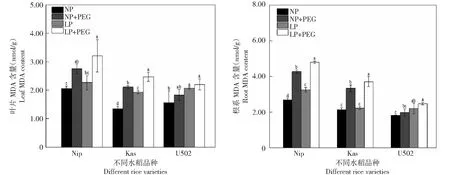
图2 不同水分和磷水平处理对水稻MDA含量的影响Fig.2 Effects of the different water regimes and phosphorus levels on the MDA contents of rice
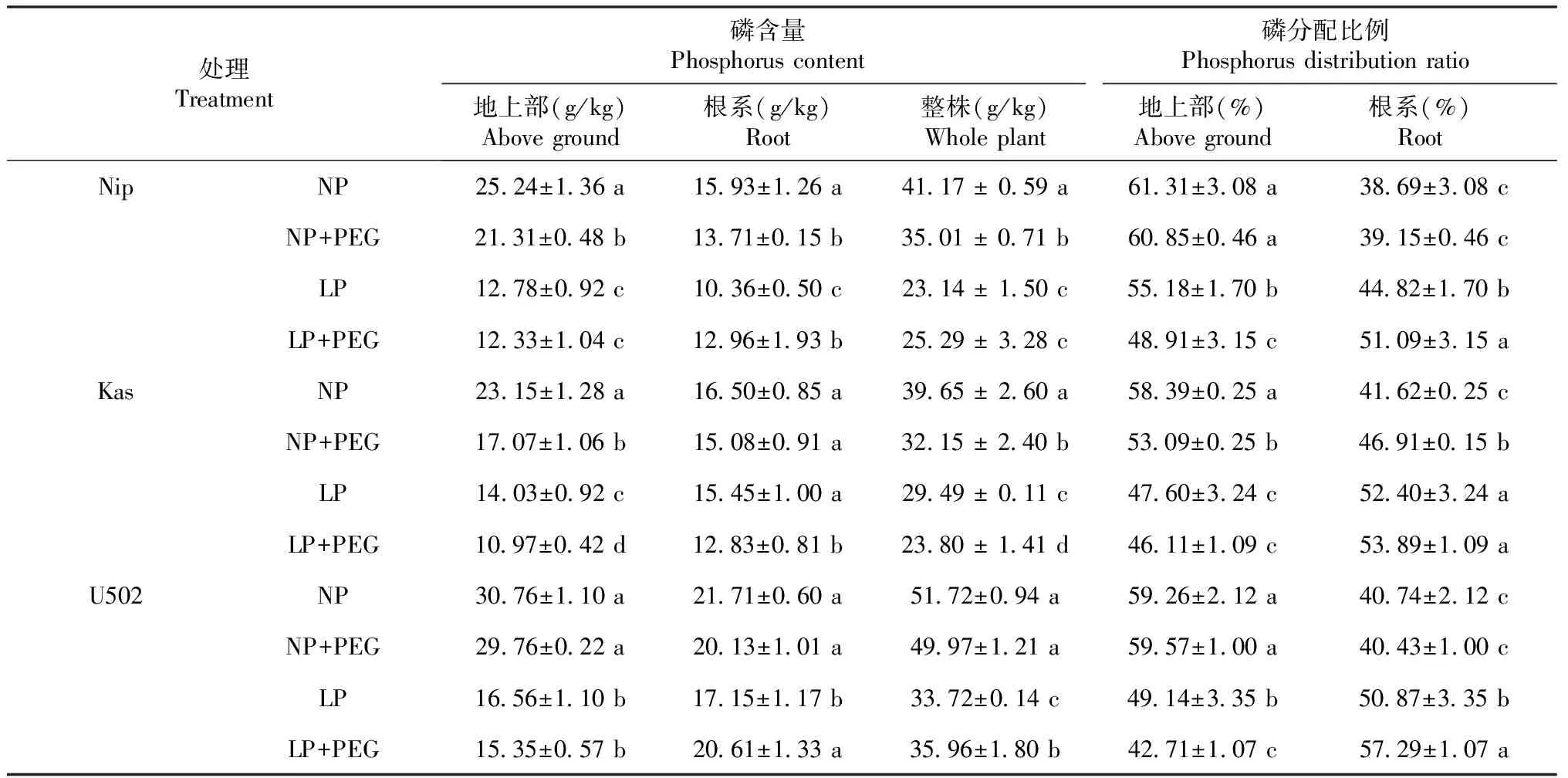
表2 不同水分和磷水平处理对水稻磷含量和分配的影响
无论水分胁迫与否,低磷较正常磷水平均显著降低了Nip、Kas和U502水稻地上部和整株磷含量,但磷水平对不同基因型水稻根系磷含量影响不同。非水分胁迫下,低磷较正常磷处理显著降低了Nip和U502水稻根系磷含量,水分胁迫下磷水平对其根系磷含量无显著影响;相反,低磷较正常磷处理显著降低了水分胁迫下Kas水稻根系磷含量,但对非水分胁迫下根系磷含量无显著影响。无论水分胁迫与否,低磷较正常磷水平均显著加了Nip、Kas和U502水稻根系磷分配比例,降低其地上部磷分配比例。3个品种均表现在低磷和水分复合胁迫下根系磷分配比例最高,叶片磷分配比例最低。
如图3所示,无论低磷、正常磷水平下,水分胁迫均显著增加了Nip、Kas和U502水稻叶片酸性磷酸酶活性。非水分胁迫下,低磷较高磷水平显著增加3个水稻叶片酸性磷酸酶活性;水分胁迫下低磷水平显著增加了U502叶片酸性磷酸酶活性,但对Nip和Kas水稻无显著影响。与叶片不同,水分胁迫显著降低了正常磷水平下Nip和Kas水稻根系酸性磷酸酶活性,低磷水平下Nip、Kas和U502水稻根系酸性磷酸酶活性显著增加。无论水分胁迫与否,低磷较正常磷处理均显著增加了Nip、Kas和U502水稻根系酸性磷酸酶活性,且低磷水平下Kas水稻根系酸性磷酸酶活性均明显高于Nip和U502。

图3 不同水分和磷水平处理对水稻酸性磷酸酶活性的影响Fig.3 Effects of the different water regimes and phosphorus levels on the activities of acid phosphatase of rice

图4 不同水分和磷水平处理对水稻脯氨酸含量的影响Fig.4 Effects of the different water regimes and phosphorus levels on the contents of proline of rice
2.4 不同水分和磷水平处理对不同基因型水稻脯氨酸和花青素的影响
如图4所示,与非水分胁迫相比,水分胁迫显著增加正常磷水平下Nip、Kas和U502以及低磷水平下Kas水稻叶片脯氨酸含量。与正常磷水平相比,低磷处理显著增加非水分胁迫下Nip和Kas叶片脯氨酸含量,但对水分胁迫下Nip、Kas和U502叶片脯氨酸均无显著影响。同时,水分胁迫均显著增加了Nip、Kas和U502根系脯氨酸含量;且除了非水分胁迫下Nip根系外,低磷较正常磷处理均显著增加Nip、Kas和U502水稻根系脯氨酸含量。
如图5所示,水分胁迫显著增加了Nip和Kas(除正常磷水平)叶片花青素含量;磷水平对非水分胁迫下Nip和Kas(除正常磷水平)叶片花青素无显著影响,但显著增加了水分胁迫下Nip水稻叶片花青素。不同的是,水分胁迫对U502水稻叶片花青素含量无显著影响,但低磷处理叶片花青素含量显著高于正常磷处理。

图5 不同水分和磷水平处理对不同基因型水稻花青素含量的影响Fig.5 Effects of the different water regimes and phosphorus levels on the contents of anthocyanin of rice
2.5 不同水分和磷水平处理对不同基因型水稻抗氧化酶活性的影响
如图6所示,水分胁迫显著增加了Nip和Kas叶片和根系的SOD、POD和CAT等抗氧化酶活性,仅显著增加U502叶片和根系中SOD酶活性。无论水分胁迫与否,低磷较正常磷处理显著增加了Kas水稻叶片和根系SOD和POD酶活性以及U502水稻叶片和根系SOD、POD和CAT酶活性;低磷较正常磷处理显著增加了Nip水稻根系SOD、POD和CAT酶活性。同时,水分胁迫条件下,低磷较正常磷处理显著增加了U502水稻叶片SOD和POD酶活性。
3 讨 论
生物量是植物对逆境胁迫的综合反应[21]。本研究结果表明,不论是否水分胁迫,低磷水平均显著抑制了Nip、Kas和U502水稻的生长和干物质量累积,进一步分析磷水平的高低水稻地上部生物量紧密相关。前期也有研究指出,低磷胁迫抑制了水稻地上部的生长,导致总生物量降低,水稻根冠比增大[22]。这与本文部分研究结果基本一致,但不同基因型水稻生长发育对不同水分、磷水平的响应不同,且水分胁迫进一步加剧了低磷对Nip和Kas水稻生长的抑制作用。虽然水分胁迫、低磷均显著抑制了Kas水稻地上部生物量,但其可通过调整水稻根系-地上部生物量分配来显著提高水稻根冠比。有研究发现低磷胁迫下植物通过增加根系来扩大对磷的吸收,在此过程中植物也可通过NO、H2S和激素等信号分子的调控作用改变体内磷吸收、转运等生理生化反应,扩大对外界磷的吸收和提高体内(如细胞壁)磷的再利用能力,进而以适应低磷胁迫[23]。
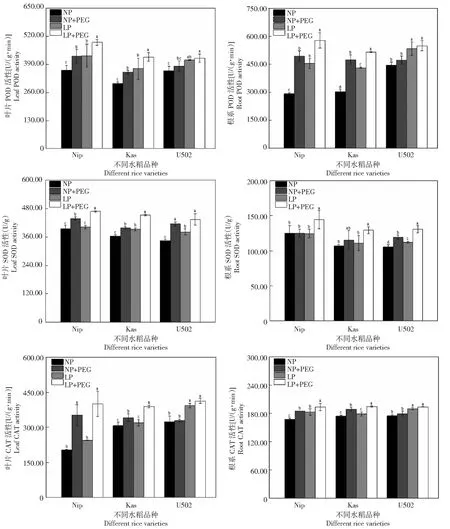
图6 不同水分和磷水平处理对不同基因型水稻抗氧化酶活性的影响Fig.6 Effects of the different water regimes and phosphorus levels on the activities of antioxidant enzymes of rice
虽然水分胁迫对U502的生物量无显著影响,但显著提高了低磷水平U502水稻根冠比,后者在促进水分和磷吸收方面具有重要作用,这也是水稻应对低磷胁迫的主动适应调控机制之一。不同的是,水分胁迫对低磷或高磷水平下U502水稻地上部、地下部和整株生物量均无显著影响,这也进一步验证了前人旱稻较常规水稻具有较高的抗水分胁迫能力这一结论[24]。
与水稻生物量变化趋势一致,低磷较正常磷水平显著抑制了不同基因型水稻地上部和整株磷含量,但增加了其根系磷分配比例。与Nip和U502水稻相比,低磷水平下Kas水稻具有更大的根系生物量,其主要原因是后者水稻根中存在耐缺磷基因 Pstol1,可使Kas水稻在缺磷土壤中有更大的根系,进而吸收更多的磷[25]。进一步对水稻根系、地上部酸性磷酸酶活性进行分析,发现低磷胁迫显著增加了水稻叶片酸性磷酸酶活性,从而促进体内有机磷转化为无机磷供生长循环利用[26]。因此低磷胁迫下不同基因型水稻根和叶片酸性磷酸酶活性增强、根系生物量和磷分配比例增加等调控策略对缓解因自身磷供应不足造成的不利影响均有积极的作用。无论低磷、高磷,水分胁迫均显著降低了Nip和Kas水稻地上部和整株磷含量,且低磷水平下水分胁迫显著提高了Nip和U502水稻根系磷含量及其磷分配比例,分析这可能与水分胁迫对根系生物量抑制作用导致的磷浓度“浓缩效应”有关。同时,水分胁迫均显著提高了Nip和Kas水稻叶片和低磷水平下根系酸性磷酸酶活性,但降低了正常磷水平下根系酸性磷酸酶活性,这与胡文涛等[18]的研究结果一致。
生理水平上,水分和低磷胁迫能通过扰乱光合作用电子传递诱导产生对细胞有害的活性氧累积(ROS),造成质膜脂质过氧化和氧化胁迫[27]。相应地,植物本身建立一套由酶促抗氧化系统和非酶促抗氧化系统组成的防御体系,以维持体内ROS稳态平衡[28],进而主动适应逆境胁迫。本试验中,水分胁迫显著降低了Nip和Kas水稻根系和叶片水势,并提高了MDA和脯氨酸含量水平;相反,水分胁迫虽然也显著降低U502水稻叶片和根系水势,但对MDA含量无显著影响。这可能与U502作为旱稻具有较高的抗水分胁迫能力,其生物膜受损程度低;U502水稻体内较高水平的抗渗透调节物质,如脯氨酸和花青素,也能一定程度提高其抗逆能力[29-30]。有研究表明,逆境胁迫过程中植物叶片累积的花青素可通过降低叶片光抑制,增强光合作用和抗氧化能力增强其逆境适应能力[31]。另一方面,除渗透调节物质外,植物还需要相互协调体内抗氧化酶防御系统减少逆境胁迫造成的氧化损伤,如SOD、POD、CAT等[32]。水分、低磷胁迫可导致作物体内ROS活性增大,伴随着水分胁迫下Nip和Kas水稻MDA含量升高,其体内 POD、SOD和CAT酶活性显著升高,可有效抑制膜内不饱和脂肪酸酸分解产物MDA的累积,这是植物主动适应外界环境胁迫时启动的应激反应。本研究中,U502水稻叶片和根系受水分和低磷胁迫影响较小,因此其CAT、POD酶活性没有显著性变化。
4 结 论
低磷水平均显著抑制了不同基因型水稻(Nip、Kas和U502)生长和干物质量累积,且水分胁迫进一步加剧了低磷对Nip和Kas水稻生长的抑制作用;但是,水分胁迫对U502水稻生物量无显著影响。不同基因型水稻对低磷和水分胁迫的生理响应特征和适应性调控机制不同:低磷胁迫下Nip、U502和Kas水稻根系和叶片酸性磷酸酶活性显著提高,Nip和U502水稻可通过增加根系磷含量和磷分配比例增强其低磷胁迫适应能力;而Kas水稻可通过提高其根系生物量提高其磷吸收利用能力。同时,不同基因型水稻均可通过提高根系和叶片渗透调节物质(如脯氨酸、花青素)、抗氧化酶(如SOD、POD和CAT)活性提高其抗水分胁迫能力。

