脓毒症休克患者肾阻力指数的影响因素分析*
付 优,何 聪,葛 晨,白银箱,张 娜,赵鹤龄
(河北省人民医院重症医学科,石家庄 050051)
急性肾损伤(acute kidney injury,AKI)是重症患者常见的并发症之一,发病率可高达50%,显著增加了患者的死亡率及经济负担,因此,早期诊断和预防AKI十分重要[1]。近年来随着床旁超声技术在重症患者中的广泛应用,研究者发现肾阻力指数(renal resistive index,RRI)在预测AKI的发生、严重程度及转归方面具有一定作用[2-3]。然而,一些研究对RRI预测AKI的能力并不肯定[4-5]。造成这种矛盾的原因之一是RRI的影响因素众多,如年龄、心率(heart rate,HR)、氧和二氧化碳等,且不同背景及人群的因素不一致[6-7]。但这些研究大多为非重症患者,对于重症患者尤其是脓毒症休克患者,由于伴有炎性反应及血流动力学不稳定,本身RRI值比非重症患者高[8],其RRI是否受其他因素的影响尚不明确。因此,本研究的目的是寻找影响脓毒症休克患者RRI的因素,以更好地利用RRI预测AKI。
1 资料与方法
1.1 一般资料
本研究为前瞻性临床观察研究。选取2017年11月至2018年10月本院重症医学科连续收治的脓毒症休克患者。入选标准:(1)年龄≥18岁;(2)预计住重症监护室(ICU)时间大于或等于24 h;(3)符合Sepsis3.0确诊脓毒症休克标准,即感染或疑似感染患者且序贯器官功能衰竭评分(sequential organ failure assessment,SOFA)急性增加≥2分,伴有持续性低血压,虽经恰当的输液复苏,仍然需要应用血管收缩药物以维持平均动脉血压(mean arterial pressure,MAP)≥65 mm Hg及血清乳酸大于或等于2 mmol/L[9]。排除标准:(1)孕妇;(2)已经存在AKI或AKI恢复期者;(3)慢性肾脏病(肾小球滤过率小于30 mL·min-1·1.73 m-2)者;(4)明确有肾动脉狭窄、肾实质损伤者;(5)持续心律失常无法进行肾脏超声测量者。经医院伦理委员会同意,由于本研究利用床旁无创超声技术,不增加患者的痛苦和费用,超声检查结果不影响最终治疗决策,无须获得家属的知情同意(审批编号:2017科研伦审第126号)。
1.2 方法
1.2.1临床资料收集
记录患者的年龄、性别、基础疾病(高血压、糖尿病、冠心病、肺部疾病)、来源、感染部位。超声测得RRI、每搏输出量(stroke volume,SV),并计算心脏指数(cardiac index,CI),记录超声检查时的HR、收缩压、舒张压、MAP、中心静脉压(如果患者留置颈内或锁骨下中心静脉导管)、去甲肾上腺素用量等。患者入选时即抽取动静脉血标本,测定血常规(日本希森美康XN-10血液分析仪)、血气分析(德国罗氏cobasb 123全自动血气电解质生化分析仪)、血肌酐(serum creatinine,sCr)及尿素氮(日本日立7600-110全自动生化分析仪)、降钙素原(广州万孚生物技术股份有限公司免疫荧光干式定量检测仪FS101)等。结合检验结果计算并记录患者第1个24 h的急性生理和慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation Ⅱ score,APACHEⅡ评分)、SOFA。常规每日复查血常规、血气分析、血肌酐及尿素氮。记录每小时尿量、ICU存活情况、ICU住院时间及28 d存活情况。
1.2.2测量RRI
由经过专门重症超声培训的医师完成超声检查,其不参与患者诊疗、不知晓病情。入ICU后24 h内,在患者血流动力学相对平稳下(不增加血管收缩药剂量及无需快速扩容的情况下MAP≥65 mm Hg)使用Philips CX50型便携式超声仪宽频弧形探头C5-1行肾脏超声检查测得RRI[10]。常规测量患者右肾,若右侧无法进行则选择左侧,选择叶间动脉或弓状动脉测RRI,测量3次取平均值,RRI=(收缩期峰值速率-舒张末期速率)/收缩期峰值速率。
1.2.3CI计算
使用便携式超声仪相控阵探头S5-1,在五腔心切面暴露出主动脉根部和左室流出道,采用脉冲多普勒测出左室流出道速度-时间积分(velocity-time integral,VTI),在胸骨旁长轴测得左室流出道直径(D),计算SV,SV=VTI×π(D/2)2。结合HR、体表面积(body surface area,BSA)计算出CI=SV×HR/BSA[11]。
1.2.4AKI定义
采用2012年改善全球肾脏病预后组织(Kidney Disease Improving Global Organization,KDIGO)制订的AKI诊断标准[12],即达到下列之一者:(1)肾功能在48 h内急剧下降,表现为sCr上升大于或等于26.5 μmol/L;(2)已知或假定肾损伤发生在7 d之内,sCr上升至≥基础值的1.5倍;(3)尿量小于0.5 mL·kg-1·h-1超过6 h。
1.2.5分组
根据LEROLLE等[13]观察结果,以测得的RRI值是否≥0.74分为高RRI组(RRI值≥0.74)和低RRI组(RRI值<0.74)。
1.2.6观察终点
出现死亡事件、出院、入科第28天,以首先出现的终点事件为观察终止时间。
1.3 统计学处理

2 结 果
2.1 一般资料
研究期间连续收住脓毒症休克患者共117例,有10例被排除,其中年龄<18岁2例,慢性肾脏病5例,持续心律不齐3例。107例研究对象年龄27~100岁,平均(70.5±15.0)岁;男71例(占66.4%),女36例(33.6%);来自急诊的患者25例(23.4%),内科病房24例(22.4%),外科病房8例(7.5%),手术后患者50例(46.7%)。全部患者第1个24 h的APACHEⅡ评分为(16.6±4.9)分,SOFA为(6.3±2.5)分。全部患者平均RRI为(0.73±0.06),其中AKI患者共59例,非AKI患者48例,AKI患者的RRI较非AKI患者高[(0.74±0.07)vs.(0.71±0.05),P=0.002]。
2.2 高RRI和低RRI组比较
高RRI组42例,平均RRI为0.79±0.05;低RRI组65例,平均RRI为0.69±0.03。超声测得两组RRI图像见图1。高RRI组患者年龄、APACHEⅡ评分、SOFA、ICU死亡率、28 d病死率均较低RRI组高,差异有统计学意义(P<0.05)。高RRI组中高血压患者百分比较低RRI组高(69.0%vs.49.2%,P=0.043)。两组间基线资料及预后比较见表1。

表1 两组患者基线资料及预后比较

A:低RRI组图像;B:高RRI组图像。
2.3 两组患者血流动力学及实验室指标比较
比较高RRI组和低RRI组间可能影响RRI的血流动力学及实验室指标,结果显示,两组患者舒张压、MAP有明显差异(P<0.05),见表2。

表2 两组血流动力学及实验室指标比较
2.4 脓毒症休克患者RRI的影响因素分析
将年龄、高血压、APACHEⅡ评分、SOFA、舒张压、MAP纳入多因素logistic回归分析,结果显示,年龄、MAP为脓毒症休克患者RRI的影响因素,见表3。
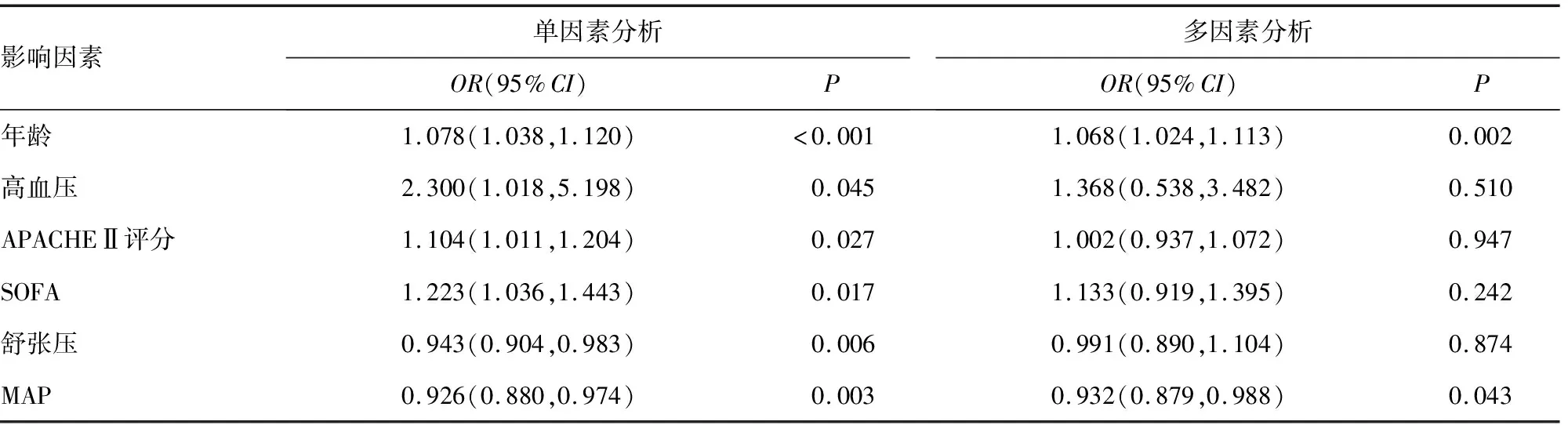
表3 logistic回归分析脓毒症休克患者RRI的影响因素
3 讨 论
RRI在评估肾脏灌注[14-15],AKI的早期诊断、严重程度评估、转归判断及预后方面均有一定作用[2-3,13,16]。CORRADI等[14]发现,RRI可以在血流动力学相对稳定的多发伤患者中预测内脏隐匿性低灌注,RRI值>0.7对失血性休克具有预测价值。BOSSARD等[17]观察到RRI值>0.74预测心脏术后患者AKI的受试者工作特征(ROC)曲线的曲线下面积(AUC)为0.91,灵敏度和特异度分别为0.85和0.94。NINET等[2]的一项meta分析结果显示,RRI有助于区分重症患者短暂性AKI和持续性AKI。BODDI等[3]分析了RRI与重症AKI患者死亡之间的关系,发现高RRI值与ICU死亡显著相关,OR值为1.63。由于RRI在重症患者肾功能的评估方面具有重要价值,研究其影响因素有助于更好地利用RRI。本研究通过观察ICU内脓毒症休克患者的RRI,发现年龄、MAP为RRI的影响因素。
RRI的正常值为0.6~0.7[6],本研究采用RRI值≥0.74作为RRI界值,其原因如下:(1)考虑休克患者RRI值会升高[8],以正常上限值0.7作为脓毒症休克RRI的界值可能会造成高RRI患者明显多于低RRI患者;(2)本研究纳入的观察对象均为脓毒症休克患者,LEROLLE等[13]的研究发现在脓毒症休克患者中,以入ICU第1天RRI>0.74为界值预测急性肾功能障碍的灵敏度为78%,特异度为77%,AUC为0.85,故采用0.74为界值。
在脓毒症休克患者中,年龄是影响RRI的因素之一,这反映了随着年龄的增加,血管动脉硬化程度增加,肾血管的顺应性下降,阻力增加,从而引起RRI值增加。这与其在健康人群中的表现一致[6,18]。同时,本研究高RRI组中高血压患者比例较高,进一步说明血管顺应性下降引起RRI值升高。
在血流动力学指标中,仅发现MAP可影响RRI,这可能是由于MAP的增加引起肾血流的增加,肾血管扩张或使灌注血管的数量增加,从而引起RRI值下降[19-20]。急性循环衰竭患者及健康人群中RRI值亦会随着MAP的增加而下降[19,21],然而二者的这种关系会受到是否存在高血压、糖尿病的影响。BELONCLE等[22]发现,当患者合并慢性高血压或糖尿病时,MAP升高可引起RRI值的轻微下降,当不存在这两种合并症时,二者的这种关系消失。同样DEWITTE等[5]发现,RRI与MAP只有在不伴有AKI的脓毒症患者中存在线性关系,在伴有AKI的患者中这种关联不存在。MAP与RRI的关系不固定,并且未发现其他血流动力学指标对RRI的影响,考虑原因可能为:(1)脓毒症休克患者受到炎症介质、镇静等因素影响,受损的肾脏血管收缩受限或无收缩应答,从而弱化了血流动力学变化对RRI的影响;(2)一些研究中发现其他血流动力学指标如脉压、中心静脉压、脉搏波动指数对RRI产生影响,可能这些血流动力学指标共同参与引起RRI的变化,在多种复杂的因素作用下,单一因素对RRI的影响可能无法预测[4-5,8,22]。
此外,一些理化因素可能亦会影响RRI值。如OLIVEIRA等[23]发现,在重症患者中乳酸与RRI呈正相关,乳酸是代表重症患者疾病严重程度的指标,而与RRI的关系则说明RRI亦反映了临床疾病的严重性。此外,在急性呼吸窘迫综合征患者中,低氧可引起RRI升高[24]。而在慢性阻塞性肺疾病患者中,二氧化碳分压的急性改变比氧分压更能决定肾血管阻力的变化[25]。本研究中未发现这些理化因素对RRI的影响,考虑可能是由于研究纳入的为脓毒症休克患者,通气氧合障碍及疾病严重程度与既往研究不同。
尽管RRI测量的是局部血管血流变化,肾外因素如全身血流动力学及理化因素均对RRI产生影响,似乎这种影响是多样且复杂的。这使得单一依靠RRI预测AKI或评估肾灌注的价值下降,进一步的研究需结合临床表现或其他监测指标以提高RRI的临床应用价值。
本研究存在以下局限:(1)本研究是单中心研究,选取的为脓毒症休克的患者,结果的适用范围受限;(2)未进行AKI严重程度的评估及分类,故无法评估其对RRI的影响。综上所述,年龄、MAP为脓毒症休克患者RRI的影响因素。由于RRI受多种因素的影响,进一步的研究需结合临床表现或其他监测指标以提高RRI的临床应用价值。

