多肽K-YFAE对H9C2心肌细胞增殖及缺氧耐受的影响
王靠山,朱 莉
(扬州大学医学院,中国江苏 扬州 225008)
心肌梗死中,缺氧、缺血等多种因素常导致心肌发生坏死,而目前尚无治疗方法可以逆转这种坏死[1],故心脏再生越来越引起人们的关注。成熟的心肌细胞属于终末分化细胞,通常被认为几乎没有再生能力,但越来越多的实验研究表明,在某些特定情况下,心肌细胞是可以再生的,如:美国有学者发现新生小鼠在出生后的7 d内,其心肌细胞是可以再生的,这一特定时间段被称为心脏再生的窗口期,只是这种再生能力随后又失去了[2]。多肽是由多个氨基酸分子脱水缩合而成的化合物,机体的众多活性物质都是以多肽的形式存在。近年来,多肽以毒性低、特异性高、相对分子质量小等独特优势被广泛研究于组织再生领域[3],如:Stiernberg等[4]研究发现,合成肽(TP508)能促进肢体损伤血管的再生,加速皮肤伤口的愈合。
近期,笔者所在课题组在乳鼠心脏再生相关多肽的筛选项目中开展了与心脏再生相关多肽的筛选工作。以出生后1 d的乳鼠心脏组织样本为检测对象、出生7 d后的小鼠心脏组织标本为对照,应用Nano LC-MS/MS(nanoscale liquid chromatography coupled to tandem mass spectrometry)质谱技术筛选与心脏再生相关的多肽,结果发现出生后1 d与7 d的小鼠心脏多肽的表达存在较大差异。在出生后1 d的小鼠心脏组织中,差异高表达2倍以上的多肽有73条,差异低表达2倍以上的多肽有36条。其中,一条前体蛋白为富含半胱氨酸肠蛋白2(cysteine-rich intestinal protein 2,Crip2)的多肽 KTVYFAE(文中简称“K-YFAE”),在出生后1 d与7 d的小鼠心脏组织中的差异表达倍数高达2.82倍,且表现为下调,其生物信息学分析显示,K-YFAE全长7个氨基酸,相对分子质量为856.97,等电位点为6.0,是一条疏水性多肽,在体内、体外都非常稳定。肽学研究早已发现多肽可能与其前体蛋白发挥相似的作用。而Crip2蛋白作为LIM蛋白家族的重要成员之一,在心脏发育、细胞免疫等过程中发挥重要作用[5]。故本文拟观察多肽K-YFAE对H9C2心肌细胞增殖及缺氧耐受的影响,为心脏再生提供新的研究对象,促进心脏再生机制的理解,为心肌梗死提供新的治疗思路。
1 材料与方法
1.1 材料
小鼠心肌细胞H9C2、DMEM完全培养基、细胞增殖及毒性检测(CCK-8)试剂盒均购自江苏无锡怀信公司,多肽K-YFAE由上海科肽公司合成,qPCR试剂盒及流式凋亡试剂盒购自诺唯赞公司(中国),无菌操作台和培养箱购自ThermoFisher公司(美国),倒置相差显微镜购自Nikon公司(日本),纯水仪购自Millipore公司(美国),qPCR仪购自Analytik Jena公司(德国),流式细胞仪购自Beckman公司(美国),其余基础实验室试剂如磷酸缓冲盐溶液(phosphate buffer saline,PBS)、无水乙醇等均由泰州市人民医院中心实验室提供。
1.2 细胞培养
H9C2心肌细胞使用10 mL DMEM完全培养基于37℃温箱中静置培养,每2~3 d换液1次。将生长到对数期的细胞接种到96孔培养板上,细胞密度为每孔1×105个,然后分组处理。
1.3 实验分组
培养后的H9C2心肌细胞分为对照组、多肽处理组。其中多肽组分为3个浓度,分别为10 μmol/L、20 μmol/L、50 μmol/L,对照组只使用 10%的二甲基亚砜(dimethyl sulfoxide,DMSO)和胎牛血清(fetal bovine serum,FBS)处理。所有组均为每2 d换液1次。
1.4 多肽K-YFAE对H9C2心肌细胞增殖的影响
分组、干预7 d后,对各组细胞分别行CCK-8、流式细胞术检测细胞周期、qPCR反应检测细胞周期相关基因等实验。
1.4.1 CCK-8细胞增殖检测
将各组细胞分别消化后制成细胞悬浮液并均匀铺入96孔板中,按照CCK-8试剂盒说明书步骤检测OD值。
1.4.2 流式细胞术检测细胞周期
将原培养液、PBS以及消化后的细胞悬液一起收集于EP管中,1 000 r/min离心5 min。弃上清,加入1.5 mL预冷的PBS,1 000 r/min离心5 min后去除PBS和细胞碎片。加入1.5 mL预冷的PBS,在涡旋状态下加入无水乙醇3.5 mL,4℃固定30 min后1 000 r/min离心5 min,将乙醇吸除,加PBS清洗混匀。1 000 r/min离心5 min后,将残留的乙醇除去并吸除管内PBS,然后加入200 μL PBS和2 μL RNA酶,37℃下孵育30 min。加入碘化丙啶(propidium iodide,PI)于室温下避光染色30 min,将EP管内细胞过滤至含有PBS的EP管中,检测细胞周期。
1.5 多肽K-YFAE对H9C2心肌细胞凋亡的影响
采用三气培养箱使细胞暴露于缺氧环境3 h,然后分组,24 h后观察细胞形态,并对各组细胞分别行TUNEL检测细胞凋亡、流式细胞术检测细胞凋亡、qPCR反应检测细胞凋亡周期相关基因等实验。
1.5.1 TUNEL检测细胞凋亡
在室温下将约5×107mL-1H9C2心肌细胞固定于4%中性甲醛中10 min。在载玻片上滴加细胞悬液50~100 μL,干燥后用PBS清洗5 min,共清洗两次。室温下,在色缸中加入含2%过氧化氢的PBS,反应5 min后再次用PBS洗两次,每次5 min。吸去载玻片上多余液体后,在切片上加两滴TdT酶缓冲液,室温下静置5 min。再次吸去多余液体后滴加TdT酶反应液54 μL,37℃下在湿盒中反应1 h。在染色缸中加入预热至37℃的洗涤和终止反应缓冲液,37℃下保温30 min,每10 min轻轻搅动1次。用PBS洗3次切片,每次5 min,滴加过氧化物酶标记的抗地高辛抗体两滴,室温下,于湿盒中反应30 min,PBS清洗4次,每次5 min。在切片上加入现配的0.05%DAB溶液,室温显色5 min后蒸馏水清洗4次,前3次每次1 min,最后1次5 min。甲基绿复染10 min后蒸馏水洗3次,前两次提起放下载玻片10次,最后静置30 s,1次。依此法再用100%正丁醇洗3次、二甲苯脱水3次,每次2 min,封片、干燥后,观察并记录实验结果。
1.5.2 流式细胞术检测细胞凋亡
选择对数生长期且状态良好的细胞,消化、洗涤并重悬细胞后行细胞染色,加入5 μL Annexin V-FITC和5 μL PI染色液,吹匀后,室温下避光孵育20 min。加入400 μL缓冲液,轻轻混匀,染色后样品在1 h内用流式细胞仪检测。
1.6 qPCR反应检测细胞周期及凋亡相关基因
按照Trizol试剂说明书提取、分离RNA,并测其浓度。采用反转录试剂盒合成cDNA后,按照ChamQ Universal SYBR qPCR Master Mix说明书行qPCR反应。以GAPDH为内参,采用ΔΔCt法定量分析细胞周期相关基因(P21、PLK3、E2F1、cyclin C)和细胞凋亡相关基因(Bax、Bcl-2)的表达水平。qPCR反应条件:预变性95℃,30 s;变性95℃,8 s;退火/延伸60℃,8 s;熔解曲线分析95℃,15 s;60℃,60s;95℃,15s。其中,变性与退火/延伸循环次数为39次。引物信息如下,P21-FP:5′-AAGACCATGTGGACCTGTCA-3′,P21-RP:5′-GGCTTCCTCTTGGAGAAGAT-3′;PLK3-FP:5′-TCAGCAAGTGGGTTGACTAC-3′,PLK3-RP:5′-GATCTCCACCCTTCATGAGGT-3′;E2F1-FP:5′-CTCGACTACCACTTCGGCCTC-3′,E2F1-RP:5′-TAGAAGCTTCTGGAGACAGAG-3′;cyclin C-FP:5′-GAGCCTCTCGCTGACCAGCT-3′,cyclin C-RP:5′-TGGGCTCTAAATTGGCTCAC-3′;Bax-FP:5′-GATGCGTCCACCAAGAAGCT-3′,Bax-RP:5′-AGCACCAGTTTGCTGGCAAAG-3′;Bcl-2-FP:5′-TGGTATTCAGGATTACATGCATG-3′,Bcl-2-RP:5′-TCAGGAAGACCCTGAAGGAC-3′;GAPDH-FP:5′-AACGACCCCTTCATTGAC-3′,GAPDH-RP:5′-TCCACGACATACTCAGCAC-3′。
1.7 统计学分析
采用GraphPad Prism 7.0进行统计分析。计量资料采用平均数±标准误(±sx)表示,组间比较采用Student’s t-test,P<0.05为差异具有统计学意义。
2 结果
2.1 多肽K-YFAE促进H9C2心肌细胞增殖
显微观察结果显示,与对照组(control)相比,多肽组H9C2心肌细胞的密度明显增加,且随着多肽浓度的增加,细胞密度进一步增加(图1)。在CCK-8检测细胞增殖实验中,多肽K-YFAE的干预显著提高了各浓度实验组心肌细胞的OD值,并随着多肽K-YFAE浓度的增加,OD值亦逐渐增加,差异有统计学意义(P<0.05)(图2);在细胞周期检测中,多肽组H9C2心肌细胞的G0/G1周期较对照组明显缩短,且随着多肽浓度增加,G0/G1周期进一步缩短(P<0.05),表明多肽K-YFAE能促进H9C2心肌细胞更早进入分裂期(图3)。进一步采用qPCR反应检测细胞周期相关基因(P21、PLK3、E2F1、cyclin C)的表达水平,结果显示:与对照组相比,P21基因的表达随多肽剂量增加而降低,而PLK3、cyclin C、E2F1基因的表达随多肽剂量增加而递增(图4)。以上结果均提示,多肽KYFAE可以促进H9C2心肌细胞增殖,并使得更多细胞进入分裂期。

图1 培养7 d后各组H9C2心肌细胞的形态标尺:100 μm。Fig.1 Morphology of H9C2 cardiomyocytes in each group after cultured for 7 days Scale bar:100 μm.
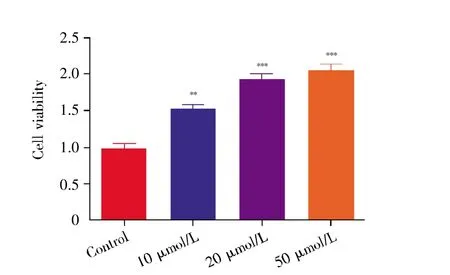
图2 CCK-8检测H9C2心肌细胞增殖与对照组比较,*:P<0.05;**:P<0.01;***:P<0.001。图4、6、8、9的统计分析同此图。Fig.2 Determination of proliferation of H9C2 cardiomyocytes by CCK-8Compared with the control group,*:P<0.05;**:P<0.01;***:P<0.001.The marks have the same meanings in Figs.4,6,8 and 9.
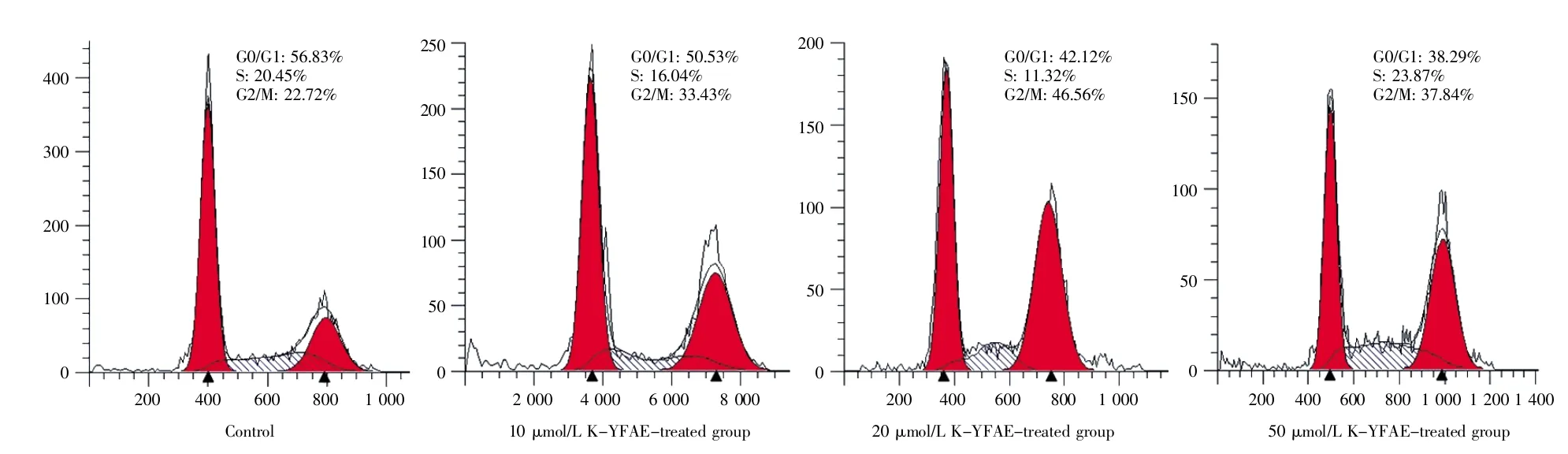
图3 流式细胞术检测H9C2心肌细胞增殖Fig.3 Detection of H9C2 cardiomyocyte proliferation by flow cytometry
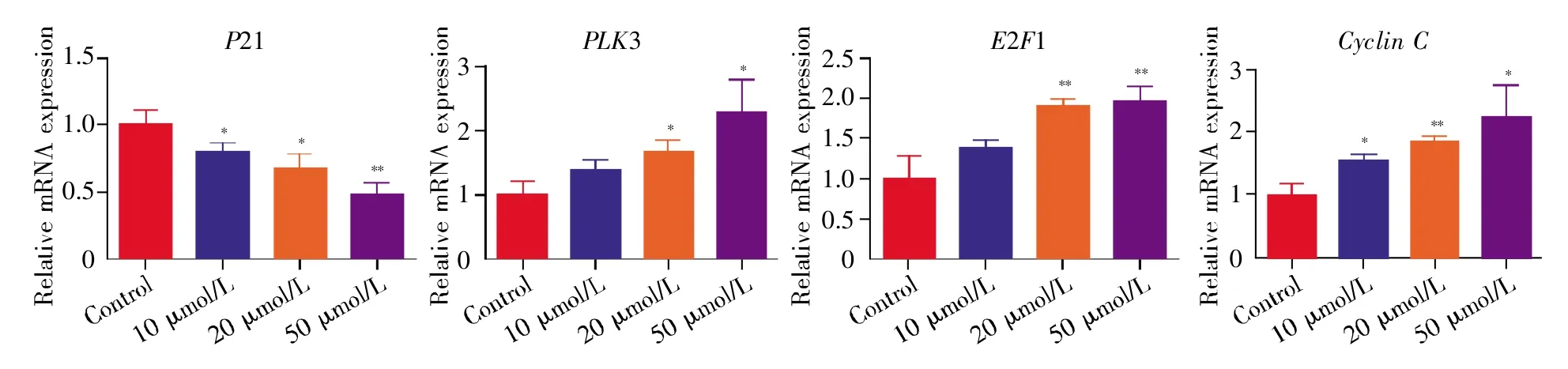
图4 细胞周期相关基因的qPCR检测Fig.4 Detection of cell cycle-related genes by qPCR
2.2 多肽K-YFAE促进H9C2心肌细胞缺氧耐受
通过在显微镜下观察各组细胞形态,我们发现经过缺氧处理后,对照组细胞皱缩,而多肽KYFAE处理组细胞随多肽剂量增加回复正常形态的细胞数增多(图5)。TUNEL法检测细胞凋亡结果显示,经过多肽K-YFAE处理后,与对照组相比,多肽组细胞凋亡比例减少,且随着多肽浓度增加,细胞凋亡比例进一步减少,差异具有显著性(P<0.01)(图6)。流式细胞术检测细胞凋亡结果显示,多肽组细胞更能耐受缺氧,细胞凋亡率明显下降(图7~8)。其中,对照组早期凋亡率(Q1-LR)=10.50%,晚期凋亡率(Q1-UR)=25.23%;20 μmol/L多肽组 Q1-LR=8.50%,Q1-UR=13.98%;50 μmol/L多肽组Q1-LR=5.53%,Q1-UR=8.25%,可以看到当多肽浓度在20~50 μmol/L范围内时,细胞早期凋亡率明显减少,且差异具有统计学意义(P<0.01),这表明在此范围内,多肽浓度的增加减少了细胞的凋亡。有意思的是,10 μmol/L多肽组早期凋亡率增加(Q1-LR=12.82%),晚期凋亡率减少(Q1-UR=12.08%)(图7),这可能提示多肽K-YFAE可以促进H9C2心肌细胞缺氧耐受,但其存在一定的浓度依赖性。进一步采用qPCR检测细胞凋亡相关基因(Bax、Bcl-2)的表达水平,结果显示:与对照组相比,Bax基因的表达随多肽K-YFAE浓度增加而降低,Bcl-2基因的表达随多肽剂量增加而递增(图9)。以上结果均提示,多肽K-YFAE可能促进H9C2心肌细胞缺氧耐受,减少其缺氧状态下的凋亡。

图5 多肽K-YFAE对H9C2心肌细胞缺氧3 h后细胞形态的影响标尺:100 μm。Fig.5 The effect of polypeptide K-YFAE on H9C2 cardiomyocyte morphology under hypoxia for 3 hoursScale bar:100 μm.
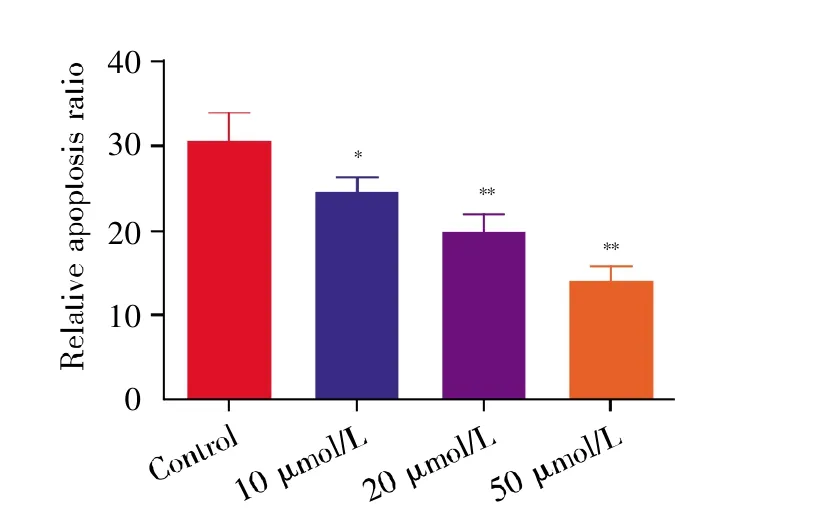
图6 TUNEL法检测缺氧处理3 h后各组细胞凋亡Fig.6 Apoptosis detection by TUNEL assay after hypoxia treatment for 3 hours

图7 流式细胞术检测H9C2心肌细胞缺氧处理3 h后的凋亡Fig.7 Apoptosis of H9C2 cardiomyocytes detected by flow cytometry after hypoxia treatment for 3 hours
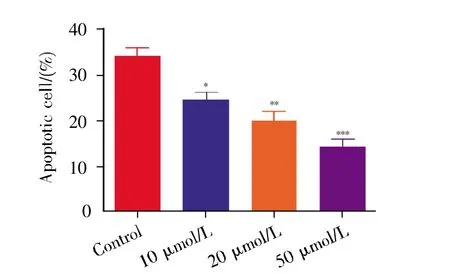
图8 流式细胞术检测H9C2心肌细胞缺氧处理3 h后凋亡的数据分析Fig.8 Analysis of apoptosis of H9C2 cardiomyocytes treated with hypoxia by flow cytometry for 3 hours
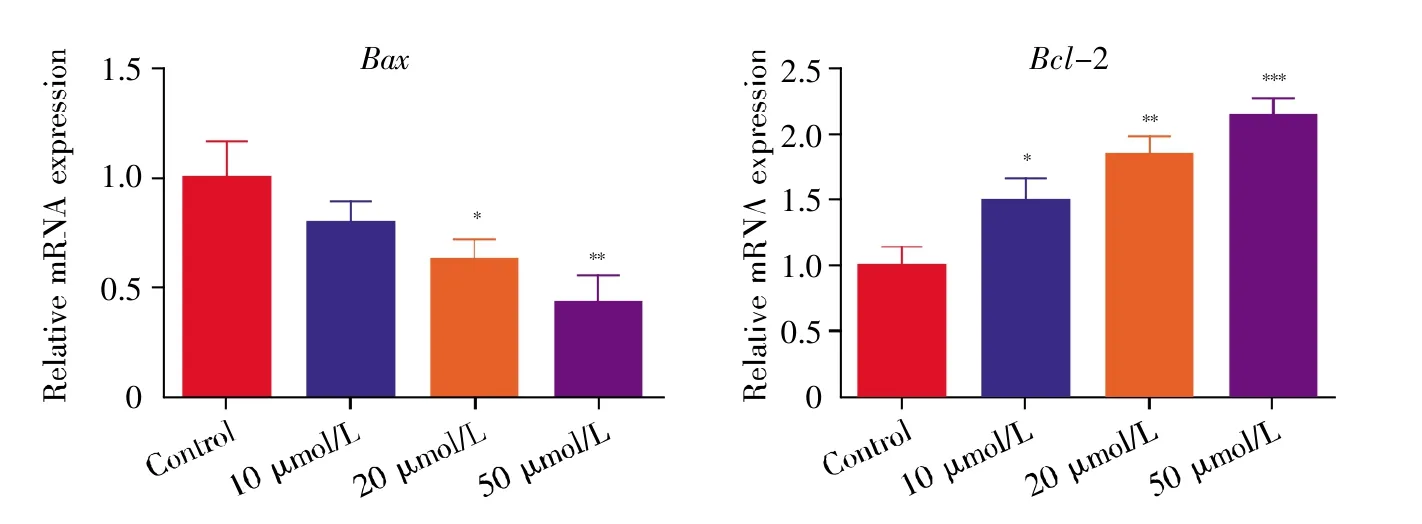
图9 qPCR检测H9C2心肌细胞经缺氧处理3 h后的凋亡相关基因Fig.9 Detection of apoptosis-related genes in H9C2 cardiomyocytes treated with hypoxia by qPCR for 3 hours
3 讨论
随着生活节奏的加快,心肌梗死等心血管疾病成为威胁人类健康的主要疾病之一[6]。目前,虽然药物治疗、溶栓及介入技术的开展明显改善了心肌梗死患者的临床症状及生存率,但是现有措施对于已经坏死或已经瘢痕化的心肌却无能为力[7]。此外,由于成年人心肌细胞几乎没有再生能力,终末期心脏病成为临床上不可避免的“老大难”问题。近年来,为探索治疗终末期心脏病的更多方法,科研界一直把心脏再生作为研究热点。科学研究发现,心脏是可以再生的,且其再生存在某个窗口期[8]。心肌梗死后,梗塞区域发生快速血管重建,有研究用全器官成像技术发现,新生小鼠可再生心脏中存在着侧支动脉网络,这些侧支动脉是由动脉内皮细胞沿预先存在的毛细血管迁移形成的,这一过程称为“动脉重组”[8]。同时,淋巴管生成在心脏修复中也起着关键作用,在心肌梗塞后,淋巴管的生成导致7 d后机体免疫细胞减少,提示新形成的淋巴管有助于心肌梗塞后炎症的消退[9]。多肽是指由α-氨基酸通过肽键连接形成的化合物,一般由3个或3个以上的氨基酸分子构成,其因特异性高、毒性低、相对分子质量小等诸多独特优势被广泛研究并应用于临床实践中[10~11]。深入探索多肽在心脏再生中的功能,将有助于促进人们对心脏再生机制的理解,亦有望为终末期心脏病的治疗提供新的策略。
Crip2是LIM域蛋白家族的Crip型亚组,其在细胞骨架构建、心脏发育过程、血管和淋巴管形成、肿瘤发生以及机体免疫等多种生理病理过程中发挥重要作用。现有的研究表明,Crip2蛋白可能通过与相关通路的重要蛋白质相互作用,调控相关信号通路(如Wnt信号通路等),参与调节机体的病理生理过程[12]。
多肽K-YFAE是笔者所在课题组近期进行的乳鼠心脏再生相关多肽的筛选项目中应用Nano LC-MS/MS技术所筛选出的兴趣多肽,其来源于前体蛋白Crip2,且在小鼠出生7 d后表现为下调。近年来,肽学新的研究结果表明,多肽往往与其前体蛋白功能相近[13]。故此多肽极有可能与Crip2发挥相似的作用,即参与调节心脏的发育、心功能的维持、伤口愈合、血管形成等。另外,由于此多肽为差异性多肽,且在心脏再生的“窗口期(7 d)”内表现为极有意义的下调。我们有理由推测它是否对心脏再生产生关键的影响。因此,我们针对其前体蛋白Crip2的功能特点,设计了此实验,拟观察多肽K-YFAE对H9C2心肌细胞增殖及缺氧耐受的影响。
本研究中,通过直接观察细胞形态以及流式细胞术检测细胞周期,我们发现多肽K-YFAE确实可以促进H9C2心肌细胞增殖,使更多的细胞进入到增殖期,并且随着多肽浓度的增加,其作用也越明显。细胞周期相关基因表达水平的检测也充分证实了这一点,多肽组随着多肽浓度的增加,P21基因的表达逐渐降低,PLK3、E2F1、cyclin C基因的表达逐渐增加。另外一方面,经多肽KYFAE处理后,缺氧后由皱缩恢复至正常形态的细胞数目增多。流式细胞术检测结果显示,多肽K-YFAE处理可以使得缺氧引起的细胞凋亡比例逐渐减小,且在多肽浓度为20~50 μmol/L时,细胞早期凋亡率减少显著,表明这种作用可能存在一定的浓度依赖性。同时TUNEL法检测结果显示,多肽K-YFAE处理可显著减少缺氧诱导的H9C2心肌细胞的凋亡。在凋亡基因检测中,多肽K-YFAE的处理可抑制缺氧环境诱导的Bax蛋白表达,同时可促进缺氧环境诱导的Bcl-2蛋白表达。以上结果均表明,多肽K-YFAE可以增强H9C2心肌细胞的缺氧耐受。
多肽K-YFAE的前体蛋白Crip2可能通过与Wnt信号通路的重要蛋白质Wnt3a相互作用,调控Wnt信号通路,参与心肌细胞生长发育的调控。研究显示,Wnt3a在胚胎心肌发育中可能具有促进作用,并且主要作用在分化早期阶段;Wnt3a的减少会破坏心脏菱形肌r6中的Crip2表达,并导致心脏神经嵴细胞异常迁移、心脏功能受损及咽弓发育的破坏[14]。在心衰大鼠心肌中,Wnt3a表达上升可能是一种机体自我保护的正反馈机制,可以减少心衰细胞凋亡,具体的作用机制可能与其下游通路以及caspase-3的下调有关[15]。在小鼠出生7 d、心脏失去再生能力后,Crip2蛋白来源的多肽K-YFAE在心脏中的含量明显下降,这可能是因为Crip2蛋白与Wnt3a相互作用,从而对心肌细胞生长发育起到抑制作用。在心肌梗死中,心肌处于缺血、缺氧状态,蛋白Crip2可能会通过上调Wnt3a表达减少心肌细胞凋亡。由于Wnt信号通路机制复杂,故Crip2蛋白与Wnt3a是否具有互相调控的作用,尚需要进一步研究。而多肽KYFAE有望成为此通道新的研究对象,且因其易合成、毒性低、相对分子质量小、特异性强等优势,或可为心脏再生或心肌梗死提供新的治疗策略。
综上所述,多肽K-YFAE既可以促进H9C2心肌细胞的增殖,又可以增强H9C2心肌细胞的缺氧耐受,发挥与其前体蛋白Crip2相近的作用,而Crip2蛋白可能参与调控Wnt信号通路,具体机制尚待进一步研究。