植物低温响应的分子机制研究进展
吴 丹,毛东海,赵小英
(1.湖南大学生物学院植物功能基因组学与发育调控湖南省重点实验室,中国湖南 长沙 410082;2.中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,中国湖南 长沙 410125)
低温影响植物的生长发育与地理纬度分布,低温灾害是造成作物减产的主要逆境之一。随着全球气候变化加剧,低温冷冻等极端气候将会更为频繁发生。因此,研究植物如何响应低温胁迫对于保障经济作物生产与粮食安全等重大问题有着重要的理论与实践价值,植物低温响应分子机制研究一直是植物研究领域中的热点话题。本文将根据相关研究现状,围绕已知信号途径从植物对外界信号的感知、细胞内的信号传递、信号通路中的信号转导以及植物激素等与低温信号的交叉反应进行论述。
1 植物的低温响应
1.1 植物对低温的生理响应
根据低温程度的不同,低温胁迫可以划分为冷害(0~20℃)和冻害(<0℃)[1~2]。在热带和亚热带气候区,冷害是主要的低温胁迫,影响着水稻、玉米等作物的生产;在温带气候区,冻害是主要的低温胁迫,影响着小麦、油菜等作物的生产。两种低温胁迫都会改变植物的细胞结构、生理代谢平衡以及蛋白质活性等,从而影响植物的生长发育[1]。在冷害条件下,细胞膜结构发生改变,导致细胞内电解质的渗漏;细胞内氧化代谢平衡失调,造成活性氧(reactive oxygen species,ROS)的积累,引发细胞膜脂类的过氧化,造成细胞膜系统损伤,并促使多聚不饱和脂肪酸降解为丙二醛(malondialdehyde,MDA),进而损害植物组织和细胞;植物细胞的叶绿素合成与叶绿体形成减少,光合作用受到抑制[3]。蔗糖是花粉粒中淀粉合成的底物,在水稻花粉母细胞减数分裂时期,低温引起蔗糖分解酶的活性降低和单糖转运蛋白的表达下调,使得花药中的蔗糖等物质不能供应到绒毡层和花粉粒,从而导致花粉不育,种子结实率下降[4]。在冻害条件下,植物会出现更严重的伤害,冻结温度促进植物组织的细胞外质体(细胞间隙)结冰,细胞间冰晶物质的积累破坏了细胞膜结构,造成细胞外水势下降,导致细胞脱水严重[5]。总之,低温胁迫影响植物的生长与发育,严重时会导致农作物减产。
1.2 植物的冷驯化
适应温带地区生长的植物在长期进化过程中,已经发展出一套复杂的机制,使它们能够承受低温胁迫。例如,模式植物拟南芥在经过0℃以上的冷处理后,可以获得对0℃以下冻害的抵抗能力,该过程被称为冷驯化(cold acclimation,CA)[6]。冷驯化的分子机制是适度低温可以激活低温响应基因(cold responsive genes,COR)的表达,使机体合成渗透保护剂合成酶、分子伴侣以及抗氧化酶等蛋白质,从而在更低温度条件下保护细胞中的生物大分子与生物膜等[2,5,7~8]。水稻虽然起源于热带或亚热带地区,各个时期对低温都敏感,但是也存在类似的冷驯化现象,即适当低温预处理,可以获得对更低温度的耐受性。研究人员通过分析低温响应关键基因CBF/DREB1(C-repeat binding transcription factor/dehydrate responsive element binding factor)的表达及进化关系,证明低温响应分子机制在较为耐冷的拟南芥与低温敏感的水稻之间存在一定保守性[9]。
2 低温信号转导途径
2.1 植物感知低温信号的受体
在植物中,温度的波动会导致细胞膜流动性的改变,细胞骨架的重新排列,引发Ca2+的胞质流向,随后触发低温响应,从而产生低温耐受性。因此,细胞膜的流动性与细胞骨架的构象改变被认为是潜在的低温感受器[10]。Ca2+作为第二信使,低温胁迫会诱导它在细胞质内的增加,这提示位于细胞膜上的Ca2+通道,可能是植物感受低温的最初靶标。在拟南芥中,Ca2+运输相关的环核苷酸门控离子通道(cyclic nucleotide-gated channels,CNGCs)对植物感受温度以及植物对温度的响应起着很重要的作用[11];在水稻中,G蛋白调节因子COLD1(chilling tolerance divergence 1)与G蛋白α亚基(G-protein alpha subunit,RGA1)形成复合体,增强G蛋白的GTP酶活性,并可能存在Ca2+通道功能,促进Ca2+流向细胞质,激活低温响应,增强水稻低温耐受性(图1)。重要的是,COLD1基因存在自然变异,将温带粳稻来源的等位基因导入到低温敏感的籼稻品种中,能增强植物耐冷性[12~13]。此外,光敏色素B(photosensitive pigment B,PHYB)作为光受体,近期也被证实拥有温度计时器的功能,耦合了对光与温度的信号感知[14~17],但是,光受体是否为低温受体,还有待深入研究。

图1 拟南芥和水稻冷信号蛋白激酶的调控网络[8]Fig.1 Regulatory network of protein kinases in cold signalling in Arabidopsis and rice[8]
2.2 植物Ca2+信号受体对低温信号的传递
植物需要Ca2+信号受体将外界低温信号转换为细胞内的信号。这些Ca2+信号受体包括钙调蛋白(calmodulin,CaM)、类钙调蛋白(CaM-like protein,CML)、Ca2+依赖蛋白激酶(Ca2+-dependent protein kinase,CDPK)以及钙调磷酸酶B类蛋白(calcineurin B-like protein,CBL)(图1)[2,18]。这些蛋白质富含EF手型结构域(elongation factor-hand domain,EFBD),可以通过与Ca2+结合使蛋白质构象发生改变,从而激活蛋白质活性,与其他蛋白质相互作用,并对效应蛋白发挥激酶或磷酸酶的功能[19~21]。其中,结合Ca2+的CaM蛋白,可以结合并磷酸化钙调蛋白结合转录激活因子(calmodulin binding transcription activators,CAMTAs)(图1)。在这类蛋白质中,CAMTA3和CAMTA5对温度的快速下降有响应,并诱导下游基因DREB1的表达,但它们对温度的逐渐降低没有响应[22]。CDPK可以通过丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)级联反应传递低温信号。该MAPK级联反应涉及3种蛋白激酶,包括MAP3K、MAP2K和MAPK。MAP3K在保守的丝氨酸/苏氨酸残基处磷酸化MAP2K;活化的MAP2K磷酸化MAPK,活化的MAPK再激活下游的效应蛋白,引发低温响应[3]。例如,拟南芥或水稻中的CRLK1(calmodulin-regulated receptor-like kinase 1)和CRLK2启动一个MKK4/5-MPK3/6(MAP kinase kinase 4/5-MAP kinase 3/6)级联,拮抗MEKK1-MKK2-MPK4(MAP/ERK kinase kinase 1-MAP kinase kinase 2-MAP kinase 4)通路,使 ICE1(inducer of CBF expression 1)或 OsICE1磷酸化,从而改变蛋白质的稳定性,进而影响COR表达与植物低温耐受性(图1)[23~25]。CBLs作为Ca2+信号传感器,通过与CBL相互作用的蛋白激酶(CBL-interacting protein kinases,CIPKs)相互作用,将冷应激引起的Ca2+瞬态传递到磷酸化事件中。在拟南芥中,CBL1和CIPK7的转录表达在4℃低温处理时,分别在3 h和12 h达到高峰期;在Ca2+存在时,CBL1和CIPK7存在互作;cbl1突变体对低温更为敏感,这些表明CBL1和CIPK7在植物低温响应中起着重要作用,它们不仅通过Ca2+传递低温胁迫信号,同时也通过ROS信号和激素信号在植物体内传递生物胁迫和非生物胁迫(图1)[26~27]。在水稻中,OsCIPK1、OsCIPK3和OsCIPK9受低温诱导表达,其中OsCIPK3被证实正调控水稻耐冷性[28],但是OsCIPKs的下游调控途径有待深入研究。
2.3 植物常见的低温响应信号通路:CBF/DREB1途径
在植物中,研究较为透彻的低温响应信号通路为CBF/DREB1信号途径,其上下游的主要模块为ICEs-CBF/DREB1s-CORs。拟南芥中有3个CBF基因:CBF1、CBF2和CBF3,在低温条件下,CBF基因的表达量增加,同时作为转录激活因子结合其下游COR基因的启动子并调节基因的表达,从而增强植物低温耐受性[18]。ICE1编码一个类MYC型的碱性螺旋-环-螺旋(basic helix-loophelix,bHLH)转录因子,ICE1蛋白能够结合CBF3的启动子调节CBF3的表达[29]。ICE2是ICE1的同源蛋白,能够通过调节CBF1的表达,正调控植物对低温的响应(图2)[30]。其他可调控CBF基因表达的各类转录因子还包括:正调控因子CAMTA、MYB56(myeloblastosis 56)等,负调控因子MYB15、MYBS3、PRRs(pseudo response regulators)等(图2)[3]。CBF与COR基因的表达受到转录后修饰的调节。例如,C端结构域磷酸酯样蛋白(C-terminal domain phosphatase-like protein,CPL1)参与CBF的mRNA剪切;STA1(signal transducer and activator of transcription 1)与CBF基因表达调控因子1(regulator of CBF gene expression 1,RCF1)参与COR的mRNA剪切(图2);NUP60(nucleoporin 60)影响CBF mRNA的核外输出,它们都会影响植物的低温耐受性[31~34]。CBF信号通路受到翻译后修饰的调节。例如,该通路中的MYB15、ICE1与CBF调控因子,以及与其存在信号交叉的脱落酸(abscisic acid,ABA)信号通路的气孔调控因子OST1(open stomata 1),都会受到各种翻译后修饰,包括:泛素化(ubiquitination)、SUMO 化(sumoylation)、磷酸化(phosphorylation)以及豆蔻酰化(myristoylation)等,使蛋白质的稳定性、活性或定位情况发生改变,从而调节CBF信号通路,最终影响植物低温耐受性[1,3,23,35~40]。此外,各类表观遗传机制通过CBF信号通路调节植物低温耐受性。例如,长链非编码RNA(long non-coding RNA,lncRNA)对低温响应基因的抑制[41],组蛋白乙酰化与去乙酰化对基因表达的调控[42~46],组蛋白甲基化修饰对基因表达的调控[47]以及DNA的甲基化[48~49],最终都会影响COR基因的表达与植物低温耐受性。
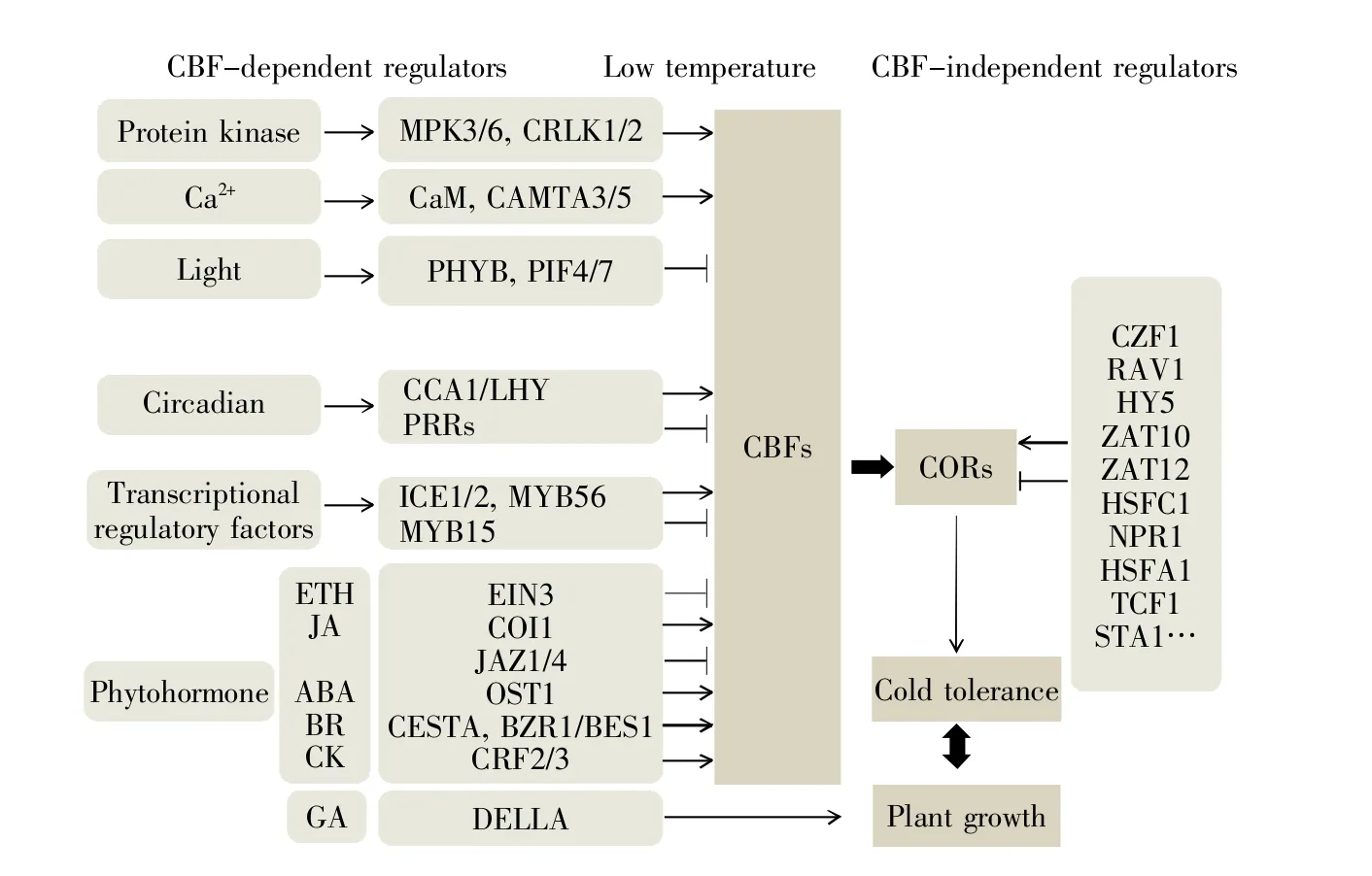
图2 植物中CBF依赖/非依赖途径的正调控和负调控因子[3]Fig.2 Positive and negative regulators of the CBF-dependent and CBF-independent pathways in plants[3]
2.4 植物激素与CBF信号通路的交叉
越来越多的证据表明,各种植物激素参与植物对低温的响应。乙烯(ethylene,ETH)、茉莉酸(jasmonic acid,JA)与ABA为植物逆境激素,现有报道证实它们都参与植物对低温的响应。在拟南芥中,施加乙烯合成抑制剂可以增强植物低温耐受性;乙烯信号通路中的关键转录因子乙烯不敏感因子3(ethylene-insensitive 3,EIN3)抑制CBF基因的表达;乙烯信号途径中各个组分的突变体,如抗乙烯突变体1-1(ethylene-resistant 1-1,etr1-1)、ein2-5、ein3-1 和 ein4-1 等,都表现为低温耐受性增强表型[50];EIN3蛋白与F-box蛋白EBF(EIN3-binding F-box)1和2结合后,通过26S蛋白酶体途径降解,从而激活CBF的表达,增强植物低温耐受性(图2)[16,50]。因此,在拟南芥中,乙烯负调控低温耐受性。然而,在番茄或烟草等农作物中,过表达乙烯响应因子(ethylene responsive element binding factor 2,ERF2)促进植物体内乙烯的合成,进而增强植物低温耐受性[51]。可见,乙烯参与植物低温响应存在物种差异性,但是具体的分子机制仍不清楚,需要进一步研究。在拟南芥中,施加茉莉酸甲酯(methyl jasmonate,MeJA)可增强其低温耐受性,而且低温处理会增加植株体内茉莉酸的含量。此外,茉莉酸合成途径的脂肪氧合酶2突变体(lipoxygenase 2,lox2)表现为低温敏感,该信号途径正调控因子COI1(coronatine insensitive 1 like)的突变体或负调控因子JAZ(jasmonate ZIM-domain)l/4的过表达也均表现为低温敏感。而且,JAZ1和JAZ4与ICE1存在互作,并抑制ICE1的转录活性(图2)[52]。在水稻中,茉莉酸代谢酶HAN1(chilling tolerance 1)可以将活性的JAIle(jasmonoyl-isoleucine)转化为非活性的12OHJA-Ile(12-hydroxy-jasmonoyl-isoleucine),进而调控茉莉酸介导的低温反应[53]。由此可见,茉莉酸正调控植物低温耐受性。现有研究显示,给果实施加茉莉酸甲酯,可以降低果实收获后的低温伤害[54~55]。在拟南芥中,ABA合成途径中的突变体aba3表现为对低温更敏感,而其过表达植株获得更强低温耐受性[56~57]。而且,许多COR基因的启动子中存在ABRE(abscisic acid response element)顺式元件,这间接证实ABA信号通路与植物耐冷性相关[58]。OST1作为ABA信号通路中的重要调控因子,通过磷酸化修饰并稳定ICE1蛋白活性,调节CBF基因的表达与植物耐冷性(图2)[36,58~60]。可见,ABA正调控植物低温耐受性,外施ABA处理能促进植物耐冷性。油菜素内酯(brassinolide,BR)、赤霉素(gibberellin,GA)以及细胞分裂素(cytokinin,CK)是植物生长激素,现有报道证实它们也参与植物对低温的响应。在拟南芥中,BR信号传递缺陷突变体无论有无经过冷驯化都增加了植物冷耐受性;相反,该信号传递的组成性激活能使得植物对低温更敏感[61]。受BR调控的 bHLH转录因子CESTA可以促进CBF及其下游COR基因的表达;CES也可以促进不依赖于CBF信号途径的COR基因的表达(图2)[62]。BR信号通路中的负调控因子BR不敏感型2(brassinosteroid-insensitive 2,BIN2)编码一个糖原合成酶激酶3(glycogen synthase kinase-3,GSK3),当BIN2突变后,植物耐冷性更强;它可以通过其下游的转录因子BES1/BZR1(bri1-ems-suppressor 1/brassinazole-resistant 1)和CES进行磷酸化修饰从而降解,这些转录因子通过不同顺式元件结合CBF基因的启动子,从而调节CBF基因的表达,最终影响植物耐冷性[61~62]。可见,BR正调控植物低温耐受性。研究报道,给农作物黄瓜施加BR类似物(24-epibrassinolide,EBL)可以增强植物低温耐受性[63]。
在拟南芥中,CBF1的组成型表达使得植物低温耐受性增强,但也减缓了植物生长。这是由于CBF信号通路与GA信号途径存在交叉。低温可以诱导CBF基因的表达,也可以诱导GA代谢酶基因GA2oxs(gibberellin 2-oxidases)的表达,使植物体内GA含量减少,促进DELLA蛋白积累。DELLA是GA信号途径中的植物生长抑制因子,活性GA通过降解DELLA蛋白释放其对植物生长的抑制效应。组成性表达CBF1的转基因植物积累的生物活性GA较少,因此表现出矮化和晚花。当CBF1在DELLA缺失突变体中表达时,这两种表型都受到抑制[64]。棉花中存在相同的情况。GhDREB1基因的启动子既含有低温响应元件也含有GA响应元件。低温可以诱导GhDREB1的mRNA积累,而外施GA可以抑制GhDREB1的mRNA积累。过表达GhDREB1的转基因植物表现为低温耐受性增强,但是在正常条件下,植物生长受阻,变得更矮小[65]。低温可以通过诱导DELLA蛋白的积累直接抑制植物生长发育,而DELLA蛋白也可以与生长调节因子(growth regulator factors,GRF)相互作用从而抑制植物的生长[66~69]。此外,低温影响内源CK水平。在农作物水稻与小麦中,低温降低内源CK的含量。但是在拟南芥中,CK对植物低温耐受性的调控机制尚无定论。拟南芥中的双组分信号系统(two-component signaling system,TCS)是细胞分裂素信号转导的关键组分。细胞分裂素受体的双突变体ahk2ahk3和ahk3ahk4表现为低温更敏感[70];该通路中的拟南芥响应调控因子7(Arabidopsis response regulator 7,ARR7)突变时,植物变得更耐低温[70~72]。细胞分裂素应答因子(cytokinin response factor,CRF)2/3编码 AP2/ERFs(apetala 2/ethylene response factors)转录因子,在低温胁迫下对拟南芥侧根形成起重要作用。CRF2和CRF3分别通过TCS依赖性或TCS非依赖性途径响应低温,并控制侧根的起始和发育。与野生型相比,crf2和crf3单突变体或双突变体在冷胁迫下的侧根发生率降低;相反,CRF2或CRF3过表达导致侧根密度增加[73]。
2.5 生物钟和光周期与CBF/DREB1信号通路的交叉
生物钟可以调控低温响应基因的表达。例如,在常温条件下,CBF基因的表达表现出昼夜节律性;当生物钟关键基因CCA1(circadian clockassociated 1)和 LHY(late elongated hypocotyl)同时突变时,CBF基因的表达节律性丧失,COR基因的表达量下降,从而使植物低温耐受性降低(图2)[74]。可见,在白天与黑夜的不同温度条件下,植物通过生物钟可以平衡生长与低温耐受性。同样,有报道称,日照长短可以调节植物CBF与COR基因的表达。CBF和COR基因在长日照下的表达量要比在短日照条件下的高。当植物的光敏色素基因PHYB以及光敏色素互作因子4/7(phytochrome interacting factors 4/7,PIF4/7)突变时,突变植株的CBF与COR基因的表达量在长日照条件下也变得更高。可见,植物通过PHYB、PIF4和PIF7在长日照下负调控CBF途径(图2)[75]。此外,拟南芥的光形态建成负调控因子PIF3可以结合CBF的启动子并抑制CBF基因的表达,从而负调控植物耐冷性[16]。这些研究结果说明,植物通过对日照长短感知调整自身对温暖季节和寒冷季节的适应性,实现生长与低温耐受性的平衡。上述已经提到,PHYB既是光受体又是温度计时器,这证实了光信号与低温信号存在交互作用[14~17,59]。可见,植物通过光信号调整自身生长发育使其适应所处的不同温度条件下的生长环境。
2.6 植物中其他非CBF的低温响应信号通路
在上述各种低温响应调控中,大多数与CBF信号通路相关,但是还有许多COR基因的表达不受CBF信号通路调控。研究人员在CBF过表达植株和cbf1cbf2cbf3突变体中发现,约4 000个COR基因参与低温响应,但是其中只有数百个受CBF调控,表明除了CBF途径之外,植物中还存在其他众多的信号通路参与调节COR的表达[76~77]。目前,已经发现的可调节COR基因表达并与CBF无关的转录因子包括:HSFC1(heat shock transcription factor C1)、ZAT10/12(zinc finger transcription factor 10/12)、RAV1(related to ABI3/VP1)、CZF1[zinc finger(CCCH-type)family protein]和HY5(elongated hypocotyl 5)等(图2)[3]。其中, 转录因子HSFA1(heat stress transcription factor A1)在低温条件下,受到水杨酸(salicylic acid,SA)受体NPR1(nonexpresser of PR genes 1)的激活,然后通过非CBF途径调控COR基因的表达和植物对低温的耐受性(图2)[40,78];油菜素内酯调控因子BZR1,除了通过CBF信号通路,还通过其他途径调节COR基因的表达[61];拟南芥T细胞因子1(T cell factor 1,TCF1)通过木质素合成途径BCB-PAL1/PAL2(blue-copper-binding-PHE ammonia lyase 1/2)调控植物低温耐受性(图2)[79]。因此,在调控植物低温耐受性上,不依赖CBF的其他信号通路也发挥着重要的作用,但是其调控机制还有待进一步研究。
3 总结与展望
综上可知,植物低温响应分子机制的研究已有重大的进展与突破,尤其在植物CBF/DREB1依赖型的低温响应信号途径的转录调控、转录后调控以及翻译后修饰等方面。然而,目前研究较为深入的是CBF/DREB1途径,其他不依赖于CBF/DREB1的低温响应信号途径尚缺乏深入研究。其次,植物低温响应的表观遗传学规律值得探讨。Park等[46]研究表明,在拟南芥遇到低温胁迫时,HOS15(high expression of osmotically responsive gene 15)能促进组蛋白脱乙酰酶2C(histone deacetylase 2C,HD2C)的降解,从而促进COR基因转录,说明染色质状态的重塑在植物低温应激反应中起到非常重要的作用。那么,通过多梳抑制性复合物1/2(polycomb repressive complex 1/2,PRC1/2)对组蛋白进行甲基化修饰的其他表观调控机制是否与植物耐低温有密切联系?这有待探究。第三,在模式植物拟南芥中,人们当前更侧重于植物营养生长时期低温胁迫响应分子机制的研究,缺乏对其生殖生长时低温响应分子机制的研究。随着全球气候变化加剧,各种农作物在营养生长时期和生殖生长时期都会更加频繁遭遇低温胁迫,从而导致作物减产。因此,在植物低温响应分子机制的研究领域中,需要发挥拟南芥作为模式植物的研究优势,启动各个时期尤其是生殖生长时期,低温胁迫响应的分子机制研究工作,为农作物各个时期尤其是生殖生长时期耐低温分子机制研究及其分子育种提供理论参考与基因资源。第四,由于物种差异性,作物低温响应分子机制的研究需要加强。目前,植物低温响应分子机制的研究主要在模式植物拟南芥中开展,而该植物为温带植物,其通过长期在温带低温生长环境的适应与驯化,获得了较强的低温耐受性。然而许多重要农作物,例如水稻与玉米等,都是起源于热带或亚热带地区,对低温较为敏感。因此,这些低温敏感农作物的低温响应分子机制,可能与较为耐低温的拟南芥存在一定程度的物种差异性。而且,当前农作物低温响应的分子机制研究没有拟南芥的那么宽广与深入,因此,针对农作物需要开展更深入、更全面的基础研究。第五,低温响应关键基因的优异等位值得发掘。在上述的各种低温响应基因中,绝大多数基因缺乏自然变异分析与优异等位的发掘,所以还不能直接应用于农作物的育种实践中。目前,在重要农作物(如水稻)中已发掘的优异耐低温等位基因有:控制低温萌发的qLTG3-1(low-temperature germinability 3-1)、控制苗期耐低温的COLD1与HAN1、同时控制苗期与孕穗期耐低温的bZIP7(basic leucine-zipper 7)以及控制孕穗期耐低温的CTB4a(cold tolerance at booting stage)等[12,53,80~83]。可见,当前能直接用于作物耐低温育种的基因资源很有限。第六,作物耐低温分子育种的技术手段有待更新。随着基因组编辑技术的日趋完善,我们可以利用该技术扩展耐低温基因对作物遗传改良的潜力。多数耐逆基因的表达既影响耐逆性状也影响生长发育,例如低温响应的关键基因OsDREB1G,在植物中稳定高表达该基因,虽然可以增强植物耐冷性,但是同时会抑制植物生长发育[84]。因此,我们可以利用基因组编辑技术在其启动子区域进行定点插入或缺失,改变其调控元件,从而在维持基因功能活性不变的前提下,适当改变基因的转录水平,从而使得作物在正常气候条件下保持高产,在低温逆境气候条件下稳定产出。总之,结合对植物低温响应分子机制的理解与生物技术的利用,培育出高产耐逆的绿色农作物将成为现实。