PD-1抑制剂治疗肝癌常见不良反应的观察与护理
赵汝平,骆惠芬,陈柳坚,吴镜强,周静文,周群芳
肝癌是常见的恶性肿瘤之一,成为全球第六大常见癌症,也是全球癌症死亡的第四大原因[1]。我国肝癌治疗方法包括肝切除术、局部消融治疗、全身治疗等多种手段,5年生存率仅为12.1%[2-3],效果令人不满意。随着医疗技术的发展和人们对肿瘤免疫机制的不断深入研究,程序性细胞死亡蛋白-1(PD-1)抑制剂广泛应用于治疗肝癌中[4-5],PD-1抑制剂主要通过阻断 PD-1的通路,恢复T细胞抗肿瘤活性,进而达到清除肿瘤的目的[6]。PD-1抑制剂在治疗肝癌的临床益处是显著的,总体有效率更高[7-9]。然而,PD-1抑制剂在临床应用的不良反应发生率为58.0%~94.1%[10-12]。因此,PD-1抑制剂相关的不良反应逐渐引起临床的重视。免疫相关不良事件(immune-related adverse events,irAEs)可累及全身所有脏器,大部分经早期皮质醇治疗后可改善,但仍有少数严重的irAEs最终导致死亡[13]。国内目前对于应用抗PD-1抑制剂治疗肝癌后,病人出现免疫相关不良反应的护理文献报道较少,且尚未形成规范。为了使发生不良反应的病人缓解症状及缩短持续时间,因此有必要制定针对性的护理措施。为此,本研究观察104例肝癌病人使用PD-1抑制剂治疗过程中出现的不良反应,并总结针对性护理措施。现报告如下。
1 资料与方法
1.1 一般资料 收集2019年1月—2019年12月于我科接受PD-1抑制剂治疗的肝癌病人的临床资料。纳入标准:①病人病理或临床诊断均为原发性肝癌;②年龄>18岁;③所有病人仅输注一种PD-1抑制剂。排除标准:④输注2种及以上PD-1抑制剂的肝癌病人;②病人随访不规律及临床资料不完整的肝癌病人。主要使用PD-1抑制剂种类为卡瑞利珠单抗、特瑞普利单抗、信迪利单抗、纳武利尤单抗、帕博利珠单抗。本研究104例病人纳入研究。
1.2 方法 以2017年美国卫生及公共服务部常见不良事件评价标准(CTCAE)5.0版为依据观察肝癌病人在使用PD-1抑制剂期间发生不良反应的情况,包括不良反应的类别、分级、发生时间、持续时间、处理方案、预后等。通过总结护理工作经验,制定针对输注相关不良反应、内分泌毒性、胃肠道毒性、皮肤毒性等护理措施。
2 结果
104例接受PD-1抑制剂肝癌病人中,根据巴塞罗那肝癌临床分期(BCLC),本研究中C期病人6例,B期86例,A期12例。其中男94例,女10例,年龄26~78岁,中位年龄52岁。所有病人共接受291次PD-1抑制剂输注,平均每人2.8次。本组104例病人中77例同时服用分子靶向药,发生皮肤毒性8例,27例没有服用分子靶向药,发生皮肤毒性有2例,发生率分别为10.4%(8/77)和7.4%(2/27)。104例病人中,59例病人发生不良反应,发生率为56.7%,见表1。18例发生输注相关不良反应,发生率为第1位,为17.3%,主要级别为1级、2级。12例发生内分泌毒性,占比11.5%,其中3例为高血糖,9例为甲状腺功能低下。14例(13.5%)为消化道毒性,其中12例(11.5%)为肝毒性[天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)]升高,且9例级别为1级或2级。10例(9.6%)出现皮肤毒性,其中8例有同时服用肝癌靶向药。3例(2.9%)病人发生肺毒性。除1例出现免疫性肺炎导致全身多器官衰竭死亡外,其余病人基本能通过护理处理,症状达到基本缓解,从而顺利出院。
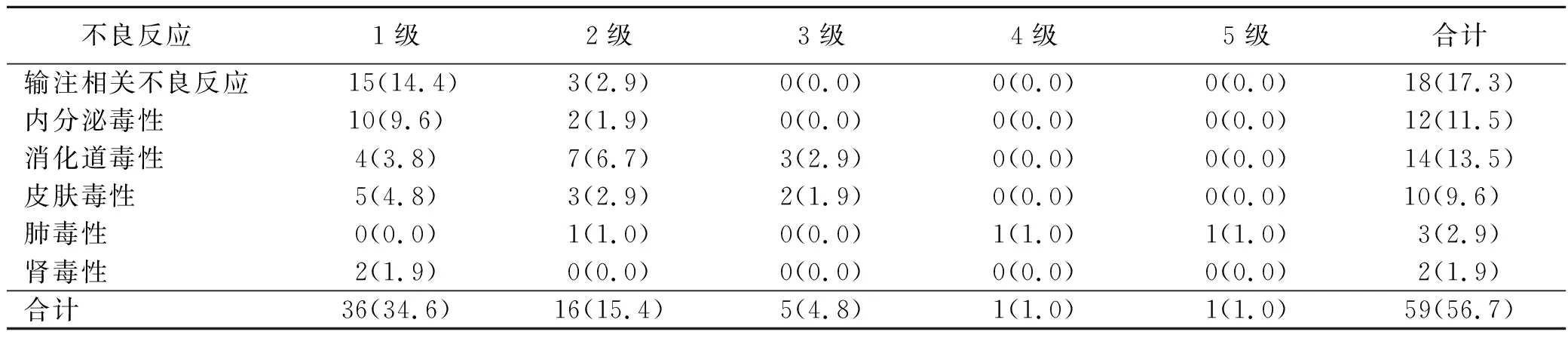
表1 PD-1抑制剂治疗肝癌的不良反应发生情况(n=104) 单位:例(%)
3 护理
3.1 输注相关不良反应的护理 本组18例发生输注相关不良反应,发生率为17.3%。其中发热8例,头晕3例,关节痛2例,瘙痒3例,面部潮红/头痛1例,高血压1例,低氧血症1例。其中14例发生为第一次输注PD-1抑制剂时,3例为第2次输注PD-1抑制时,1例为3次输注时均有输注相关不良反应。因此病人首次输注PD-1抑制剂时要观察病人输注相关不良反应的发生,并做好病人输注时的对症处理和宣教。以下为我科制定统一的药物配制与输注流程:PD-1抑制剂从冰箱取出后常温放置20~30 min后使用0.9%氯化钠注射液100 mL稀释药物,同一方向轻轻混合2次后静置混匀。药物配制做到现配现用,即从冰箱取出到输注时间不超过1 h。采用专用过滤输液器,输注过程用输液泵控制时间为60 min,输注前后用0.9%氯化钠注射液100 mL冲洗静脉通道。
输注前要测量体温、脉搏、血压、血氧饱和度,如病人体温>38.0 ℃,要先退热后再输注。同时,输注前要评估病人既往不适症状,如有应向主管医生汇报后再决定是否输注。在输注过程中病人若出现不良反应时应先暂停输注,向医生汇报。并详细询问病人症状,通过对症处理缓解,可考虑继续输注。输注完毕后,要求病人继续于病房平躺1 h,无不适再活动。本研究所有病人发生的输注相关不良反应均为1级、2级,在对症处理缓解后可继续行PD-1抑制剂输注,无再次出现相关输液不良反应。
3.2 内分泌毒性的护理 本组12例发生内分泌毒性。3例为高血糖,针对这类病人,指导其少进食高糖食物,控制摄入热量,输注后动态监测血糖24 h。另有9例为甲状腺功能低下,是最常见的内分泌毒性。主要为甲状腺功能减退,游离三碘甲状腺原氨酸(FT3)值低于正常水平,波动范围为2.70~3.80 pmol/L,促甲状腺素(TSH)值高于正常水平,波动范围在6.72~56.38 mIU/L。临床表现为疲乏、虚弱、食欲不振、恶心、呕吐。嘱病人规律口服优甲乐,并定时复查甲状腺功能5项以调整优甲乐剂量[14]。本组病人的内分泌毒性经过积极治疗与护理后,均能恢复至正常,而不影响后续的治疗。
3.3 消化道毒性的护理 本组14例发生消化道毒性,其中肝毒性12例,占11.5%。12例肝毒性中9例为1级、2级,3例为3级。主要表现为AST、ALT升高,并常伴有疲乏、食欲减退、腹胀等症状,而总胆红素升高较为少见。肝毒性常出现在首次用药后的6~10周内。2例出现免疫性肠炎,为3级不良反应。
当病人出现1级、2级肝毒性时,根据病人病情给予合理饮食指导。饮食应以优质蛋白、高维生素为宜,避免过多的摄入高热量、高脂肪和辛辣刺激的食物。同时进行护肝治疗,定时复查肝功能指标[15]。当病人出现3级肝毒性时,同时伴有中度腹水及低白蛋白血症(低于35 g/L),应每天记录病人出入量、测腹围、体重,及时利尿及补充白蛋白,做好对症护理,警惕肝衰竭、肝性脑病的发生。
本组2例病人出现免疫性肠炎,均是为接受帕博利珠单抗治疗。主要症状为:腹痛、腹泻、黏液血便、体重下降。肠镜检查可见:弥漫性点片状溃烂表面均覆盖点状白苔,黏膜表面见渗出。病人发生免疫性肠炎时,要严密观察病人的大便次数、性质、量、颜色,同时注意病人腹部症状,动态观察血红蛋白含量、红细胞沉降率等变化。本组2例免疫性肠炎经过激素治疗后症状得到有效控制。
3.4 皮肤毒性的护理 本组10例发生皮肤毒性,占比9.6%。主要表现为斑丘疹、瘙痒、脱皮、脱发、皮肤苔藓样疹。脱皮主要发生在躯干和双上肢。其中1例有银屑病的病人,在使用PD-1抑制剂前症状处于稳定状态,然而接受PD-1抑制剂治疗后,银屑病出现病情加重。临床表现为全身脱屑、皮损明显。皮肤毒性发生的中位时间为4周,其中4例病人发生在输注当天。皮肤毒性多为1级、2级,经对症处理后一般1~3 d可缓解。3级以上则需持续治疗2周或以上。
在病人出现皮肤症状时,指导病人要保持皮肤清洁、干燥,禁忌使用热水、冷水、肥皂水清洗皮肤。同时需剪短指甲,避免抓伤皮肤。穿宽松柔软的棉质透气衣服,避免日光直接照射皮肤,外出做好防晒[16]。当病人出现明显的皮疹和瘙痒时,需口服氯雷他定抗组胺药物及指导病人使用保湿乳膏[12]。本组2例出现3级皮肤毒性不良反应。通过口服糖皮质激素联合使用尿素软膏或类固醇药膏(倍他米松软膏)外涂,症状可得到缓解。若对症处理后症状无缓解,需停止继续输注PD-1抑制剂。
4 小结
PD-1抑制剂不良反应表现在全身多个器官,其中最常见不良反应的是皮肤毒性,发生率为34%~45%,内分泌毒性发生率为5%~10%,消化道毒性发生率<19%,相关输注不良反应发生率为10%[12,17-19]。但本研究中相关输注不良反应是最常见的不良反应,而皮肤毒性的发生率只有9.6%。本组104例病人中77例同时服用分子靶向药,发生皮肤毒性8例,27例没有服用分子靶向药,发生皮肤毒性有2例,发生率分别为10.4%(8/77)和7.4%(2/27)。分子靶向药也会引起皮肤的不良反应[20-21],目前靶向药物的皮肤不良反应护理已有文献报道[22],和免疫抑制剂的皮肤护理相似,值得借鉴。
本组病人出现肝毒性的发生率达11.5%,104例接受PD-1抑制剂治疗的肝癌病人中,有46例是行肝动脉栓塞术后1周内接受输注,发生肝毒性有8例,58例1周内没有行肝动脉栓塞术,发生肝毒性有4例,肝毒性发生率分别为17.4%(8/46)和6.9%(4/58)。肝动脉栓塞术会导致肝功能的损害[23],在护理术后使用PD-1抑制剂肝癌病人时要警惕肝毒性的发生,并做好动态观察病人肝功能的变化。
本组有1例病人在接受PD-1(纳武单抗180 mg)2次治疗后出现免疫相关性肺炎,属于PD-1治疗后少见的并发症[24-25]。病人在第2次治疗后10周因出现呼吸困难入院,但经过积极治疗1周后因多器官衰竭而死亡。既往文献报道,对2级、3级的免疫性肺炎,通过激素治疗可缓解[23,26],但对病情发展迅速且危急的免疫性肺炎重症病人,目前缺乏可参考的护理经验。通过分析,认为护理重点在于纠正病人低氧血症,保持呼吸道通畅,当病人出现呼吸困难,血氧进行性下降,应进行详细全面评估,及早干预并送重症监护室治疗。
综上所述,PD-1抑制剂治疗肝癌病人的不良反应主要包括输液相关不良反应、内分泌毒性、消化道毒性、皮肤毒性、肺毒性、肾毒性。在临床工作中不断观察不良反应的发生,总结出针对性护理措施,为护理临床工作提供参考。同时可以缓解不良反应症状及缩短持续时间,保证治疗的顺利进行。本研究的不足是样本量较小,今后将进一步增大样本量并通过对照研究加以验证护理干预的临床效果,同时形成规范的护理措施。

