苦参提取物防龋作用的动物实验研究
谢雪洁 吴泽钰 宋 洁 范文献 赵 今
龋病是全世界分布最广泛的细菌性慢性疾病之一,虽然随着社会经济的发展,近几年发病率有下降趋势,但其发病率仍处于较高水平,全世界约有80~90%的人们受其影响[1]。因此,探索安全可靠、经济有效的防龋措施迫在眉睫。苦参,一种我国应用广泛的传统中药,已被证实低毒且具有很高的药用价值,其主要活性成分苦参碱及氧化苦参碱的抗病毒、抗炎、抗心律失常、抗纤维化等药理作用也已得到充分证实[2~5]。S.mutans能在短期内建立龋病动物模型,在口腔真实的环境中模拟龋病的自然进程。本实验选用S.mut ans UA159,参照改良的大鼠龋病模型进行动物实验[6],旨在以前期体外研究[7]为基础,进一步评估苦参提取物防龋的有效性及安全性。
资料和方法
1.主要仪器及试剂
洁净工作台(上海博迅,SW-CJ-2FD);体式显微镜(Struers Minitom,丹麦);37℃恒温摇床(恒温培养震荡仪,ZWY-240,上海);CLSM(TCS-SP8,德国);苦参(新疆医科大学天然药物研究重点实验室);氯己定(源叶生物,LOT:J25J7Y16622);紫脲酸铵指示剂(源叶生物,LOT:M06GS147307);罗丹明B荧光染料(Solarbio,CAS:81-88-9)。
2.动物及饲料
雄性SPF-SD大鼠36只(新疆医科大学实验动物管理中心),Keyes 2000 diet(Trophic,Nantong,China),通过新疆医科大学伦理委员会审批。
3.致龋菌及培养基
S.mutansUA159标准株,购买于美国模式培养物集存库(american type culture collection,ATCC)脑心浸液培养基(brain heart infusion,BHI):美国BD公司,Lot号:7075659。轻唾琼脂培养基(miltis salivarius agar base,MS):青岛日水生物技术有限公司,Cat.No.10922。
4.实验分组
随机数表法将动物分为6组:2g/L、4g/L、8g/L苦参提取物干预的实验组;0.12%洗必泰(chlorhexidine,CHX)干预的阳性对照组(CHX);无菌蒸馏水干预的龋病模型组(caries group,CA)以及不干预的空白对照组(Control)。
5.实验方法
(1)制备苦参提取物及S.mutans菌悬液:参照前期实验制得苦参提取物母液[7],稀释至2g/L、4g/L、8g/L。选取S.mutans冻存菌株接种于BHI琼脂培养基,80%N2,20%CO2,37℃厌氧培养48h。观察菌落生长形态,随机取单个菌落涂片镜检,无污染且生化鉴定为纯培养后,相同培养条件下培养48h,取形态一致的菌落溶于BHI液体培养基,麦氏比浊法标定菌悬液浓度至106CFU/mL。
(2)建立动物模型:鼠龄21天,随机分组编号。22~24天,内源性细菌的抑制,饲以均匀混有氨苄西林钠(每2g配1000g普通饲料)的饲料及含青霉素钾(80万单位,1瓶配200mL生理盐水)的饮水。25天,口腔拭子检测内源性细菌的抑制情况。26~28天,用浸有饱和S.mutans悬液的棉签感染大鼠口腔(1mL/只)。29天,大鼠口腔拭子检测S.mutans的定植情况。鼠龄25天至实验结束,除空白对照组饲以普通饮食及饮水,其余组均饲以Keyes 2000 diet及5%蔗糖水。实验中期,每只大鼠鼠磨牙拍摄X线片,确认有低密度影像,证实龋齿形成后,继续下一步实验。
(3)药物口腔干预:30~50天,无菌棉签蘸取实验药液(1mL)至饱和,处理大鼠磨牙各牙面及口腔黏膜,剩余药液注入口内含漱,确保药液作用到位。每天干预2次(早晨10点及下午6点),每个象限15s,处理后禁食水2h,持续3周,干预始终由同一操作者完成,每天称重并记录大鼠的健康状况。
(4)标本采集:①唾液:鼠龄50天,腹腔注射0.2%硝酸毛果芸香碱(0.4mL/100g),采集大鼠唾液(100μL/只),稀释1000倍,取10μL均匀涂于BHI琼脂培养基(总菌菌落数)及MS琼脂培养基(S.mutans菌落数),80%N2,20%CO2,37℃厌氧培养12h,由两人分别进行菌落计数[11],S.mutans水平=(S.mutans菌落数/总菌落数)×100%。②颌骨标本:51天,水合氯醛麻醉下处死大鼠,无菌解剖颌骨,高压蒸汽灭菌锅中处理5min,清理颌骨上软组织,在0.4%紫脲酸胺溶液中染色12h。用0.15~0.2mm的线锯,沿颌骨近远中方向将牙列切开,体视显微镜下据Keyes评分法[8]评估大鼠磨牙龋损情况。紫脲酸胺渗入牙齿的大小和深度代表龋损的影响范围和严重程度。根据Keyes法,龋病分为四个等级:纯釉质龋(E)、轻度牙本质龋(Ds)、中度牙本质龋(Dm)和广泛牙本质龋(Dx)。Ds级龋损约占牙釉质至髓室顶间牙本质的1/4;Dm级龋损表示其间约1/4至3/4的牙本质受累,而超过3/4牙本质受累的龋损被标记为Dx级龋损。每颗磨牙光滑面E级龋损记分相加,作为这只大鼠光滑面的E级龋损总记分,同样方法进行窝沟E、Ds、Dm、Dx级龋损记分,所有评分均是双人双评。③主要脏器:采集心、肝、脾、肺和肾脏称重,计算脏器系数(脏器系数=脏器重量/体重×100%)。④口腔黏膜组织:取每只大鼠同一部位口腔颊黏膜,4%多聚甲醛溶液固定24h,HE染色后显微镜观察。⑤牙磨片:用细砂纸将鼠磨牙制成厚约300μm的牙磨片,37℃下避光经罗丹明B荧光染料(0.1mmol/L)染色24h,CLSM下观察牙磨片的荧光激发情况。
6.统计学方法
采用SPSS26.0软件进行统计学分析,以α=0.05作为组间比较的检验水准。计量资料用Shapiro-Wilk行正态性检验,符合正态分布计量资料用均数±标准差(±s)表示,不符合正态分布计量资料用P50(P25,P75)表示,分类资料用例数表示。①符合正态分布计量资料多组间比较,采用方差F检验,组间两两比较用LSD-t法。Mann-Whitney U两独立样本的非参数秩和检验。②不符合正态分布计量资料多组间比较用Kruskal-Wallis H检验,组间两两比较用Bonferroni矫正p法。③计量资料重复测量资料:采用重复测量方差模型,数据不满足球形假设条件采用Greenhouse-Geisser法校正。
结 果
1.S.mutans水平:如表1,组间菌落计数情况比较结果显示,BHI、MS、S.mutans水平差异均有统计学意义(P<0.05)。且经两两比较:BHI指标为CHX组显著低于2g/L组,CA组显著高于其余组别;MS指标为CHX组显著低于2g/L组,CA组显著高于4g/L、8g/L、CHX和Control组;S.mutans水平指标为2g/L组、CA组显著高于4g/L组高于Control组、8g/L、CHX组。
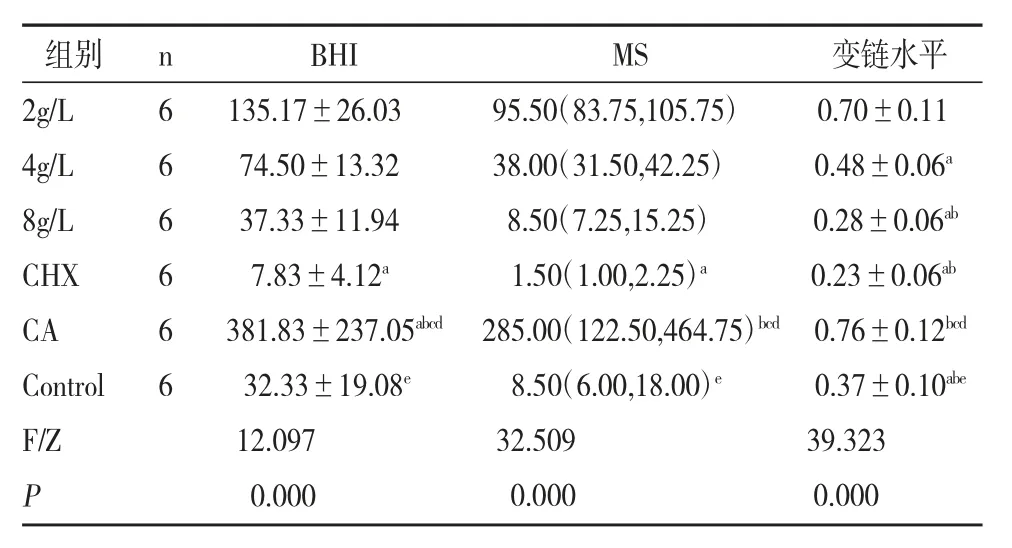
表1 6组间菌落计数结果
2.Keyes记分:如图1,在龋病模型中,牙齿逐渐发展为龋损(被紫脲酸胺染成红色),CA组光滑面及窝沟明显有更广泛的颜色改变。如表2,各药物干预组与CA组相比,光滑面及窝沟的各级龋损评分均有所降低;8g/L组未检出Dm级龋损,CHX组未检出Dm级及Dx级龋损,这两组的光滑面龋评分、窝沟龋E级、Ds级、Dm级及Dx级评分与CA组均有显著统计学差异(P<0.05);4g/L苦参提取物组未检出Dx级龋损,其窝沟龋Dx级龋损与CA组有明显统计学差异(P<0.05)。

表2 6组间Keyes评分结果

图1 龋齿Keyes评分及CLSM结果
3.体重、口腔黏膜HE染色及脏器系数:经过4周的实验,各组大鼠体重均呈上升趋势,Control组各时间点体重增幅最大。初始及第一周时,各组间差异无统计学意义,第二周开始至处死前均为Control组体重显著高于其余组别。其余组间差异均无统计学意义(P>0.05)。如图2。表4见6组间脏器系数比较时,肝脏系数差异有统计学意义(P<0.05),Control组显著低于其余组别。心脏、肺脏、肾脏、脾脏指数各组间差异均无统计学意义(P>0.05),见图3。如图4,各药物干预组口腔黏膜组织结构完整,细胞排列整齐,未见增生性改变、炎症反应和坏死等不良反应,与Control组无明显差异。
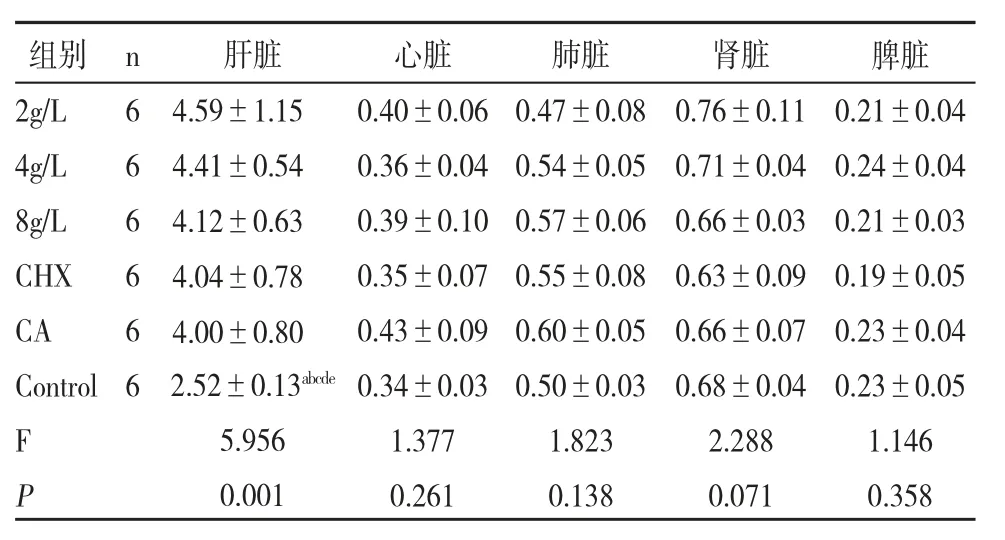
表4 6组间脏器系数比较
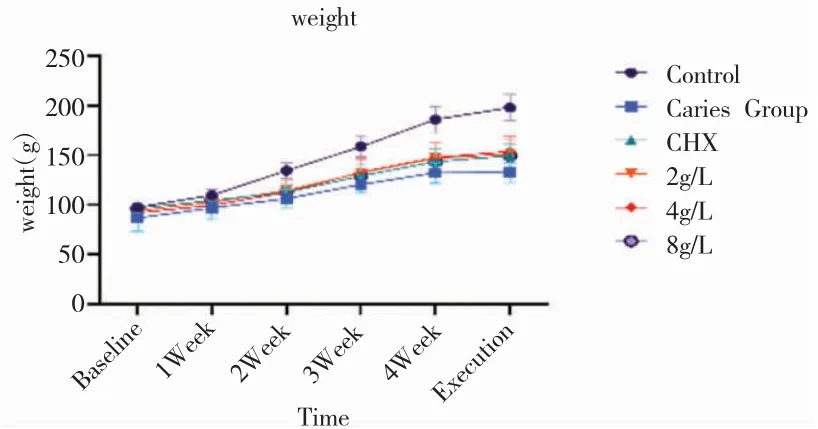
图2 各组大鼠的体重变化
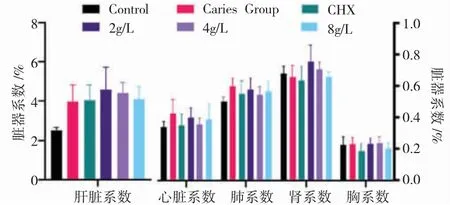
图3 各组大鼠的脏器系数结果

图4 各组大鼠的口腔粘膜HE染色结果
4.牙磨片CLSM:如图1,CA组牙釉质连续性明显中断,牙磨片渗入的红色荧光强度与其余组相比较强;2g/L及4g/L苦参提取物组可见部分牙釉质裂纹,荧光强度较CA组有减弱,但并不明显;8g/L及CHX组牙釉质较连续,未见明显釉质裂纹,荧光强度较CA组明显降低。
讨 论
洗必泰是一种具有广泛抗菌活性的阳离子双肌类药物,对G+、G-和真菌都有杀菌作用,且抗菌效能高,临床常用其0.12%~2%溶液作为口腔疾病的预防和辅助治疗,常用作其他抗菌药物评价的阳性对照和金标准。故本实验选用0.12%洗必泰作为阳性对照组。然而长期洗必泰使用会导致味觉迟钝,口腔粘膜脱屑,牙齿、舌背着色和长期应用口腔菌群失调等。近年来,中草药防龋受到越来越多的关注和认可,众多学者已研究没食子[9,10]、青皮[11]、紫草素[12]等天然植物,充分证实了天然药物的防龋功效。
致龋菌对牙面的粘附是其致龋的前提,进而代谢食物中的碳水化合物,产生各种有机酸导致牙体硬组织脱矿,引起龋病的发生。在龋病的发展过程中,致龋菌合成胞内外多糖的能力和耐酸特性发挥着重要作用,胞内、外多糖可贮存能量供细菌利用,胞外多糖还有促进牙菌斑生物膜形成的作用[13]。因此,防龋的有效性通常体现在其对致龋菌及其生物膜生长、产酸、产糖及黏附的抑制方面。团队前期研究发现[7],S.mutans在苦参提取物浓度为2g/L、4g/L和8g/L时,在对浮游菌产酸产生显著抑制作用;1g/L苦参能够显著抑制浮游菌合成水不溶性胞外多糖。牙菌斑生物膜是导致龋病发生的始动因子,因此在药物防龋方面,抑制S.mutans生物膜的形成和清除成熟生物膜具有重要意义[14]。然而本实验的旨在调节口腔微生态环境,完全清除S.mutans生物膜可能导致菌群紊乱,因此未设置16g/L浓度组,由于体内实验与体外实验相比,药物作用环境更为复杂,干扰因素也相对较多,据前期体外实验,1g/L组仅对浮游菌合成IEPS的抑制方面与阴性对照组有统计学差异,而对浮游菌生长、产酸、黏附、生物膜的生长及清除方面未见显著效果,因此本实验设置2g/L、4g/L、8g/L苦参提取物组作为实验药物组。
本研究中,2g/L组与CA组的BHI、MS及S.mutans水平指标均显著高于其余组,见表1;2g/L及4g/L组光滑面龋、窝沟龋E级、Ds级、Dm级Keyes评分与CA组无统计学差异(P>0.05),但4g/L组Dx级评分与CA组有统计学差异(P<0.05)。8g/L组及CHX组各级龋损评分与CA组均有统计学差异(P<0.05),见表2。以上差异综合表明,2g/L苦参提取物抗龋效能欠佳;4g/L苦参提取物可阻止龋病向深层牙本质进展,但对釉质龋及牙本质浅层龋的防治作用有限;8g/L组可显著降低大鼠口内S.mutans水平,显著降低龋齿各级Keyes评分,防龋效能良好,对照CLSM结果可得出一致结论。此浓度相对于体外实验的有效浓度偏高,可能因体内环境为复杂的多菌种生物膜环境,对抗菌剂表现出更强的抗药性。
生物安全性方面,表3可见,初始、第一周时间点各组间体重差异均无统计学意义(P>0.05),第二周至处死前Control组体重均显著高于其余组别,其余组间差异均无统计学意义(P>0.05)。实验第一周进行适应性喂养、S.mutans的定植及检测等实验内容,第二周开始进行药物干预,即2~4周进行为期3周的实验药物干预,正是药物干预阶段,Control组与其余各组体重产生了差异。实验过程中也确发现,药物干预期间各实验组大鼠大便较溏稀,饲料相较于空白对照组吃完的较慢等情况,可能是由于实验中所用的苦参提取物、CHX及长期高糖饮食可能会增加肠胃负担,导致胃肠道功能紊乱,进而导致体重较Control组增加较慢。表4见,6组间脏器系数比较中,肝脏系数差异有统计学意义(P<0.05),且经LSD-t法两两比较,Control组显著低于其余组别。心脏、肺脏、肾脏、脾脏指数各组间差异均无统计学差异(P<0.05)。可能是实验中所用的苦参提取物、CHX及长期高糖饮食增加了肝脏的代谢负担,使肝脏代偿性的增大,导致肝脏系数略有增加。张明发[15]等人研究发现,大剂量使用苦参碱可能引起中毒症状,机体中毒时可引起肝脏、肾脏、肺脏和神经麻痹等症状,认为苦参碱可提高中枢神经的兴奋性递质谷氨酸水平,降低抑制性递质γ-氨基丁酸水平,并抑制胆碱酯酶活性从而造成胆碱能神经兴奋,这是苦参碱造成神经麻痹的原因。杨良月[16]对绵羊的毒理学试验表明,大剂量使用苦参碱可造成肺脏、肝脏、脑、肾脏和心脏损伤。但除去自身较难恢复的肺脏,苦参碱造成的肝脏和肾脏造成的损害均可逐渐恢复。苦参碱在应用中比较安全,但不可过量长期使用以,以免造成危害。

表3 6组间6个时间点体重变化情况
综上,8g/L的苦参提取物可有效防龋并有较好的生物安全性,但过量长期使用可能会引起其它系统危害。后期天然药物动物实验的安全性研究中,将对大鼠肠道粘膜及各脏器进行进一步研究。
本实验大鼠口内仅定植S.mutans,不能完全代表复杂的口腔微生物环境,多菌种生物膜的龋病研究对于进一步探索防龋制剂的作用势在必行,课题组后期将致力于此方面的研究。综上,8g/L苦参提取物可有效阻止龋病的发生和进展,并初步表明具有一定的生物安全性,有望成为防龋制剂进入临床。

