预测进展期胃癌病人新辅助化疗后pCR列线图模型的建立与评价
郑自文 周昊 刘波 刘皓 赵俊江 张坚

[摘要] 目的 分析并确定影响进展期胃癌病人新辅助化疗后病理完全缓解(pCR)的临床病理学特征,开发并验证新辅助化疗后pCR的列线图(Nomogram)预测模型。方法 回顾性分析在青岛大学附属医院接受新辅助化疗的175例进展期胃癌病人的临床病理学资料。利用单因素及多因素Logistic回归分析病人新辅助化疗后pCR的影响因素。根据多因素分析结果建立预测进展期胃癌病人新辅助化疗后pCR的Nomogram模型。利用一致性指数(C-index)、校正曲线及决策曲线分析对Nomogram预测模型的性能进行评价。结果 术后病理显示,11.4%的胃癌病人达到pCR。多因素分析显示,癌胚抗原(CEA)、cN分期、肿瘤分化程度和肿瘤最长径为pCR的独立影响因素。所建立Nomogram预测模型的C-index为0.821,校正曲线及决策曲线显示该模型具有较好的临床净获益。结论 cN分期、CEA、肿瘤分化程度和肿瘤最长径为pCR的影响因素,依此建立的预测进展期胃癌病人新辅助化疗后pCR的Nomogram模型,具有较好的预测能力,能够为临床个体化精准治疗提供决策依据。
[关键词] 胃肿瘤;化学疗法,辅助;病理完全缓解;列线图
[中图分类号] R735.2;R195.1
[文献标志码] A
[文章编号] 2096-5532(2022)01-0095-05
doi:10.11712/jms.2096-5532.2022.58.032
胃癌是世界上第四常见的恶性肿瘤,也是癌症相关死亡的常见原因之一[1]。随着胃癌治疗理念和技术的不断发展,人们发现单纯手术治疗效果并不理想[2],胃癌的综合治疗已成为当下的共识。已有临床研究表明,术前辅以新辅助化疗的综合治疗手段可以达到降低肿瘤分期、减少肿瘤负荷的效果,可以消灭肿瘤微转移使肿瘤根治度提高并且降低肿瘤复发的风险[3]。有研究结果显示,大约有10%的接受新辅助化疗的胃癌病人能够达到病理完全缓解(pCR)[4]。pCR则意味着切除标本中不存在残留的肿瘤细胞。新辅助化疗的生存获益与肿瘤的病理反应相关,pCR病人的预后明显好于化疗后依然有大量肿瘤细胞残留的病人[5]。那些对新辅助化疗药物不敏感的病人并不能从新辅助化疗中获益,反而会在新辅助化疗过程中受到药物毒性的影响,最佳的手术时机也可能因此而被推迟[5]。故确定影响新辅助化疗效果的因素,并且据此筛选出对新辅助化疗敏感的病人,从而制定更为精准的个体化胃癌治疗方案,具有很高的临床价值。国外的一些学者对新辅助化疗病理反应的预测因素进行过研究,但是存在样本量过小以及临床实践中不可用等局限性[6]。本研究旨在分析并确定影响进展期胃癌病人新辅助化疗后pCR的临床病理学特征,开发并验证新辅助化疗后pCR的列线图(Nomogram)预测模型,以期为新辅助化疗的临床决策提供一个方便可用的精准化工具。现将结果报告如下。
1 资料和方法
1.1 病例选择
2010年1月—2019年12月,根据纳入和排除标准,选取在青岛大学附属医院胃肠外科接受新辅助化疗的进展期胃癌病人175例作为研究对象。纳入标准:①胃或者胃食管腺癌(胃食管肿瘤定义为发生在贲门或胃食管结合部的肿瘤,不涉及食管下段2 cm以上,即Siewert Ⅱ型和Ⅲ型);②经腹部-盆腔计算机断层扫描评估临床病理分期为cT3-4N0/+的病人;③实验室检查、影像学及病理学资料完整。排除标准:接受了术前放疗、靶向治疗或免疫治疗的病人。本研究经青岛大学附属医院伦理审查委员会批准(QYFYWZLL25667),所有入选的病人均已知情并且同意。
1.2 资料收集
收集所有入选胃癌病人的临床病理学资料,包括年龄、性别、饮酒史、吸烟史、体质量指数(BMI)、查尔森共病指数(CCI)、肿瘤最长径、肿瘤位置、活检病理分化分级、肿瘤分期、常规血液学和生化检测结果、肿瘤标志物、新辅助化疗方案以及治疗后反应等。按照第8版美国癌症联合委员会(AJCC)胃癌TNM分期对病人进行化疗前临床病理分期。依据CT检查确定化疗前临床T分期和临床N分期。依据超声内镜(EUS)检查确定肿瘤最长径。
1.3 统计学方法
采用SPSS 24.0软件进行统计学处理。先利用单因素Logistic回归分析筛选病人新辅助化疗后pCR的影响因素,再将单因素分析中P<0.05的因素纳入到多因素Logistic回归分析确定独立影響因素。根据多因素分析的结果,使用R语言软件及相关软件包进行Nomogram模型的绘制。利用一致性指数(C-index)、校正曲线及决策曲线分析等验证Nomogram模型的性能,并对其进行校正。设定双侧检验的显著性水平为P<0.05。
2 结 果
2.1 病人的基线特征
本文175例病人,男性136例(77.7%),女性39例(22.3%);年龄为(57.4±12.5)岁;体质量指数(BMI)为(24.4±3.6)kg/m2;有饮酒史者100例(57.1%),吸烟史者93例(54.1%);CCI≤2者98例(56.0%),CCI>2者77例(44.0%)。肿瘤位于胃上部者27例(15.4%),胃中部者66例(37.7%),胃下部者82例(46.9%);肿瘤组织为中高分化者55例(31.4%),低分化者120例(78.6%);肿瘤最长径(4.5±2.8)cm;cT分期cT3期70例(40.0%),cT4期105例(60.0%);cN分期cN0期45例(25.7%),cN+期130例(74.3%)。114例(65.2%)病人接受SOX方案(奥沙利铂+替吉奥)2~4周期化疗后进行手术,61例(34.8%)病人在接受XELOX方案(奥沙利铂+卡培他滨)2~4周期化疗后进行手术。中性粒细胞(3.8±1.4)×109/L,淋巴细胞(1.8±0.6)×109/L,中性粒细胞与淋巴细胞比值(NLR)为2.4±1.1,血小板与淋巴细胞比值(PLR)为179.2±89.7,清蛋白(38.5±4.3)g/L;CA125≤35 kU/L者160例(91.4%),>35 kU/L者15例(8.6%);癌胚抗原(CEA)≤5 μg/L病人72例(41.1%),>5 μg/L者103例(58.9%);CA199≤37 kU/L病人122例(69.8%),>37 kU/L者53例(30.2%)。根据术后病理学评估,有20例(11.4%)病人的原发肿瘤部位不存在残留的肿瘤细胞,达到pCR。
2.2 病人新辅助化疗后pCR相关因素分析
单因素Logistic回归分析显示,cT分期、cN分期、肿瘤最长径、CEA和肿瘤分化程度均与病人新辅助化疗后pCR显著相关,而pCR病人与非pCR病人性别、年龄、BMI、吸烟、饮酒、CCI、肿瘤位置、CA199、CA125、清蛋白、中性粒细胞、淋巴细胞、NLR、PLR比较差异均无显著性(P>0.05)。见表1。将单因素分析中与病人新辅助化疗后pCR相关的影响因素纳入多因素Logistic回归分析,结果显示,除cT分期外,cN分期、肿瘤最长径、CEA和肿瘤分化程度均为病人新辅助化疗后pCR的独立影响因素。肿瘤cN分期较早、肿瘤长度较小、CEA水平低和肿瘤分化较好的病人对术前新辅助化疗的反应更好,更容易获得pCR。见表2。
2.3 Nomogram模型的建立及评价
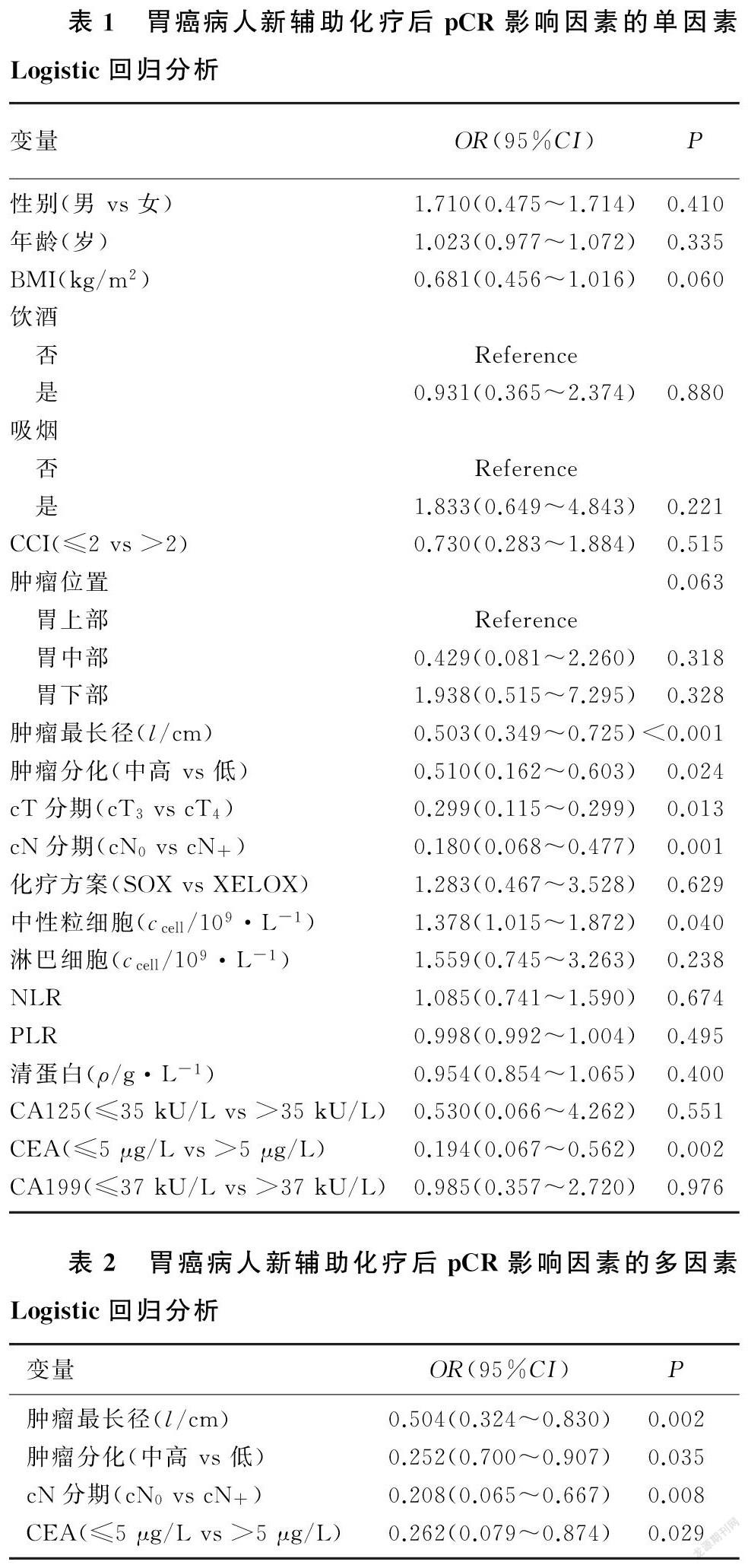
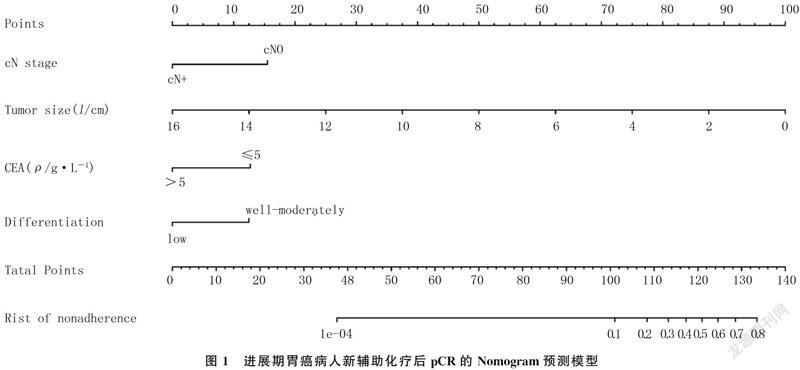
根据多因素Logistic回归分析中显示的独立影响因素,应用R语言软件建立了新辅助化疗后pCR的Nomogram预测模型(图1)。通过图中每个变量对应的点向“Points”轴的投射可以获得相应的分数,将对应的分数相加,所得到的总分数可对应相应的预测结果。受试者工作特征(ROC)曲线分析显示,Nomogram模型预测的C-index为0.821(图2),较AJCC TNM系统的C-index(0.656)高。校准曲线分析显示,本文Nomogram模型有较高的统计学性能,能够较好地预测新辅助化疗后的pCR(图3A)。决策曲线则体现了该模型具有较好的临床实用性(图3B)。因此,本研究建立的Nomogram预测模型在临床实践中能够根据病人的临床病理学特征评估个体新辅助化疗后pCR的发生概率,对于病人咨询和决策非常重要,可帮助临床医生制定后续治疗计划。
3 讨 论
胃癌的综合治疗已成为当下的共识,新辅助化疗因依从性好、消灭微转移、降低肿瘤分期和提高手术切除率等优点而被各大指南所推荐[7-9]。但基于不同的临床研究结果,东西方对于新辅助化疗适应证人群的选择存在很大差異。有研究表明,对于进展期胃癌病人,新辅助化疗能显著提高生存率[10-11]。然而,大约只有10%的病人能够达到pCR[12-13]。也有研究结果显示,36%的胃癌病人在接受术前新辅助化疗期间并没有得到病理缓解反而肿瘤出现了缓慢的进展[14]。病理缓解反映了体内肿瘤对术前新辅助化疗的敏感性,是评价新辅助化疗疗效的一个重要指标[14-15]。达到pCR的病人预后可以得到显著改善[12]。对于术前对新辅助化疗不敏感的病人来说,不仅没有获益反而暴露于新辅助化疗药物的毒性中,甚至由于肿瘤的进展而错过了最佳的手术时机[14,16]。因此,以体内肿瘤细胞对新辅助化疗的敏感性为依据来制定更精准的个体化方案,能够使病人得到最大获益。
本研究建立的Nomogram预测模型纳入的影响因素包括cN分期、肿瘤长度、CEA和肿瘤分化程度。其中肿瘤分化程度与新辅助化疗pCR率的关系在胃癌的相关研究中被多次证明,新辅助化疗前肿瘤分化程度越高,则越有可能获得完全缓解[17],本研究结果进一步验证了此观点。以往的多项研究结果显示,肿瘤长度是新辅助化疗pCR的预测因素[18-19],本研究结果与之一致。本研究显示,cN分期也是影响pCR的一个重要因素。其机制可能为cN分期与肿瘤负荷和侵袭性相关[20]。那些cN分期相对较晚的病人达到pCR的概率较低,提示cN分期较早、肿瘤负荷较小的病人对新辅助化疗的敏感性更高。cN分期较晚的病人进行新辅助化疗要承担更大的风险,在临床决策中,这类病人适时地进行手术+术后化疗或许能够避免因对新辅助化疗不敏感而导致的肿瘤进展和延误手术风险。本研究结果显示,低CEA水平的病人更易达到pCR。CEA水平的升高被认为与较重的肿瘤负荷和较快的肿瘤生长速度有关,同时也导致化疗的敏感性差[21]。以上研究结果表明,cN分期相对较早、CEA水平低、肿瘤长度小的低肿瘤负荷的胃癌病人可能更适于接受术前新辅助化疗,而肿瘤负荷总体较大的晚期可切除胃癌病人选择新辅助化疗策略时需要慎重。
本研究的优点如下:以中国人群临床数据建立的Nomogram预测模型更加适用于中国人群的临床应用;先前的一些研究多是从单一因素单一维度出发讨论胃癌新辅助化疗pCR的影响因素,而本研究综合了多个临床指标,依据每个参数的权重和重要性构建了Nomogram预测模型;cN分期、肿瘤长度、CEA和肿瘤分化程度都是临床易于获取的实用性指标,这也保证了本研究构建的Nomogram模型的实用性。本研究存在的局限性:样本数量少,不足以分为训练集和验证集,以训练集来评价预测的效果;为单中心研究,还需要基于其他中心人群的外部验证;为回顾性研究,不能避免一些未知因素存在导致的偏倚。
综上所述,cN分期、CEA水平、肿瘤分化程度和肿瘤长度为进展期胃癌病人新辅助化疗后pCR的影响因素,依此建立的预测新辅助化疗后pCR的Nomogram模型,具有一定的预测能力,能够为临床个体化精准治疗提供决策依据。
[参考文献]
[1]SITARZ R, SKIERUCHA M, MIELKO J, et al. Gastric cancer: epidemiology, prevention, classification, and treatment[J]. Cancer Management and Research, 2018,10:239-248.
[2]YOKOYAMA H, NAKANISHI H, KODERA Y, et al. Biological significance of isolated tumor cells and micrometastasis in lymph nodes evaluated using a green fluorescent protein-tagged human gastric cancer cell line[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2006,12(2):361-368.
[3]YCHOU M, BOIGE V, PIGNON J P, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase Ⅲ trial[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2011,29(13):1715-1721.
[4]GASTRIC (Global Advanced/Adjuvant Stomach Tumor Research International Collaboration) Group, PAOLETTI X, OBA K, et al. Benefit of adjuvant chemotherapy for resectable gastric cancer[J]. JAMA, 2010,303(17):1729-1737.
[5]ACHILLI P, DE MARTINI P, CERESOLI M, et al. Tumor response evaluation after neoadjuvant chemotherapy in locally advanced gastric adenocarcinoma: a prospective, multi-center cohort study[J]. Journal of Gastrointestinal Oncology, 2017,8(6):1018-1025.
[6]HOFHEINZ R D, WENZ F, POST S, et al. Chemoradiothe-rapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial[J]. The Lancet Oncology, 2012,13(6):579-588.
[7]Association JGC. Japanese gastric cancer treatment guidelines 2018 (5th edition)[J]. Gastric Cancer, 2021,24(1):1-21.
[8]SMYTH E C, VERHEIJ M, ALLUM W, et al. Gastric can-cer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Annals of Oncology, 2016,27(Suppl 5):v38-v49.
[9]DETTERBECK F, TANOUE L, REID A. National comprehensive cancer network[J]. Journal of the National Comprehensive Cancer Network: JNCCN, 2013,11(4):365-366.
[10]CUNNINGHAM D, ALLUM W H, STENNING S P, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. The New England Journal of Medicine, 2006,355(1):11-20.
[11]OKI E, EMI Y, KUSUMOTO T, et al. Phase Ⅱ study of docetaxel and S-1 (DS) as neoadjuvant chemotherapy for clinical stage Ⅲ resectable gastric cancer[J]. Annals of Surgical Oncology, 2014,21(7):2340-2346.
[12]FIELDS R C, STRONG V E, GNEN M, et al. Recurrence and survival after pathologic complete response to preoperative therapy followed by surgery for gastric or gastrooesophageal adenocarcinoma[J]. British Journal of Cancer, 2011,104(12):1840-1847.
[13]LORENZEN S, HENTRICH M, HABERL C, et al. Split-dose docetaxel, cisplatin and leucovorin/fluorouracil as first-line therapy in advanced gastric cancer and adenocarcinoma of the gastroesophageal junction: results of a phase Ⅱ trial[J]. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 2007,18(10):1673-1679.
[14]SONGUN I, KEIZER H J, HERMANS J, et al. Chemotherapy for operable gastric cancer: results of the Dutch randomised FAMTX trial. The Dutch Gastric Cancer Group (DGCG)[J]. European Journal of Cancer (Oxford, England: 1990), 1999,35(4):558-562.
[15]SCHMIDT T, SICIC L, BLANK S, et al. Prognostic value of histopathological regression in 850 neoadjuvantly treated oesophagogastric adenocarcinomas[J]. British Journal of Cancer, 2014,110(7):1712-1720.
[16]REDDAVID R, SOFIA S, CHIARO P, et al. Neoadjuvant chemotherapy for gastric cancer. Is it a must or a fake[J]? World Journal of Gastroenterology, 2018,24(2):274-289.
[17]WU Z F, CAO Q H, WU X Y, et al. Regional Arterial Infusion Chemotherapy improves the Pathological Response rate for advanced gastric cancer with Short-term Neoadjuvant Chemotherapy[J]. Scientific Reports, 2015,5:17516.
[18]韋华军,钟亮,曾湖,等. 新辅助化疗治疗进展期胃癌的临床疗效及影响因素[J]. 中国肿瘤临床与康复, 2014,21(7):834-836.
[19]杨娟,燕速. 影响进展期胃癌新辅助化疗患者临床疗效的危险因素[J]. 实用癌症杂志, 2017,32(5):770-772.
[20]MACGUILL M, MULLIGAN E, RAVI N, et al. Clinicopathologic factors predicting complete pathological response to neoadjuvant chemoradiotherapy in esophageal cancer[J]. Diseases of the Esophagus: Official Journal of the International Society for Diseases of the Esophagus, 2006,19(4):273-276.
[21]ZHOU C, ZHONG X, SONG Y X, et al. Prognostic biomar-kers for gastric cancer: an umbrella review of the evidence[J]. Frontiers in Oncology, 2019,9:1321.
(本文编辑 马伟平)
3979500338217

