新型静电纺丝纳米支架敷料对大鼠皮肤创伤的作用
苏鲁安 冷向锋 何才 周子艺 刘永娟 陈振雨


[摘要] 目的 观察新型静电纺丝纳米支架敷料对皮肤创面的修复作用。方法 应用静电纺丝技术制备壳聚糖(CS)/聚己内酯(PCL)纳米支架敷料。选取健康大鼠,制备皮肤损伤创面,分为实验组(应用新型静电纺丝纳米支架敷料)及对照组(应用凡士林油纱)。观察两组创面在术后第3、5、7、10、14天的愈合形态并计算愈合率,于术后第7、14天分别取创面组织进行组织学观察。结果 术后第3、5、7、10、14天,应用新型静电纺丝纳米支架敷料的实验组创面愈合率均显著高于对照组,差异具有统计学意义(F=222.42~463.42,P<0.05)。组织学观察显示,与对照组比较,实验组毛细血管增生更明显,肉芽组织排列更致密。结论 新型静电纺丝纳米支架敷料具有促进皮肤创面愈合的作用。
[关键词] 支架;封闭敷料;壳聚糖;羧甲基纤维素钠;皮肤;创伤和损伤;大鼠
[中图分类号] R618
[文献标志码] A
[文章编号] 2096-5532(2022)01-0063-05
doi:10.11712/jms.2096-5532.2022.58.025
在皮肤创伤治疗中,优良的创面敷料可显著降低感染率、致残率和致死率。传统敷料如纱布、绷带等存在很多缺陷,如保湿及抗感染作用差,创面易与敷料粘连导致换药时疼痛并损伤新生组织等[1-2]。随着近些年医学技术的发展,各种新型创面敷料得到了越来越多的研究及应用[3]。静电纺丝技术是一种制备纳米纤维的技术方法[4],相较传统纺丝方法工艺简单、成本低[5],该法制备的纳米纤维具有独特的尺寸优势,可以模拟生物细胞外基质(ECM)的结构和功能[6],促进细胞增殖,加速伤口愈合,在医用敷料领域表现出极大的潜力[7]。但目前基于静电纺丝技术的纳米纤维作为伤口敷料临床应用较少,关于其性能参数及评价方法无统一指标且尚不完善,因此如何将其真正应用于临床治疗仍然需要研究者的继续努力。本研究应用静电纺丝技术,结合壳聚糖(CS)和聚己内酯(PCL)材料的优点,制备一种新型创面敷料,并通过动物实验探讨其在创面愈合方面的作用,为该敷料的进一步临床应用提供参考。
1 材料与方法
1.1 新型静电纺丝纳米支架敷料的制备
基于前期在静电纺丝过程中积累的经验,为了保持电纺丝液的可纺丝性,将PCL和CS按照质量比12∶2加入到质量比为1∶1的N,N-二甲基甲酰胺/氯仿溶剂中,配制成质量分数为0.12的纺丝溶液。将混合后的溶液加入10 mL注射器内,连接电纺喷头(17G)。设定静电纺丝装置初始参数如下:接收距离为15 cm,电压为18 kV,电纺液推进流量5.0 mL/h,收集滚筒转速为1 000 r/min。在接受滚筒上包裹铝箔,电纺丝时间6 h,收集到的纤维膜真空干燥24 h后备用。
1.2 模型制备
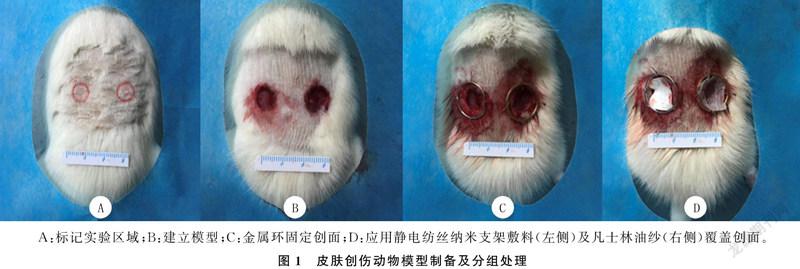
所用实验动物为健康SD大鼠10只,体质量为200~250 g,雌雄不限,购自济南朋悦实验动物繁育有限公司。根据大鼠体质量,以30 mg/kg剂量腹腔注射100 g/L水合氯醛麻醉大鼠。参考实验常用皮肤缺损创伤动物模型[8-9],以大鼠脊柱为中心线对称标记两处直径为1 cm的圆形区域(图1A),剥离该区域内全层皮肤至筋膜层(图1B),制备全层皮肤损伤模型。设定左侧创面为实验组,右侧创面为对照组,并加以标记。用金属环法固定创面(图1C)。将静电纺丝纳米支架敷料裁剪为创面大小,平整覆盖于实验组创面;选取同等大小凡士林油纱,平整覆盖于对照组创面(图1D)。
1.3 观察指标
记录原始创面面积,分别于术后第3、5、7、10、14天观察两组创面形态、愈合程度,计算创面面积及创面愈合率。创面愈合率=(原始创面面积-各时间点创面面积)/原始创面面积×100%。于术后第7、14天分别随机选1只大鼠,取创面组织活检,标本用甲醛固定液固定、石蜡包埋后进行苏木精-伊红(HE)染色。
1.4 统计学处理
使用SPSS 21.0软件进行统计学处理。计量资料数据以[AKx-D]±s表示,两组间不同时间创面面积和愈合率的比较采用重复测量设计的方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组创面形态、面积及愈合率的變化
与创面原始形态(图2A)相比,术后第3天,实验组创面面积明显缩小,肉芽组织较对照组增生明显,创面渗出少于对照组(图2B)。术后第5天,实验组创面肉芽组织继续增生,渗出物减少,局部可见痂皮形成,而对照组仍为肉芽创面(图2C)。术后第7天,实验组创面痂皮边缘脱落,新生皮肤组织进一步向创面中心生长,静电纺丝纳米支架敷料与创面粘连较轻;对照组创面渗出多,凡士林油纱与创面粘连,肉芽组织生长缓慢,痂皮延迟形成(图2D)。术后第10天,实验组创面面积进一步缩小,仅有少量渗出;对照组创面面积变化较小,部分可见结痂(图2E)。至术后第14天,实验组创面接近愈合,外观与正常皮肤组织接近;对照组创面部分愈合,残存创面可见结痂,个别实验对象创面有少量渗出以及异味(图2F)。
创面面积重复测量设计的方差分析结果显示,两组不同时间点创面面积比较,差异均有统计学意义(F=3 103.51、2 277.10,P<0.001);实验组术后第3、5、7、10、14天的创面面积均小于对照组,差异具有统计学意义(F=147.92~402.10,P<0.001)。见表1。
创面愈合率重复测量设计的方差分析结果显示,两组不同时间点的创面愈合率比较,差异均具有统计学意义(F=729.31、385.58,P<0.001);实验组术后各时间点的创面愈合率均高于对照组,差异均具有统计学意义(F=222.42~463.42,P<0.001)。见表2。
2.2 两组创面组织学观察
术后第7天,实验组创面可见肉芽组织增生,新生血管开始形成,炎症反应较轻,恢复状态良好(图3A);对照组创面可见水肿及渗出显著,肉芽组织排列紊乱,大量急慢性炎性细胞浸润,毛细血管排列不规则(图3B)。术后第14天,实验组创面肉芽组织更为致密,大量毛细血管及胶原纤维增生,可见新生上皮,总体形态接近正常组织(图3C);对照组创面仍可见大量肉芽组织形成,提示组织处于修复状态(图3D)。
3 讨 论
创面敷料在创面修复中发挥着重要作用[10],理想的创面敷料应具有以下特点[11-13]:①良好的功能性,能促进皮肤组织生成,加速创面愈合;②良好的封闭性,使创面与外界环境隔绝,既能减少水分及蛋白质、电解质的流失,又能阻止细菌等微生物侵入,降低感染风险;③良好的通透性,有利于创面分泌物的排出及气体交换;④良好的组织相容性,无明显的排异反应。
本研究选用CS和PCL作为静电纺丝纳米纤维的原料。CS多存在于节肢动物的外骨骼或真菌的细胞壁中[14],能促进细胞增殖,具有良好的生物相容性、生物降解性以及抗菌、止血和黏膜黏附性能,还可抑制瘢痕成纤维细胞的增殖,防止瘢痕组织形成,在生物医学、食品、医药领域有着广泛应用[15-21]。PCL是一种由生物可降解聚合物构成的晶体材料,由于其特殊的碳链结构,PCL具有良好的组织相容性、柔韧性、加工性及力学性能,可以调节静电纺丝纳米敷料的机械强度[22-24]。因此,CS和PCL共混不仅保留了材料本身的优点,还可互补两种材料的不足[25],使纳米纤维的机械强度和性能更符合创面敷料的性能要求。
本实验结果显示,应用静电纺丝纳米支架敷料的实验组创面愈合过程中肉芽组织新鲜红润,痂皮形成更早,在各时间点的愈合率均高于对照组,愈合后形态更接近于正常皮肤。本研究组织学观察显示,实验组创面水肿更轻,新生血管的形成也更多,肉芽组织更为致密,提示静电纺丝纳米支架敷料可促进创面愈合。其机制可归纳为以下几点。①静电纺丝纳米纤维空间形态与ECM极为接近[26],而ECM作为皮肤细胞生存的微环境,具有支持、连结、营养细胞的作用,可参与细胞的增殖、分化及迁移等环节,调节生长因子的释放,影响血管生成及炎性反应,参与皮肤创伤中肉芽组织的形成,促进表皮细胞迁移,最终使创面完成再上皮化[27-28]。静电纺丝纳米支架敷料通过模拟ECM的功能发挥作用,为细胞黏附增殖提供了条件[29]。②静电纺丝纳米支架敷料可为创面提供湿润的微环境[30],而相对湿润的环境可以促进创面释放并激活多种酶类,有利于清除皮肤创面的结痂及坏死组织,促进创面释放生长因子,加速表皮细胞迁移,促进创面愈合[31-32]。③静电纺丝纳米敷料具有很高的孔隙率[33],利于创面透气,可促进细胞的呼吸作用。有研究结果表明,创面的愈合过程需要适当的氧气参与,在低氧状态下,血管生成、细胞增殖及各类细胞因子和生长因子的释放受阻,创面将延迟愈合[34]。故静电纺丝纳米支架敷料具有良好的功能性、封闭性和通透性,是一种理想的创面敷料。
综上所述,静电纺丝纳米支架敷料可以显著促进创面愈合,降低创面渗出及感染的风险,减少敷料与创面的粘连,且无明显毒副作用,具有广阔的发展空间,为创面敷料的研究提供了新方向。
[参考文献]
[1]杜天乐,刘东林,景春晖,等. 创伤敷料对促进创面愈合的研究进展[J]. 医学综述, 2015,21(6):969-971.
[2]MAYET N, CHOONARA Y E, KUMAR P, et al. A comprehensive review of advanced biopolymeric wound healing systems[J]. Journal of Pharmaceutical Sciences, 2014,103(8):2211-2230.
[3]WANG F D, HU S, JIA Q X, et al. Advances in electrospinning of natural biomaterials for wound dressing[J]. Journal of Nanomaterials, 2020,2020:1-14.
[4]YUAN T T, DIGEORGE FOUSHEE A M, JOHNSON M C, et al. Development of electrospun chitosan-polyethylene oxide/fibrinogen biocomposite for potential wound healing applications[J]. Nanoscale Research Letters, 2018,13(1):88.
[5]BRUGGEMAN K F, WILLIAMS R J, NISBET D R. Dyna-mic and responsive growth factor delivery from electrospun and hydrogel tissue engineering materials[J]. Advanced Healthcare Materials, 2018,7(1):1700836. doi:10.1002/adhm.201700836.
[6]VARGAS E A T, DO VALE BARACHO N C, DE BRITO J, et al. Hyperbranched polyglycerol electrospun nanofibers for wound dressing applications[J]. Acta Biomaterialia, 2010,6(3):1069-1078.
[7]李智璐,賀爱华. 静电纺丝法制备聚合物功能纤维的研究进展[J]. 合成纤维, 2015,44(2):28-33.
[8]晋培红,张如鸿. 皮肤缺损创伤动物模型的制备[J]. 组织工程与重建外科杂志, 2006,2(6):354-356.
[9]付小兵,孙同柱,盛志勇. 几种用于创伤修复研究的动物模型[J]. 中华实验外科杂志, 1999,16(5):479.
[10]张天蔚,刘方,田卫群. 促皮肤创面愈合新型敷料研究现状与进展[J]. 生物医学工程学杂志, 2019,36(6):1055-1059,1068.
[11]GEORGESCU M, CHIFIRIUC M, MARUTESCU L, et al. Bioactive wound dressings for the management of chronic wounds[J]. Current Organic Chemistry, 2016,21(1):53-63.
[12]首家保,陈彬,芦慎,等. 不同敷料修复创面的实验研究及临床应用评价[J]. 中国组织工程研究, 2012,16(8):1479-1482.
[13]赵琳,宋建星. 创面敷料的研究现状与进展[J]. 中国组织工程研究与临床康复, 2007,11(9):1724-1726,1737.
[14]YOUNES I, RINAUDO M. Chitin and chitosan preparation from marine sources: structure, properties and applications[J]. Marine Drugs, 2015,13(3):1133-1174.
[15]D’AYALA G G, MALINCONICO M, LAURIENZO P. Marine derived polysaccharides for biomedical applications: che-mical modification approaches[J]. Molecules (Basel, Switzerland), 2008,13(9):2069-2106.
[16]薛明,周大利,曹巨辉,等. 壳聚糖/磷灰石-硅灰石复合多孔支架材料的制备与性能[J]. 复合材料学报, 2009,26(3):127-132.
[17]莫名月,李国明,方雷. 壳聚糖载药微囊的制备及应用研究进展[J]. 天津化工, 2005,19(6):1-4.
[18]JAYAKUMAR R, PRABAHARAN M, SUDHEESH KUMAR P T, et al. Biomaterials based on chitin and chitosan in wound dressing applications[J]. Biotechnology Advances, 2011,29(3):322-337.
[19]陈燕培,夏栋林,王雨飞,等. 创面复合液体敷料在皮肤创伤中的治疗研究[J]. 中国生物医学工程学报, 2016,35(4):453-459.
[20]陈煜,窦桂芳,罗运军,等. 甲壳素和壳聚糖在伤口敷料中的应用[J]. 高分子通报, 2005(1):94-100.
[21]MOHANDAS A, DEEPTHI S, BISWAS R, et al. Chitosan based metallic nanocomposite scaffolds as antimicrobial wound dressings[J]. Bioactive Materials, 2018,3(3):267-277.
[22]黄琼瑜,佘厚德,肖秀峰,等. 羟基磷灰石/聚己内酯-壳聚糖复合材料的制备与表征[J]. 复合材料学报, 2009,26(1):24-30.
[23]仲留仪,柳臻,陈建秋,等. 静电纺丝用作难愈合伤口敷料的研究进展[J]. 药学进展, 2016,40(5):375-379.
[24]武小童,何儿,刘来俊,等. 基于聚己内酯纤维的组织工程支架研究进展[J]. 中国生物医学工程学报, 2020,39(5):611-620.
[25]杜媛,王卫东. 静电纺丝伤口敷料研究进展[J]. 西南国防医药, 2017,27(4):421-424.
[26]DONG Y P, ZHENG Y Q, ZHANG K Y, et al. Electrospun nanofibrous materials for wound healing[J]. Advanced Fiber Materials, 2020,2(4):212-227.
[27]PIRAN M, VAKILIAN S, PIRAN M, et al. In vitro fibroblast migration by sustained release of PDGF-BB loaded in chitosan nanoparticles incorporated in electrospun nanofibers for wound dressing applications[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2018,46(sup1):511-520.
[28]刘青武,何秀娟,张金超,等. 细胞外基质在皮肤组织创面修复中的研究进展[J]. 医学研究杂志, 2019,48(9):21-24.
[29]陈思原,孔梅梅,王淑芳,等. 静电纺丝新技术及其在生物医药领域的应用[J]. 中国生物医学工程学报, 2011,30(1):120-129.
[30]FIGUEIRA D R, MIGUEL S P, DE S K D, et al. Production and characterization of polycaprolactone-hyaluronic acid/chitosan-zein electrospun bilayer nanofibrous membrane for tissue regeneration[J]. International Journal of Biological Macromolecules, 2016,93:1100-1110.
[31]陈琳,宁宁,陈慧,等. 皮肤创伤湿性愈合治疗的临床效果观察[J]. 华西医学, 2015,30(10):1810-1813.
[32]陈晓洁,吕爱凤,高晶,等. 功能敷料的“伤口湿润环境愈合”理论与实践[J]. 生物医学工程学进展, 2013,34(1):31-34.
[33]CHEN S N, CUI S S, HU J L, et al. Pectinate nanofiber mat with high absorbency and antibacterial activity: a potential superior wound dressing to alginate and chitosan nanofiber mats[J]. Carbohydrate Polymers, 2017,174:591-600.
[34]RODRIGUEZ P G, FELIX F N, WOODLEY D T, et al. The role of oxygen in wound healing: a review of the literature[J]. Dermatologic Surgery, 2008,34(9):1159-1169.
(本文編辑 马伟平)
3145500338236

