可溶性尿酸对肠上皮细胞的影响及其机制
杨婉 吕秋兰 徐大星 刘秀 王鹏君 邢士超



[摘要] 目的 探讨可溶性尿酸(sUA)对肠上皮细胞的影响及其机制。方法 将大鼠肠上皮细胞(IEC-6细胞)随机分为对照组和实验组,对照组采用0 mg/L sUA刺激IEC-6细胞;实验组分别用25、50、100、200、400 mg/L浓度的sUA刺激IEC-6细胞,观察sUA对细胞活力的影响,并筛选出对IEC-6细胞毒性较小的sUA浓度。采用蛋白印迹法和实时荧光定量PCR,检测sUA刺激对IEC-6细胞蛋白激酶C(PKC)、肿瘤坏死因子α(TNFα)表达的影响;采用PKC抑制剂抑制PKC的表达,观察PKC降低对炎症因子表达的影响。采用活性氧检测试剂盒检测sUA对IEC-6细胞线粒体活性氧(ROS)的影响,线粒体膜电位试剂盒检测IEC-6细胞膜电位变化,免疫荧光方法检测IEC-6细胞紧密连接蛋白(ZO-1)表达。结果 25、50、100 mg/L浓度sUA刺激组细胞活力与对照组比较差异无统计学意义(P>0.05);200、400 mg/L浓度 sUA刺激组细胞活力受损较为显著,差异有统计学意义(F=20.519,P<0.05)。25、50、100 mg/L浓度sUA刺激组IEC-6细胞PKC、TNFα mRNA和蛋白表达高于对照组,差异有统计学意义(F=36.750~81.660,P<0.05)。PKC抑制剂组PKC、TNFα蛋白表达显著低于对照组,差异有统计学意义(t=16.646、22.572,P<0.05)。25、50、100 mg/L浓度sUA刺激组ROS较对照组增多(F=341.708,P<0.05)。50、100 mg/L浓度sUA刺激组线粒体膜电位较对照组明显降低,差异有统计学意义(F=400.952,P<0.05)。100 mg/L浓度sUA刺激组ZO-1蛋白表达较对照组降低,差异有统计学意义(t=50.508,P<0.05)。结论 sUA能激活由PKC介导的免疫应答,产生过量的ROS,释放炎症因子,引起肠上皮细胞炎症反应。
[关键词] 肠细胞;高尿酸血症;尿酸;紧密连接蛋白质类
[中图分类号] R392.6
[文献标志码] A
[文章编号] 2096-5532(2022)01-0013-06
doi:10.11712/jms.2096-5532.2022.58.010
尿酸是核酸及嘌呤类化合物的最终代谢产物。除肾脏外,约有1/3尿酸经肠上皮细胞转运至肠腔内代谢[1]。肠上皮细胞功能紊乱是引发代谢病的风险因素,目前尿酸对肠上皮细胞的影响尚不清楚。肠上皮细胞在保护肠道屏障,调节黏膜免疫系统等方面具有重要的作用[2]。肠屏障功能受损后,肠道通透性增加,易引发一系列的炎症[3-5]。蛋白激酶C(PKC)是一种丝氨酸/苏氨酸蛋白激酶,是控制细胞分化、增殖等过程的重要调节因子[6]。本研究采用大鼠肠上皮细胞(IEC-6细胞)模型探讨可溶性尿酸(sUA)能否激活诱导炎症反应、引起肠上皮细胞损伤,为高尿酸血症及其并发症的预防和治疗提供新的方向。现将结果报告如下。
1 材料与方法
1.1 实验材料
IEC-6细胞(CRL-1592)购自ATCC美国模式培养物集存库;DMEM培养基、胎牛血清、PBS缓冲液、胰蛋白酶、Trizol、三氯甲烷均购于碧云天公司;二甲基吡啶(MTS)细胞增殖试剂盒、二氯荧光黄双乙酸盐(DCFH-DA)活性氧检测试剂盒、JC-1线粒体膜电位检测试剂盒、细胞核染料DAPI均购于索莱宝公司;引物、Taq DNA聚合酶购于上海生物工程公司;紧密连接蛋白(ZO-1)抗体购于美国CST公司;PKC抗体、肿瘤坏死因子α(TNFα)抗体、β-actin抗体、羊抗兔IgG抗体购于美国Abcam公司;PKC抑制剂(Sotrastaurin)购于APE×BIO公司。
1.2 实验方法
1.2.1 IEC-6细胞培养 配制含有体积分数0.10的胎牛血清、100 kU/L青霉素G和100 U/L链霉素的DMEM培养基,将IEC-6细胞置于该培养基中,在37 ℃、含体积分数0.05 CO2的细胞培养箱中培养。细胞长至80%~90%融合时,用胰蛋白酶消化传代。
1.2.2 sUA制备 取1 mol/L氫氧化钠溶液溶解尿酸盐,充分搅拌后配制成20 g/L的尿酸溶液,用0.22 μm注射式过滤器过滤,制成澄清淡黄色溶液。
1.2.3 细胞活力检测 IEC-6细胞分别用0、25、50、 100、 200、 400 mg/L浓度sUA刺激24 h后,改用不含血清的培养基,按照MTS细胞增殖试剂盒说明,加入MTS放于37 ℃培养箱孵育2 h。使用酶标仪检测490 nm波长处吸光度值,以其表示细胞活力。
1.2.4 实时荧光定量PCR(RT-PCR)检测PKC、TNFα mRNA表达 分别应用0、25、50、100 mg/L浓度的sUA(分别为A、B、C、D组)刺激IEC-6细胞6 h,RT-PCR方法检测PKC、TNFα mRNA表达。根据试剂说明书步骤进行操作。所用引物及其序列见表1。采用2-ΔΔCt法计算基因的相对表达量。
1.2.5 PKC和TNFα蛋白表达检测 采用Wes-tern blot方法。分别用0、25、50、100 mg/L浓度的sUA(分别为A、B、C、D组)刺激IEC-6细胞24 h;PKC抑制剂组应用100 mg/L浓度sUA刺激IEC-6细胞24 h后,加入0.05 mg/L的PKC抑制剂继续刺激24 h。去除培养液,用PBS冲洗3次。加入RIPA裂解液,室温下12 000 r/min离心取上清液,提取细胞总蛋白,测定蛋白浓度。各组取30 μL总蛋白加入SDS-PAGE凝胶蛋白上样缓冲液,放入100 ℃金属浴煮沸10 min后进行SDS-PAGE凝胶分离。蛋白经凝胶电泳分离后,转印至硝酸纤维素膜上。加入50 g/L的脱脂牛奶室温封闭1 h,分别加入兔源PKC抗体(1∶1 000)、TNFα抗体(1∶1 000),4 ℃孵育过夜。以TBST清洗3次,每次10 min。加入二抗(1∶5 000)室温下孵育1 h后,以TBST洗膜3次。最后通过化学发光法显影,应用Image J软件分析蛋白条带灰度值,以目的蛋白与内参照蛋白灰度值的比值表示PKC、TNFα蛋白表达水平。
1.2.6 细胞内活性氧(ROS)的水平测定 应用DCFH-DA ROS检测试剂盒。IEC-6细胞接种在12孔板,分别用0、25、 50、 100 mg/L浓度sUA(分别为A、B、C、D组)刺激24 h后,去除细胞培养液,加入10 mg/L荧光探针DCFH-DA。将细胞放于37 ℃环境中孵育20 min,用无血清培养液清洗3次,去除残余未进入细胞内的探针,最后应用荧光显微镜和流式细胞仪检测细胞中ROS的含量。
1.2.7 细胞线粒体膜电位检测 采用JC-1线粒体膜电位试剂盒。IEC-6细胞接种在12孔板,分别加入0、25、50、100 mg/L浓度sUA(分别为A、B、C、D组)刺激24 h后,弃去原有培养液,PBS冲洗;加入JC-1工作液,37 ℃细胞培养箱孵育20 min;孵育结束后,使用JC-1缓冲液洗涤3次。设置荧光酶标仪的激发波长490 nm、发射波长590 nm,检测各组细胞线粒体膜电位。 以荧光信号的强度表示细胞线粒体膜电位的变化。
1.2.8 ZO-1表达检测 采用免疫荧光方法。选取100 mg/L浓度的sUA刺激IEC-6细胞24 h后,弃去培养液,用PBS冲洗3次后,加入40 g/L的多聚甲醛室温固定30 min;再次用PBS冲洗3次,加入5 g/L的Tritox-100,室温静置20 min;去除Tritox-100液后PBS漂洗3次,室温下应用体积分数0.05山羊血清封闭30 min,然后加入ZO-1抗体,4 ℃孵育过夜;吸出一抗,PBS冲洗;加入荧光二抗,室温孵育1 h。细胞核染料DAPI染核,使用荧光显微镜观察荧光强度,使用Image Pro Plus软件分析ZO-1表达水平。
以上所有实验均重复3次。
1.3 统计学处理
采用SPSS 17.0软件进行统计学分析。计量资料结果以[AKx-D]±s表示,数据间比较采用单因素方差分析(ANOVA)和t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度sUA刺激对IEC-6细胞活力的影响
与0 mg/L sUA刺激组(对照组)相比较,200、400 mg/L浓度 sUA刺激组细胞活力降低,差异有显著性(F=20.519,P<0.05)。25、 50、 100 mg/L 浓度sUA刺激组细胞活力与对照组相比差异无统计学意义(P>0.05)。见图1。因此,为了避免sUA刺激导致细胞死亡而影响实验结果,后续实验采用25、 50、 100 mg/L浓度的sUA。
2.2 sUA刺激对IEC-6细胞PKC、TNFα mRNA和蛋白表达的影响
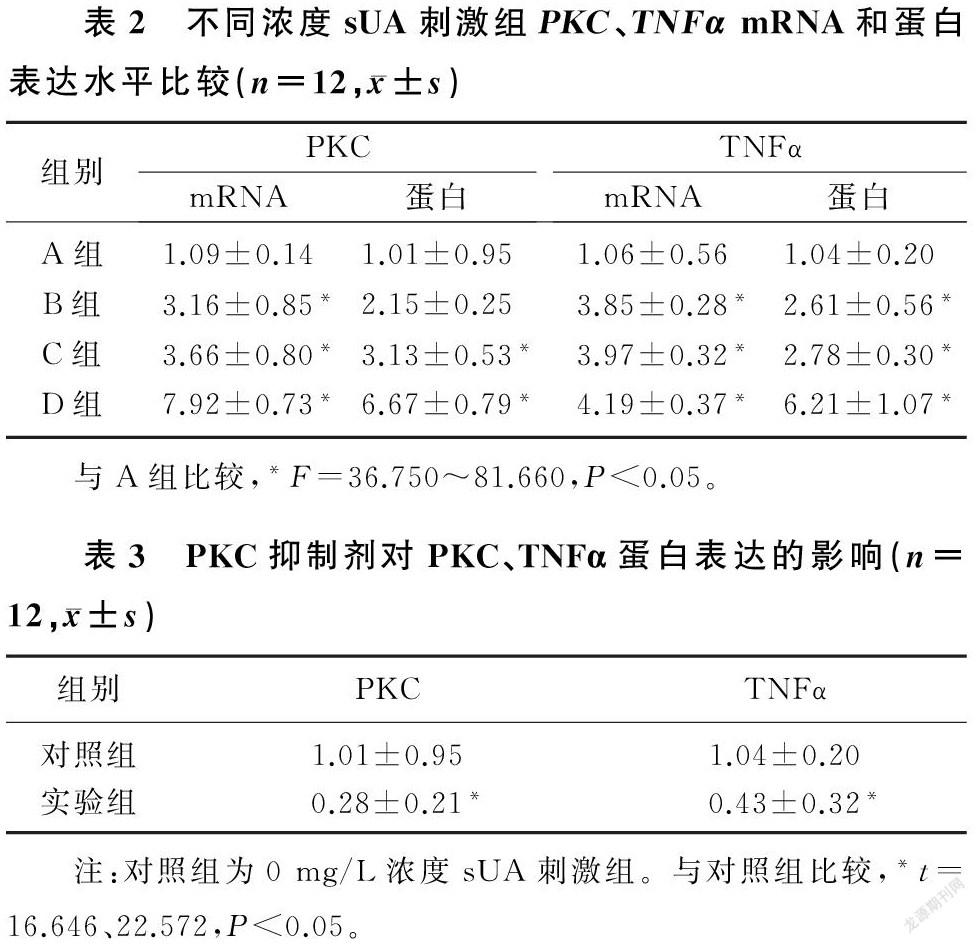
RT-PCR检测结果显示,25、50、100 mg/L浓度sUA刺激组IEC-6细胞PKC mRNA的表达均高于0 mg/L浓度sUA刺激组(对照组),差异有统计学意义(F=51.317,P<0.05)。Western blot检测结果显示,50、100 mg/L浓度sUA刺激组的PKC蛋白表达较对照组增高,差异有统计学意义(F=73.293,P<0.05)。25、50、100 mg/L浓度sUA刺激组TNFα蛋白和mRNA表达明显高于对照组,差异有统计学意义(F=81.660、36.750,P<0.05)。见图2和表2。
2.3 PKC抑制剂对PKC及TNFα表达的影响
加入PKC抑制剂(实验组)刺激IEC-6细胞24 h后,PKC抑制剂组PKC、TNFα蛋白表达显著低于0 mg/L浓度sUA刺激组,差异有统计学意义(t=16.646、22.572,P<0.05)。见图3和表3。
2.4 sUA刺激对IEC-6细胞线粒体膜电位及ROS水平的影响
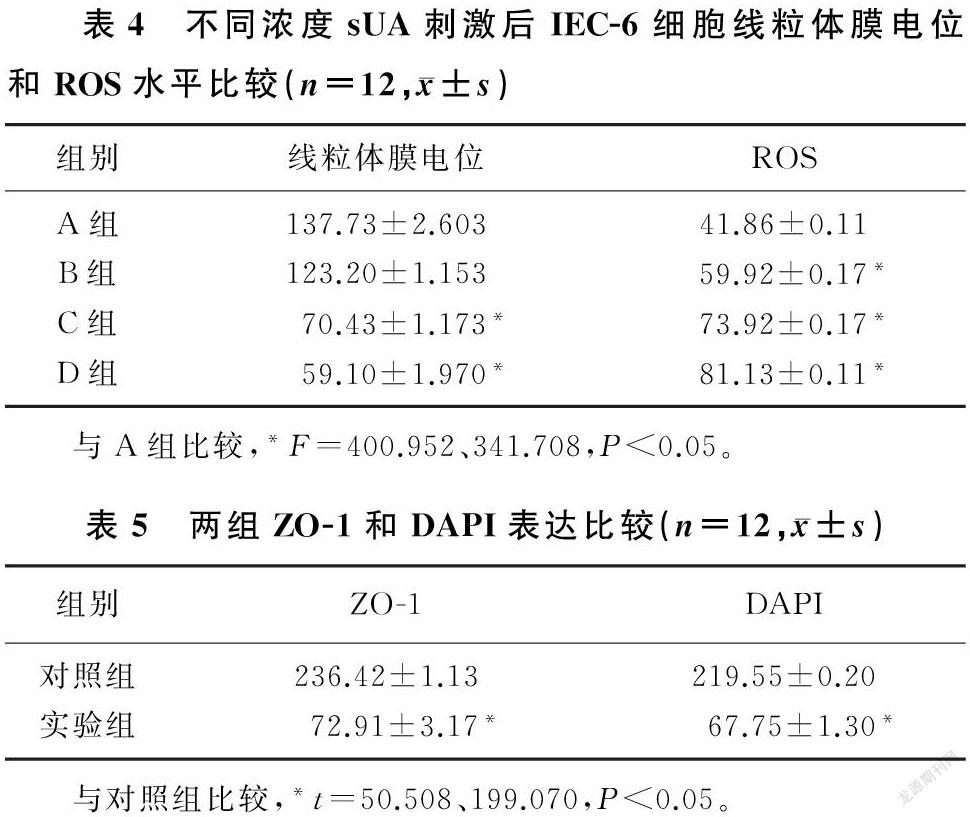
50、100 mg/L浓度sUA刺激组线粒体膜电位与0 mg/L浓度sUA刺激组(对照组)相比明显降低,差异有统计学意义(F=400.952,P<0.05)。与对照组相比较,25、50、100 mg/L浓度sUA刺激组ROS以剂量依赖性方式升高,差异有统计学意义(F=341.708,P<0.05)。见表4。
2.5 sUA刺激对IEC-6细胞ZO-1蛋白及细胞核DAPI染色的影响
以100 mg/L浓度sUA刺激组(实验组)ZO-1以及细胞核DAPI染色表达明显低于0 mg/L浓度sUA刺激组(对照组),差异均具有统计学意义(t=50.508、199.070,P<0.05)。见图4和表5。
3 讨 论
高尿酸血症不仅会导致痛风,同时还与糖尿病、肥胖等代谢疾病密切相关[7-9]。肠道是尿酸排泄的重要途径,肠上皮细胞作为肠屏障的一部分,在维持肠道微生态相对稳定中发挥重要作用[10-11]。肠黏膜上皮细胞与尿酸的相互作用不仅影响尿酸的转运与代谢,还可能损伤肠黏膜屏障,从而促进炎症以及代谢疾病的发生[12-13]。目前,有关尿酸对肠上皮细胞影响的研究较少。探讨尿酸对肠道上皮细胞的影响及其机制,对深入了解高尿酸血症的发病机制及发生发展过程有着重要的意义。
尿酸是一种内源性危险信号,结晶后的尿酸晶体能诱导炎症反应,激活免疫系统[14-15]。目前大部分研究集中于探讨尿酸晶体诱发的炎症反应及免疫过程。有研究显示,sUA可能是一种促炎剂,能够不依赖尿酸晶体诱发炎症反应和免疫过程[16-18]。本研究结果表明,25、50、100 mg/L的sUA刺激能显著激活IEC-6细胞的PKC通路介导的免疫应答,促进TNFα等炎症因子表达,引发炎症反应。为了进一步探究该过程中PKC通路對炎症因子表达增加是否起关键作用,本文检测抑制细胞中PKC的表达后PKC、TNFα蛋白水平的变化。结果显示,sUA刺激可增加IEC-6细胞中PKC的表达,抑制PKC表达后PKC、TNFα蛋白表达显著降低。
ROS作为一种重要的信号分子,可调节细胞的代谢、增殖并参与多种疾病的发生发展[19]。已有研究表明,线粒体产生过量的ROS,引起炎性细胞因子的分泌[20]。尿酸最初被认为是一种抗氧化剂,可以去除ROS,防止老化和氧化应激[21]。近几年研究发现,尿酸不一定是抗氧化剂,某些情况可能会变成促氧化剂。SAUTIN等[22]研究表明,尿酸能激活成熟脂肪细胞中NADPH氧化酶并促使ROS产生增加,诱导脂肪细胞中的氧化还原依赖性信号传导和氧化应激。高浓度的尿酸还可引起β-细胞、血管平滑肌细胞和人脐静脉内皮细胞的氧化应激[23-25]。结合本研究结果,我们推测sUA导致ROS的产生可能是引起炎症反应的另一个机制,但需要進一步的研究探讨。
由于线粒体是细胞中ROS的主要来源,本文进一步研究了sUA刺激对线粒体膜电位的影响。结果表明,高浓度的sUA刺激可导致IEC-6细胞线粒体膜电位下降。线粒体膜电位对维持线粒体功能具有重要作用,若线粒体受损则会通过低效氧化磷酸化不断增加ROS的产生,损害细胞功能[26]。有研究显示,高尿酸血症可改变细胞内线粒体的面积与功能,使机体处于氧化应激状态[27-28]。本文结果与其一致。提示sUA可能通过诱导IEC-6细胞氧化应激,增加ROS的产生,最终导致线粒体损伤。
ZO-1蛋白连接邻近的肠上皮细胞,并且与调节肠道通透性的胞浆肌动蛋白和肌球蛋白网络有关[29-30]。本文研究结果显示,当sUA浓度为200、400 mg/L时,IEC-6细胞活力明显降低,对IEC-6细胞毒性较大。提示sUA破坏了肠细胞间的ZO-1蛋白,进一步损坏肠黏膜屏障,而这些变化与尿酸引起的炎症反应密切相关。
综上所述,尿酸能激活PKC信号通路,改变细胞氧化应激状态,反馈上调炎症因子的表达,进一步扩大炎症反应。尿酸引起的炎症反应可能是其损害肠道黏膜屏障的重要机制之一。这一发现对于进一步研究高尿酸血症并发症的机制及靶点治疗具有重要的指导意义。但该研究结果还需要进一步的动物实验验证。
[参考文献]
[1]MANDAL A K, MOUNT D B. The molecular physiology of uric acid homeostasis[J]. Annual Review of Physiology, 2015,77:323-345.
[2]PETERSON L W, ARTIS D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis[J]. Nature Reviews Immunology, 2014,14(3):141-153.
[3]BROQUET A H, HIRATA Y, MCALLISTER C S, et al. RIG-I/MDA5/MAVS are required to signal a protective IFN response in Rotavirus-infected intestinal epithelium[J]. Journal of Immunology, 2011,186(3):1618-1626.
[4]ABREU M T. Toll-like receptor signalling in the intestinal epithelium: how bacterial recognition shapes intestinal function[J]. Nature Reviews Immunology, 2010,10(2):131-144.
[5]ELINAV E, HENAO-MEJIA J, FLAVELL R A. Integrative inflammasome activity in the regulation of intestinal mucosal immune responses[J]. Mucosal Immunology, 2013,6(1):4-13.
[6]MAKHOUL S, DORSCHEL S, GAMBARYAN S, et al. Feedback regulation of syk by protein kinase C in human platelets[J]. International Journal of Molecular Sciences, 2019,21(1):E176.
[7]马东芹. 血尿酸与2型糖尿病主要代谢指标的相关性研究[D]. 长春:吉林大学, 2015.
[8]穆尧,张莹,韩松. 血尿酸水平与男性人群代谢综合征发病关系的系统综述与Meta分析[J].中国煤炭工业医学杂志, 2016,19(12):1752-1757.
[9]BILLIET L, DOATY S, KATZ J D, et al. Review of hyperuricemia as new marker for metabolic syndrome[J]. ISRN Rheumatology, 2014,2014:52954.
[10]MABBOTT N A, DONALDSON D S, OHNO H, et al. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium[J]. Mucosal Immunology, 2013,6(4): 666-677.
[11]OUELLETTE A J. Paneth cells and innate mucosal immunity[J]. Current Opinion in Gastroenterology, 2010,26(6):547-553.
[12]AMAR J, CHABO C, WAGET A, et al. Intestinal mucosal adherence and translocation of commensal bacteria at the early onset of type 2 diabetes: molecular mechanisms and probiotic treatment[J]. EMBO Molecular Medicine, 2011,3(9):559-572.
[13]CANI P D, AMAR J, IGLESIAS M A, et al. Metabolic endotoxemia initiates obesity and insulin resistance[J]. Diabetes, 2007,56(7):1761-1772.
[14]MARTINON F, PTRILLI V, MAYOR A, et al. Gout-associated uric acid crystals activate the NALP3 inflammasome[J]. Nature, 2006,440(7081):237-241.
[15]GHAEMI-OSKOUIE F, SHI Y. The role of uric acid as an endogenous danger signal in immunity and inflammation[J]. Current Rheumatology Reports, 2011,13(2):160-166.
[16]CRIAN T O, CLEOPHAS M C, OOSTING M, et al. Soluble uric acid primes TLR-induced proinflammatory cytokine production by human primary cells via inhibition of IL-1Ra[J]. Annals of the Rheumatic Diseases, 2016,75(4):755-762.
[17]XIAO J, FU C S, ZHANG X L, et al. Soluble monosodium urate, but not its crystal, induces toll like receptor 4-dependent immune activation in renal mesangial cells[J]. Molecular Immunology, 2015,66(2):310-318.
[18]XIAO J, ZHANG X L, FU C S, et al. Soluble uric acid increases NALP3 inflammasome and interleukin-1β expression in human primary renal proximal tubule epithelial cells through the Toll-like receptor 4-mediated pathway[J]. International Journal of Molecular Medicine, 2015,35(5):1347-1354.
[19]SENA L A, CHANDEL N S. Physiological roles of mitochondrial reactive oxygen species[J]. Molecular Cell, 2012,48(2):158-167.
[20]CHANDEL N S, TRZYNA W C, MCCLINTOCK D S, et al. Role of oxidants in NF-kappa B activation and TNF-alpha gene transcription induced by hypoxia and endotoxin[J]. Journal of Immunology (Baltimore, Md: 1950), 2000,165(2):1013-1021.
[21]MURAOKA S, MIURA T. Inhibition by uric acid of free radicals that damage biological molecules[J]. Pharmacology & Toxicology, 2003,93(6):284-289.
[22]SAUTIN Y Y, NAKAGAWA T, ZHARIKOV S, et al. Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress[J]. American Journal of Physiology Cell Physiology, 2007,293(2):C584-C596.
[23]YU M N, SNCHEZ-LOZADA L G, JOHNSON R J, et al. Oxidative stress with an activation of the renin-angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid-induced endothelial dysfunction[J]. Journal of Hypertension, 2010,28(6):1234-1242.
[24]ZHANG Y N, YAMAMOTO T, HISATOME I, et al. Uric acid induces oxidative stress and growth inhibition by activating adenosine monophosphate-activated protein kinase and extracellular signal-regulated kinase signal pathways in pancrea-tic β cells[J]. Molecular and Cellular Endocrinology, 2013,375(1-2):89-96.
[25]CHAO H H, LIU J C, LIN J W, et al. Uric acid stimulates endothelin-1 gene expression associated with NADPH oxidase in human aortic smooth muscle cells[J]. Acta Pharmacologica Sinica, 2008,29(11):1301-1312.
[26]BARDAWEEL S K, GUL M, ALZWEIRI M, et al. Reactive oxygen species: the dual role in physiological and pathological conditions of the human body[J]. The Eurasian Journal of Medicine, 2018,50(3):193-201.
[27]BRAGA T T, FORNI M F, CORREA-COSTA M, et al. So-luble uric acid activates the NLRP3 inflammasome[J]. Scienti-fic Reports, 2017,7:39884.
[28]JHANG J J, LIN J H, YEN G C. Beneficial properties of phytochemicals on NLRP3 inflammasome-mediated gout and complication[J]. Journal of Agricultural and Food Chemistry, 2018,66(4):765-772.
[29]BLAIR S A, KANE S V, CLAYBURGH D R, et al. Epithe-lial myosin light chain kinase expression and activity are upre-gulated in inflammatory bowel disease[J]. Laboratory Investigation; a Journal of Technical Methods and Pathology, 2006,86(2):191-201.
[30]MARCHIANDO A M, SHEN L, GRAHAM W V, et al. Caveolin-1-dependent occludin endocytosis is required for TNF-induced tight junction regulation in vivo[J]. The Journal of Cell Biology, 2010,189(1):111-126.
(本文編辑 黄建乡)
3521500338238

