某医院女性体检者人乳头瘤病毒感染状况及影响因素分析
杜彦丹 孙辉 包春喜 郑海军 李春雨 董占柱 张仕华
作者单位:022150 内蒙古自治区牙克石,内蒙古林业总医院/内蒙古民族大学第二临床医学院检验科
人乳头瘤病毒(human papillomavirus,HPV)是双链DNA小分子病毒,根据对宫颈癌的致病性强弱可以分为低危型HPV(low-risk HPV,LR-HPV)和高危型HPV(high-risk HPV,HR-HPV)两大类[1]。目前已经确认,宫颈癌的主要致病因素是HR-HPV的持续感染,而HR-HPV的持续感染与宫颈癌的发生密切相关[2]。不同年龄段女性的HPV感染率和感染型别均不相同,不同HPV亚型的致病性也不相同。有研究表明,在不同地区,由于不同的生活和卫生习惯等,HPV感染型别分布也有很大差异,常见的HPV感染高危因素主要有饮酒、受教育水平低下、早婚、不洁的性生活、多育、口服避孕药、吸烟等[3]。内蒙古自治区呼伦贝尔地区位处草原与森林的交汇地带,是少数民族聚集区,当地居民的生活习惯与其他地区有较大差异。对当地三甲医院体检人群的HPV感染状况及相关危险因素进行调查和分析,为该地区女性宫颈癌的预防起到积极作用,现将结果报告如下。
1 资料与方法
1.1研究对象及一般资料 选择2021年1月—2022年2月在内蒙古林业总医院(内蒙古民族大学第二临床医学院)进行HPV检查的783名女性体检者作为研究对象,年龄25~65岁,平均(43.69±6.34)岁。根据年龄分为20~35岁组(108例)、36~45岁组(339例)、46~55岁组(324例)和>55岁组(12例)。所有研究对象均进行HPV基因分型检测,且在知情同意原则下自愿填写相关危险因素的调查问卷。问卷为面对面填写,全部填写后将问卷收回,剔除无效答卷,进行整理。
1.1.1纳入标准 ① 年龄22~65岁;② 无宫颈或生殖道畸形者;③ 不在月经期;④ 有性生活史的女性;⑤ 取样前3 d无阴道用药史,且能耐受检查者。
1.1.2排除标准 ① 处于月经期;② 宫颈病变者;③ 合并有其他疾病,不能接受检查者;④ 使用药物影响检测结果;⑤ 标本采集不符合要求。
1.1.3伦理学 本研究方案符合医学伦理学标准,并经内蒙古林业总医院伦理委员会批准(审批号:2022-1225),所有检测均获得过受检者知情同意。
1.2仪器与试剂 北京博晖创新生物技术股份有限公司生产的BHF-VI核酸芯片检测仪,使用配套HPV核酸检测试剂盒。
1.3检测方法 对研究对象由妇科专业医生行宫颈取材,取宫颈上皮细胞后,放入样本保存液中及时送检。使用核酸芯片检测仪及配套HPV核酸检测试剂盒,采用生物芯片法进行HPV检测,采用聚合酶链反应(polymerase chain reaction,PCR)体外扩增和DNA反向斑点杂交法相结合的DNA芯片技术,主要用于HPV感染的定性检测和HPV基因分型。分别检测出18种高危型HPV和6种低危型HPV。
1.4统计学方法 所有数据采用SPSS 19.0统计软件进行分析。多型别感染者各组的阳性率重复计算,计数资料采用χ2检验;危险因素分析应用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1HPV单一和多重感染情况 在783名体检者中,检出HPV阳性93例(单一或多重型别感染),总阳性检出率为11.88%;其中单一型别感染77例,感染率为9.89%;多重型别感染16例,其中以二重感染最多见(14例),感染率为1.79%;三重感染1例,感染型别为HPV42、HPV44、HPV51型;四重感染1例,感染型别为HPV39、HPV42、HPV44、HPV53型。见表1。

表1 783名体检者中检出的HPV感染型别分析
2.2不同亚型HPV感染率比较 93例感染者中,高危型感染以HPV52、HPV58、HPV68、HPV16亚型为主,低危型感染以HPV42、HPV6、HPV44亚型为主,且不同亚型HPV的感染率差异有统计学意义,感染率最高的亚型为HPV52型,检出15例,感染率为1.92%,在阳性感染者中占16.13%。见表2。

表2 93例HPV感染者不同亚型HPV分布
2.3不同年龄段人群HPV感染情况分布 783例体检者中,>55岁年龄组HPV感染者的感染率最高,为25.00%,其次为46~55岁人群,感染率为12.96%。由于>55岁群体多数为绝经后人群,该年龄段人群常规体检人数较少;因此>45岁的人群HPV感染率较高。不同年龄段女性受检者的HPV感染情况和感染率比较见表3。

表3 不同年龄段体检人群HPV感染率比较
2.4HPV感染危险因素的单因素分析 对783名体检者的临床资料进行Logistic回归分析,以是否感染HPV为因变量(Y),赋值为未感染HPV=0,感染HPV=1;以年龄(X1)、民族(X2)、吸烟(X3)、居住环境(X4)、饮酒(X5)、月经初潮年龄(X6)、定期妇科体检(X7)、性伴侣人数(X8)、每日清洗外阴(X9)、房事前清洗(X10)、孕产史(X11)、是否避孕(X12)、避孕方式(X13)、肿瘤家族史(X14)、既往宫颈疾病(X15)、是否了解HPV(X16)为自变量。将各组自变量进行单因素Logistic回归分析,结果表明吸烟、性伴侣人数、每日清洗外阴、房事前清洗、既往宫颈疾病均为HPV感染的影响因素,差异均有统计学意义(均P<0.05)。见表4。
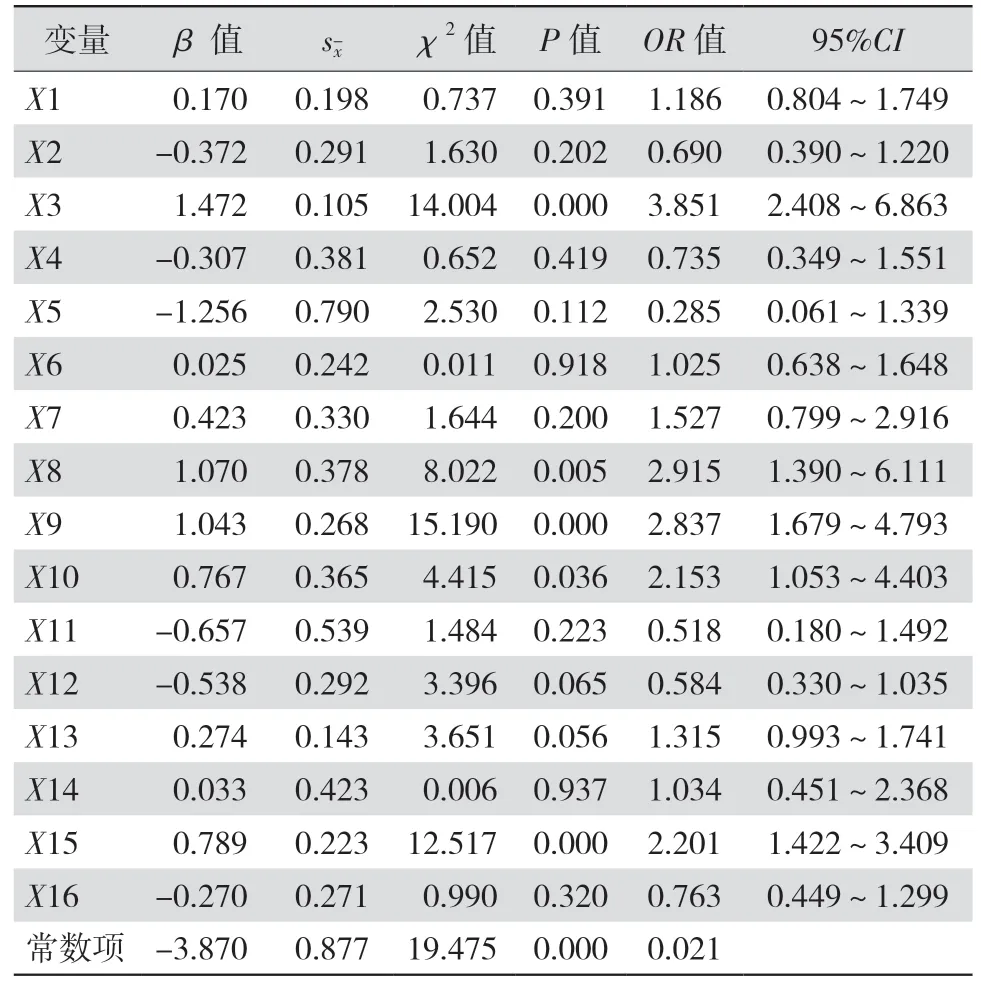
表4 HPV感染危险因素的单因素非条件Logistic回归分析
2.5HPV感染危险因素的多因素Logistic回归分析 对单因素中有意义的5个变量(吸烟、性伴侣人数、每日清洗外阴、房事前清洗、既往宫颈疾病)进行多因素非条件Logistic回归分析,结果表明吸烟〔优势比(odds ratio,OR)为2.547,95%可信区间(95% confidence interval,95%CI)为2.408~6.863〕、性伴侣人数≥2(OR值为2.411,95%CI为1.390~6.111)为感染HPV的危险因素,差异均有统计学意义(均P<0.05),每日清洗外阴为HPV感染的保护性因素(OR值为2.885,95%CI为1.679~4.793)。见表5。

表5 HPV感染危险因素的多因素非条件Logistic回归分析
3 讨论
宫颈癌是女性生殖系统发病率居于首位的恶性肿瘤,我国每年新发病例数高达10万例[4]。目前已经公认,HR-HPV的持续感染与宫颈癌的发生密切相关,尤其HPV16和HPV18的致癌作用最强。大量研究表明,在不同地区、生活习惯和年龄段人群中HPV的感染率和感染型别都有较大差异[5-6]。一项关于中国女性HR-HPV感染的Meta分析数据表明,我国普通女性HPV的感染率为15.71%,且北方地区高危型HPV的感染率普遍高于南方地区[7]。呼伦贝尔地区女性体检者HPV总感染率为11.88%,低于国内平均水平,高危型别以HPV52型感染率最高,低危型以HPV42和HPV6型为主,我国高危型别感染率最高的是HPV16。有文献报道,云南省曲靖地区高危型HPV感染以HPV16型为主;低危型HPV感染以HPV40、HPV44型为主,表明HPV感染率和感染型别存在地区差异[8],可能是由于不同地区居民的生活习惯和卫生状况等多种因素导致。
国内外多项研究均表明,不同年龄段人群的HPV感染率和基因型别也各不相同,女性年轻人和围绝经期是感染的高峰年龄段,呈U字形分布特点[9-11]。本研究中感染率最高的年龄段为>55岁女性,其次是46~55岁女性,这与国内其他地区的调查存在一定差异[12],可能原因是>55岁人群性生活相对减少,体检意识也较为缺乏,同时该年龄段的人群机体免疫力较弱,HPV感染后自我清除能力较差,增加了HPV的感染率。36~45岁女性的HPV感染率最低,可能是由于该年龄段人群注重体检,机体免疫力较强,HPV感染后自我清除能力较强,从而降低了感染HPV的概率。
有研究表明,宫颈癌大多是由HR-HPV持续感染10年以上发展而来,超过70%的人可将HPV从体内自行清除,少部分人会从宫颈炎症向宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)和癌症进展[13]。导致HPV的侵袭性感染有很多高危因素,有效规避这些危险因素能减少宫颈炎症到宫颈CIN和宫颈癌的转变[14]。本研究中吸烟和性伴侣人数≥2均为感染HPV的危险因素。吸烟者感染HPV的概率是不吸烟者的2.547倍,因为烟草中含有尼古丁[15]。长期吸烟者体内的高水平尼古丁会使机体免疫力降低,引起免疫细胞减少,尤其是CD4+T细胞,此外吸烟还会影响女性体内雌激素代谢以及宫颈局部的一氧化氮(nitric oxide,NO)含量,引起宫颈基质成分的改变,容易导致HPV的感染;性伴侣人数≥2的人群更易感染HPV,对于这类人群应进行定期体检,有针对性地规避可能存在的危险因素,有效防止宫颈癌的发生。本研究中HPV感染的保护性因素为每日清洗外阴,由于女性生殖道生理结构的特点,非常容易受尿液或粪便的感染而出现阴道炎,且女性外阴部皮肤特殊的结构褶皱较多,易导致细菌在此隐藏,因此每日清洗外阴,提高健康防范意识,能有效降低HPV的感染率。有针对性地规避HPV感染的危险因素能有效减少因HPV感染导致的宫颈癌。
利益冲突所有作者均声明不存在利益冲突

