重症急性胰腺炎腹腔不同分区局部并发症的微创治疗
许克东,马振华,曹 芳,仵 正
(西安交通大学第一附属医院a.肝胆外科,b.转化医学中心,陕西 西安 710061)
急性胰腺炎为消化系统常见病、多发病,国内尚无大范围的流行病学调查数据。全球发病率为(4.9~73.4)/10万[1],且呈逐年升高趋势。常见病因包括胆石病、高三酰甘油血症、酒精、医源性、药物等。按严重程度,急性胰腺炎分为轻症、中度重症及重症。中度重症及重症胰腺炎病人病程迁延、花费巨大、病死率高。除早期合并器官功能衰竭外,胰腺局部并发症为加重疾病进程的主要因素,感染性坏死死亡率高达40%[2]。胰腺炎局部并发症包括急性胰周液体积聚 (acute peripancreatic fluid collection,APFC)、急性坏死物积聚 (acute necrotic collection,ANC)、胰腺假性囊肿 (pancreatic pseudocyst,PPC)、包裹性坏死(walled-off necrosis,WON)[1]。APFC及ANC为早期并发症,多数不需有创干预。PPC、WON大多为后期并发症,无症状者可随访观察,有症状者多数需穿刺引流、微创手术,甚至开腹手术治疗。随着重症医学及器官替代治疗的长足进步,更多的病人可度过多器官功能衰竭相关的第1个“死亡高峰”,进入与胰腺感染性坏死相关的第2个“死亡高峰”[3-4]。胰腺坏死及积液分布范围与手术方式及手术入路显著相关,且不同部位坏死组织继发感染后病死率差异有统计学意义[5]。关于积液分布的研究大多基于解剖学及影像学,与疾病严重程度相关[6-8]。越来越多的胰腺外科专家认识到不同分区局部并发症的处理具有不同的特点[7,9]。但不同部位积液与微创手术方式选择以及手术入路方面的报道仍较少。
腹腔不同分区
一、解剖学基础
胰腺为腹膜外位器官,因此胰腺局部并发症多数于腹膜后腔隙中蔓延,部分病例可突破胰腺表面腹膜而累及小网膜囊,而坏死组织很少累及游离腹腔[10]。有研究以肾筋膜为中心,将腹膜后间隙分为肾旁前间隙、肾周间隙及肾旁后间隙[11]。急性胰腺炎发作时胰液破坏筋膜间薄弱部位,可使液体在这3个间隙间播散,甚至向上经食管裂孔扩散至纵隔,向下扩散至盆腔、腹股沟区及阴囊(大阴唇)等部位[12]。左、右两侧腹膜后腔隙在腹腔大血管前方相通,因此,当某一侧肾周前间隙积液较多时,可经大血管部位扩散至对侧,进而继续扩散至对侧肾周间隙及肾旁后间隙,形成播散范围最广的“马蹄形坏死”。此外,胰液还可经横结肠系膜根部、小肠系膜根部扩散至小网膜囊、大网膜、肝十二指肠韧带、肠系膜内部等。当胰液突破脏腹膜进入游离腹腔时,多数聚集在下腹部及盆腔,部分形成分隔状积液(见图1)。
二、腹腔分区
结合以上解剖学分析,笔者团队在既往研究的基础上结合自身临床经验提出胰腺炎局部并发症分区的概念。基于该分区方式,结合积液部位、局部并发症和术者经验的不同,选择个体化治疗方式。根据积液扩散范围,将并发症区域分为左侧区(胰体尾部区域、小网膜囊、脾周、左肾周、左侧结肠旁沟、左侧盆腔)(见图1B)、右侧区(胰头及钩突区域、十二指肠外侧、右肾周、右侧结肠旁沟、右侧盆腔)(见图1C)以及中央区(局限于胰腺周围、小网膜囊、肠系膜根部、腹腔大血管周围而未向两侧流注)(见图1D)。该分类方法基于局部可能出现的并发症问题,结合不同解剖结构及手术入路,分别进行阐述。左侧区域内包含重要器官较少,除胰腺外有脾脏、胃、横结肠左半部、降结肠、乙状结肠、左肾等。因结肠脾曲特殊的解剖结构,该部位积液可能影响结肠脾曲血供,缺血、狭窄甚至坏死,严重者需开腹手术造瘘或切除结肠。右侧区域内包含重要器官较多,除胰腺外尚有十二指肠降段及水平段、肝脏、胆道、横结肠右半部、升结肠、右肾等。局部积液引起胆道梗阻及十二指肠梗阻可能性大。中央区域包含胰腺、小网膜囊、腹腔大血管等。该部位积液易引起出血,可波及肝十二指肠韧带,引起胆道梗阻、门静脉血栓、胃十二指肠梗阻及小肠梗阻,治疗也较棘手。
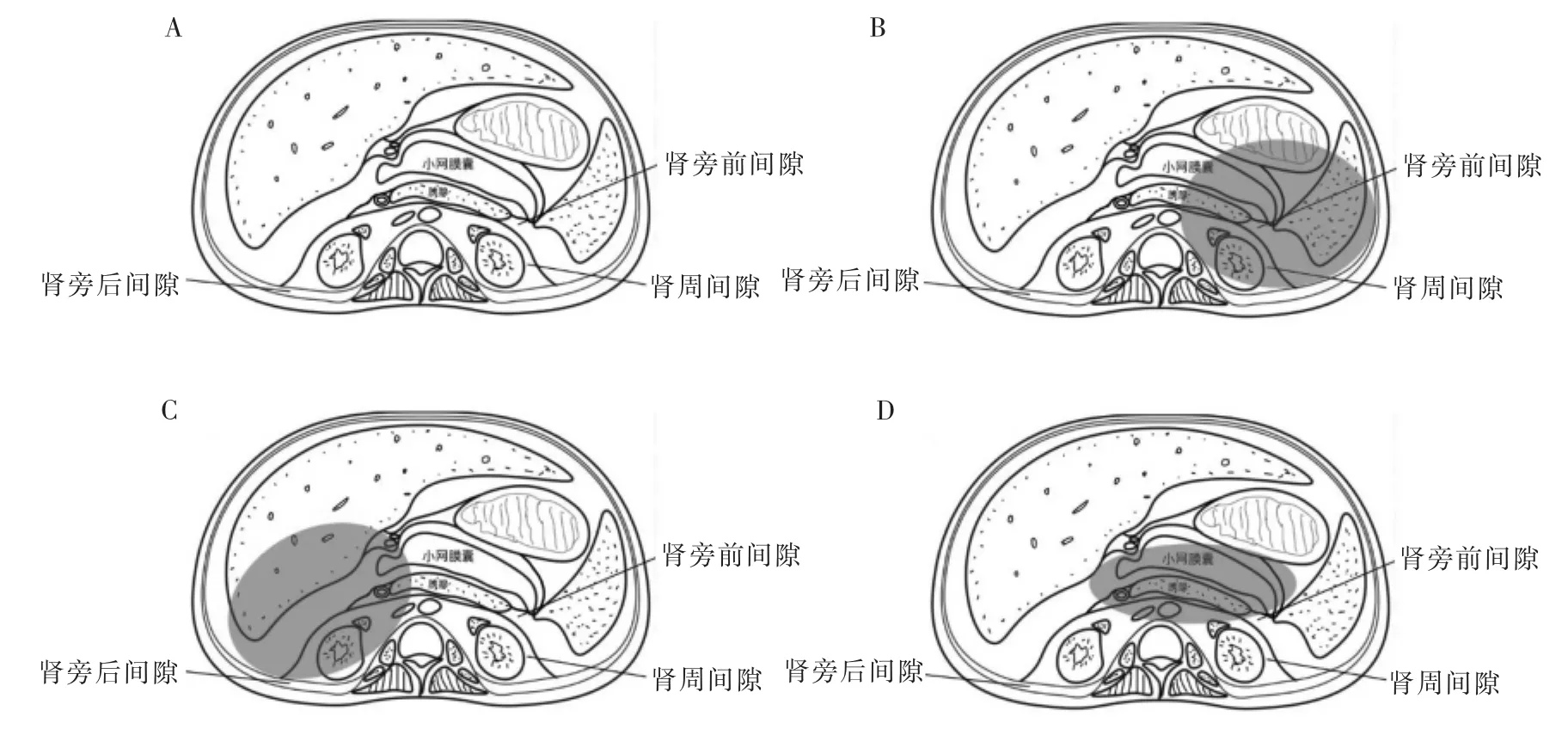
图1 腹腔分区
胰腺炎局部并发症的微创治疗
急性胰腺炎早期形成的APFC以ANC因部分可后期自行吸收,转归尚不明确,多数情况无需早期干预。后期形成的PPC及WON均可按照有症状及无症状两类而选择不同的随访和治疗模式。对于无症状的PPC以及WON,均可安全随访,而不采取有创干预的方式。随访中,50%以上的积液及坏死组织可自行吸收或液化而好转甚至痊愈[13]。无症状的PPC及WON随访中可能出现胃、十二指肠、小肠、胆道梗阻和继发感染等,处理原则与有症状的PPC及WON相同[14]。当PPC及WON出现症状时,根据部位、症状、发病时间、病人全身状况以及术者经验选择不同的处理方式。
一、PPC
(一)经皮穿刺置管引流
PPC为急性胰腺炎常见并发症,70%~85%的病人不需特殊治疗,可自行吸收、囊肿消失,无需早期干预[15]。对于不同分区的PPC处理原则区别不大。当PPC出现相关梗阻、感染、压迫症状时多需有创治疗,包括经皮穿刺置管引流(percutaneous catheter drainage,PCD)及经消化道穿刺置管引流。PCD操作简单,多在超声或CT引导下完成。主要并发症为穿刺相关损伤、出血、导管移位以及胰液皮肤瘘等。其中尤以胰液皮肤瘘严重,常迁延不愈,且PCD在感染状态下引流效果欠佳。因此,其在笔者团队较少用于PPC,而主要用于囊肿合并感染、全身情况差、高龄等不能耐受手术的情况。
(二)内镜下引流
当明确PPC与胰头部主胰管相通时,可采用内镜经十二指肠乳头引流术 (transpapillary drainage,TPD)。引流方式包括内镜胰管支架植入(endoscopic retrograde pancreatic drainage,ERPD)及内镜鼻胰管引流 (endoscopic naso-pancreatic drainage,ENPD)。其不适用于胰管明显狭窄、支架难以通过或狭窄靠近胰尾部的PPC,且存在支架移位、鼻胰管脱落、鼻胰管长期留置导致鼻咽部压迫症状等风险。笔者团队倾向于采用超声内镜(endoscopic ultrosound,EUS)经胃及十二指肠穿刺置管引流术。注意事项如下:①囊肿与消化道壁之间的距离<1 cm;②穿刺部位应选择在囊肿膨出处,术中行EUS探查,避开血管区;③囊肿一般应为单个、囊壁成熟、直径>5 cm,消化道受压明显;④囊内容物以液体为主,含坏死物质过多易堵塞引流管,出现继发感染等并发症。Yang等[16]的一项多中心回顾性研究分析174例PPC病人,对比行EUS引导下单纯经消化道引流(95例)与消化道引流联合经十二指肠乳头引流(79例),两者成功率为97%比44%(P=0.000 1),而在并发症发生率、客观症状缓解率以及影像学缓解率方面,差异无统计学意义。提示行EUS引导下单纯经消化道引流可有效治疗PPC。
(三)手术治疗
PPC手术治疗适应证如下:①内镜介入治疗失败或出现相关并发症;②合并多发主胰管狭窄;③有胰头区炎性包块等复杂合并症,合并感染、出血、破裂等;④怀疑囊性肿瘤。手术方式包括外引流、内引流及切除术。随着微创技术的发展,单纯外引流手术已很少采用,常用于囊肿未成熟、破裂等不能一期干预的情况。内引流根据囊肿位置不同,选择胰胃吻合或胰肠吻合。切除术根据囊肿位置不同,选择行保留十二指肠的胰头切除、胰十二指肠切除或胰体尾(保留或不保留脾脏)切除术[17]。
二、WON及感染性坏死
(一)手术指征
PPC和WON继发感染是目前重症胰腺炎并发症中常见的外科干预指征,也是引起重症胰腺炎病人第2个“死亡高峰”的主要原因。指南推荐感染性胰腺坏死为手术治疗重症胰腺炎并发症的指征之一[1]。但对于感染性胰腺坏死的诊断仍较困难,其诊断标准包括如下:①细针穿刺(fine needle aspiration,FNA)细菌学检查阳性;②增强CT检查见气泡征。在临床实际工作中,FNA细菌学检查阳性率偏低,存在假阴性[18]。增强CT检查气泡征在感染性胰腺坏死确诊病人中阳性率仅51%,而在胰腺坏死病人中仅18%[19]。因此,胰腺坏死病人出现发热、腹痛、全身情况恶化等感染症状时均应考虑感染性胰腺坏死的可能,往往需外科干预。此外,当胰腺坏死无明确感染症状而出现腹痛、恶心、呕吐、营养不良、胃肠道梗阻、胆道梗阻、复发性胰腺炎、胰漏、持续性全身炎症反应综合征时,也应考虑及时行引流或清创术,以改善总体预后。
(二)手术策略
目前多采用以微创为主的治疗模式,包括PCD、视频辅助清创 (vedio-assisted debridement,VAD)、内镜清创(endoscopic debridement)。荷兰研究团队提出“Step-up”的策略[20],内镜“Step-up”与外科“Step-up”[21]的合理选择已显著提高重症胰腺炎疗效。但是否所有病人均应严格按照升阶梯步骤进行,则需根据具体情况采用个体化策略。笔者中心常接诊由下级医院转诊的病人,发病已达4周以上,明确存在界限清晰的感染性胰腺坏死。直接行VAD,均取得良好疗效。胰腺坏死组织与正常组织界限不清时,往往不能通过一次手术彻底清创,局部残余感染灶可能需再次清创或PCD。优先选择内镜“Step-up”还是外科“Step-up”,仍有很大争议。内镜“Step-up”需特殊的器械,由经验丰富的内镜医师操作。目前国内多数胰腺外科中心采用外科“Stepup”的方式[1]。
与国内、外大多数中心一样,对于感染性胰腺坏死,病程≥4周是笔者团队选择干预方式时主要参考的时间因素。对于<4周的病人,仍采用PCD、抗生素、营养支持以及必要的器官功能支持治疗[2]等保守方法。笔者团队对于感染性坏死多采用经皮肾镜处理[22]。PCD的路径选择尤为重要,需考虑后续VAD等手术通路问题。还需考虑腹膜后积液引流后结肠回归原始位置时,可能出现的引流管相关性结肠漏及结肠梗阻的可能。因此,应与超声和放射科医师充分沟通,在保证后续干预手术通路的前提下,尽量避免医源性损伤。
(三)中央区感染性坏死的手术方式选择
发病≥4周的病人,根据分区不同,处理方式选择差异较大。中央区感染性坏死因积液局限于胰腺周围,未向两侧流注,经左、右侧腹膜后区域穿刺往往难以避开肠道、肾脏等重要脏器,多数需选择前腹部入路或腹腔镜清创术(见图2A)。已于小网膜囊部位行PCD的病人,可先行窦道扩张至16~20 F,培育1周后行经皮肾镜清创术(见图2B)。窦道培育可避免后腹膜腔感染播散至腹腔而加重症状,并减少后期并发症发生。为避免医源性肠漏的发生,在操作之前需明确PCD导管与胃、十二指肠及结肠的关系,尽可能在保证其距离肠管1 cm以上时选择该术式(见图2C)。
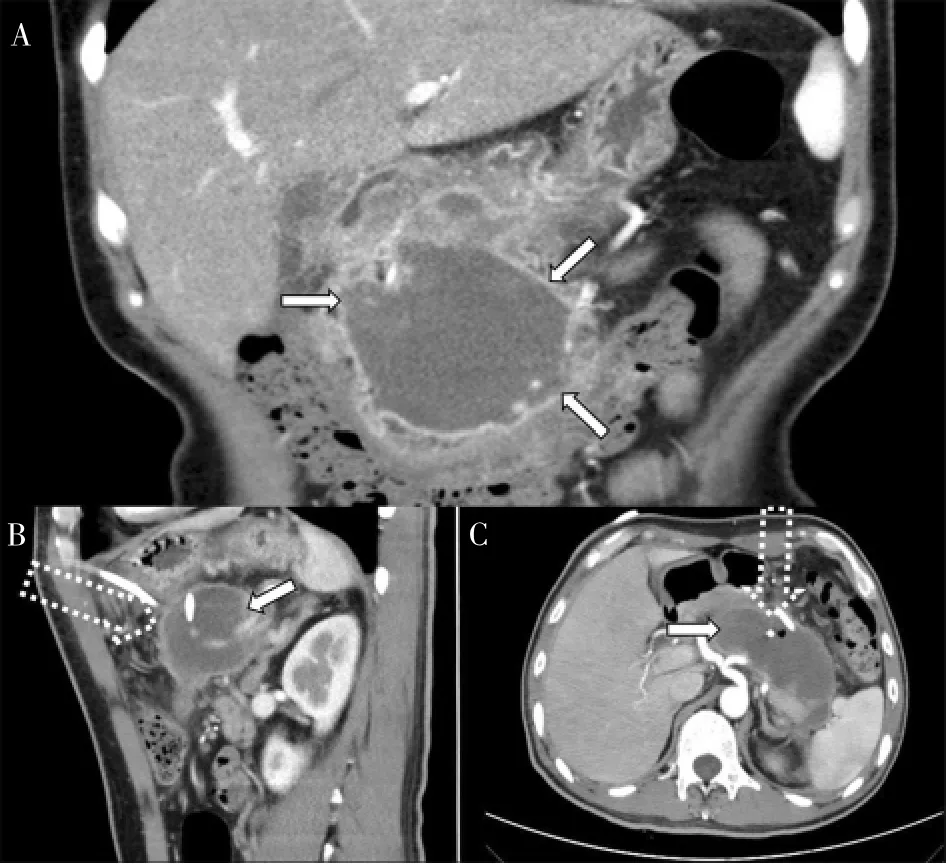
图2 中央区感染CT检查图像
未留置PCD引流管的病人,可选择经前腹部入路,于感染灶距体表最近部位切开至腹腔。穿刺确认感染灶后,打开感染腔前壁,隔绝感染腔与腹腔,腹腔镜下用卵圆钳清理坏死组织。深在部位腹腔镜不易观察时,可经皮肾镜清创,放置28 F冲洗引流管。术后根据引流情况,不常规行冲洗引流,存在残余感染灶时可于1周后再次行经皮肾镜清创。
胃后壁为主的感染灶,可行腹腔镜经胃清创术。腔镜下打开胃前壁,于后壁隆起最明显部位穿刺。确认无误后,超声刀打开脓腔,以直线切割闭合器行胃后壁与脓腔前壁缝合,腔镜直视下行清创术,难以直视部位可行胆道镜或经皮肾镜辅助清创。对于感染性坏死向左、右两侧播散较远时,该方法可能遗留感染灶。部分病人后期需行胃镜清创术。腹腔镜经胃清创术优点在于胰液皮肤瘘发生率低,胆源性胰腺炎病人可选择性同期行胆囊切除术。但术后禁饮禁食时间较长,不易管理,存在消化道出血甚至大出血的风险。
中央区感染性坏死,因解剖结构特殊,需结合术者经验及各中心包括消化内镜、血管介入等相关学科技术能力选择。不可强求毕其功于一役,以保证安全为前提行清创术,为后续治疗预留合适的路径。必要时及时开腹手术,以防发生严重并发症。
(四)右侧区感染性坏死的手术方式选择
右侧区感染性坏死可选择右侧腹膜后入路。若术前已留置合适的PCD引流管,可于术中逐级扩张至30 F后置入10 mm trocar,以经皮肾镜辅助行清创术。右侧区走行有十二指肠降段及水平段,在该部位操作时需避免十二指肠副损伤,尤其是第一次行清创术时。若坏死不充分或界限不清晰,可留置引流,留待再次干预。当流注范围较广泛时,可选择双通道或三通道清创。每个通道留置冲洗引流管,需要时可于术后行冲洗引流。术中出血时,可电凝或血管夹止血。右侧区因走行有胆道及胃肠道,可能出现坏死灶引起的胆道及胃肠道梗阻。出现上述症状时,尽早行引流或清创治疗,避免后期发生胆道或胃肠道炎性狭窄而需行旁路手术(见图3A)。
(五)左侧区感染性坏死的手术方式选择
左侧区感染性坏死,可选择左侧腹膜后入路,方法同右侧。该部位因组织器官较少,处理相对简单。但因左侧结肠旁沟较长,行PCD或穿刺时需尽量选择左侧Toldt线背侧,避免穿刺或手术操作时,胰液或脓液播散至腹腔内而加重症状(见图3B)。此外,左侧流注多数来源于胰腺体尾部坏死、感染性病灶,该部位主胰管破裂后胰液皮肤瘘发生率高,病程迁延。应在病情稳定、感染灶清理完毕后尽早开始后续胰管桥接治疗。
腹膜后大范围流注形成“马蹄形”坏死时,可经左、右侧腹膜后入路行清创术,具体方式可参考上述左侧区及右侧区感染性坏死处理原则(见图3C)。

图3 左、右侧区及双侧区感染CT检查图像
三、手术通路相关损伤控制
随着“Step-up”的理念深入人心,越来越多的单位开展超声或CT引导下PCD治疗胰腺炎局部并发症。笔者中心近期接诊了多例因穿刺副损伤需急诊外科手术干预甚至死亡的病人,因此将损伤控制单独阐述。
PCD常用的影像学引导方法包括超声、CT等,因CT引导受仪器及场地等限制,超声仍是多数中心行PCD时首选的引导方法。胰腺炎病人往往合并胃肠道功能障碍,肠管胀气或扩张。超声通过性较差,超声引导穿刺时易发生肠道、脾脏、肝脏、肾脏、大血管相关副损伤。尤其是胃肠道,在超声下难以确定边界,发生副损伤风险较高,且副损伤后难以形成管状瘘而自发愈合,往往需外科手术干预造瘘或修补。因此,复杂的腹腔内或腹膜后积液穿刺置管引流前,建议行胸部+全腹部+盆腔的CT检查,充分评估积液与周围脏器的关系。对于积液、感染范围复杂的病例,建议行增强CT检查,以明确积液周围界限。肠管壁往往有轻度强化,易与周围网膜、脂肪区分。行超声引导下PCD前,应详细阅读CT各断层影像,选择合适的穿刺路径。既保证操作安全,又保证后续清创时的有效路径。
复杂病例行超声引导下PCD建立通道时,除术前CT、MRI等影像学检查外,还可利用3D打印技术,于术前精准规划穿刺路径。术中可用CT影像与超声融合技术定位,明确积液区域与周围脏器的关系,以精准确定穿刺点位及进针角度,选择安全有效的穿刺路径。
四、胰液皮肤瘘的处理
约44%的重症胰腺炎病人合并主胰管损伤[23]。其行PCD引流或VAD后易出现胰液皮肤瘘。病人往往因胰漏迁延不愈,需长时间留置引流管,增加导管感染、出血、腐蚀、脱落等风险。长期不愈合的胰液皮肤瘘需内镜或手术治疗。内镜治疗分为经内镜逆行胰胆管造影 (endoscopic retrograde cholangiopancreatography,ERCP)相关手术和EUS相关手术[24]。外科手术的经典方法是胰瘘窦道与消化道吻合术。
对于中度重症及重症胰腺炎,行PCD及VAD治疗后2个月以上仍有>100 mL/d清亮胰液引流的病人存在因胰液皮肤瘘长期带管的可能性。该部分病人可行磁共振胰胆管造影 (magnetic resonance cholangiopancreatography,MRCP)[24]、窦道造影或ERCP[25]检查明确胰管离断部位。增强CT检查明确胰管离断部位的病人可直接进入下一治疗序列。检查明确胰管损伤部位后,可根据具体情况选择不同的治疗方式。破损部位靠近胰头部而远端残余胰腺组织较少时,可行十二指肠乳头小切开降低胰管内压力,部分病人可治愈。主胰管破损部位靠近胰头部而远端残余胰腺组织较多——即胰管离断综合征 (disconnected pancreatic duct syndrome,DPDS)时,治疗相对复杂,需根据病人情况个体化选择。可尝试行ERPD桥接治疗,胰管支架植入时间需超过3个月,根据复查情况明确可否拔除支架。拔除支架后复发或支架自行脱落引起PPC复发者可行EUS下支架植入,后期随访明确拔除支架时间。对于远端胰管扩张明显的胰漏,笔者有数例病人EUS经胃穿刺远端胰管置入胰管支架,形成远端胰管-胃引流,成功治愈。
对于部分胰液皮肤瘘病人,本中心也开展磁压榨胰胃吻合方式重建内引流通路。注意事项如下:①适合引流液以胰液为主、胰腺周围积液不包含坏死物质,包含坏死物质者易在吻合后继发感染。②窦道位置靠近胃壁,一般间隔≤2 cm,<1 cm效果较好。为使窦道位置合适,在前期手术操作,尤其行VAD时,应对窦道塑形,保证后续治疗路径。③需保持窦道直径1 cm左右,保证植入磁铁磁力足够压榨形成窦道与胃的引流通路。对于窦道位置合适但直径较小者,可经窦道扩张,保证植入足够磁力的磁铁。
结 语
综上,重症胰腺炎局部并发症可根据所在腹腔不同分区,以及疾病进程选择个体化的微创手术治疗方式。影像医学、消化内镜、介入医学、外科学等多学科紧密协作是微创治疗成功的重要条件。但临床上仍有少部分病情危重的病人因腹腔间隔室综合征、腹腔内大出血、消化道穿孔等行开腹清创术。

