2-甲基-2-己醇制备实验的改进与创新设计
刘广路 李婷婷 辛凯涛 赵腾雪 王春杰
(周口师范学院,河南周口,466000)
1 引言
利用Grignard试剂制备2-甲基-2-己醇是本科教学中重要的基础实验,学生在日后药物设计、药物合成常会用到这个反应,是一个化学、药学类学生必做的一个重要实验[1]。其目的是训练学生牢固掌握有机化学实验的基本技能和基础知识:(1)培养学生正确选择有机化合物的合成、分离、提纯与分析、鉴定的方法,并让学生及时掌握现代有机合成、分离和鉴定的手段,训练回流、萃取、过滤和蒸馏等技能操作;(2)通过有机实验,还要培养学生分析解决问题和独立思考、独立工作的能力[2]。
格氏试剂RMgX中,C-Mg键是共价键,极性强,这说明格氏试剂是一种很强的碱,亲核性强。因而,任何含有活泼H的化合物,如醇、酸、胺类等都可以与格氏试剂反应,所以在格氏试剂的制备过程中要严格干燥并保持无水状态。经典实验中存在的一系列问题是不能忽视的,例如:操作过程复杂、实验时间长、反应条件苛刻、实验的失败率高,这给学生增加了负担;碘作为引发剂易生成副产物,产率低;淬灭剂为硫酸,具有一定的危险性,而且极易使产物发生消除反应,产生副产物并降低产率。
有关该实验的改进已有相关文献进行了报道,主要涉及利用氮气保护来改善实验装置的气密性,工作装置复杂;采用超声辐射法合成,实验设备无法普及;利用碘甲烷做引发剂,价格昂贵不易保存[3-4]。以上改进各有缺点,不适用于本科基础教学。尝试在原有普通反应装置基础上,通过改变初始加热顺序,营造隔绝空气和水分的条件;更换合适的引发剂,缩短引发时间并且提高产率;采用合适的淬灭剂,避免因硫酸溶液而产生消除反应,提高了产率和实验的安全性。
2 实验部分
2.1 实验原理
2-甲基-2-己醇制备的原理如图1。

图1 2-甲基-2-己醇的制备原理
2.2 实验装置
2-甲基-2-己醇制备反应装置见图2。

图2 2-甲基-2-己醇制备反应装置图
2.3 实验改进
2.3.1 加热顺序
经典实验为先加入乙醚,再依次加入引发剂和混合液,此时装置中尚有空气和水分残留。本文采用先将乙醚加入,加热至微沸回流状态,排出装置的水分和空气,再依次加入混合液和引发剂,比经典实验更好地隔绝了水分和空气。
2.3.2 引发剂
经典实验为碘做引发剂,易生成副产物,产率低。本文选用碘甲烷、碘丁烷、1,2-二溴乙烷作为引发剂。原因是碘甲烷和碘丁烷的C-I键容易断裂,反应引发快;1,2-二溴乙烷中由于两个Br均为吸电子基团,C-Br键很容易断裂,副产物生成乙烯,将挥发出反应装置。
2.3.3 淬灭剂
经典实验选用10%硫酸溶液作为淬灭剂,具有一定的危险性,产物发生消除反应,产生副产物,降低产率。本研究选用饱和氯化铵溶液做淬灭剂,因为在水中电离出的铵根离子水解使溶液显酸性,常温下饱和氯化铵溶液pH值一般在5.6左右,水解中间产物时放热温和。不仅能满足实验所需要的酸性条件,而且不易使产物发生消除反应。
2.4 试剂与仪器

表1 冷低分油化验分析

表2 仪器设备
2.5 步骤与方法
2.5.1 实验准备
将实验所需仪器提前干燥,配制饱和氯化铵溶液,镁条充分打磨后剪成镁屑。
2.5.2 格氏试剂的制备
将剪好的1.5 g镁屑加入三颈烧瓶中,量取6.4 mL正溴丁烷和15 mL无水乙醚加入恒压滴液漏斗中,混匀。向三颈烧瓶中加入10 mL无水乙醚,温水浴保持三颈烧瓶中无水乙醚处于微沸状态,此时向三颈烧瓶中加入约3 mL混合液,立即自冷凝管上端滴加引发剂。
待反应平缓后自冷凝管上端加入10 mL无水乙醚,逐滴滴加混合液,开动磁力搅拌器,使溶液保持微沸状态,混合液滴加完毕后,再用温水浴加热回流20 min使镁屑反应完全。
2.5.3 2-甲基-2-己醇的制备
量取5 mL丙酮和10 mL无水乙醚加入恒压滴液漏斗,混匀,在冰水浴及搅拌下缓慢滴加混合液,控制滴加速率,使反应平稳进行,待混合液滴加完毕后,室温搅拌15 min。
反应结束后,在冰水浴及搅拌下将淬灭剂分批加入三颈烧瓶中,刚开始滴加速率较慢,滴加速率可逐渐加快,使中间产物分解完全。
2.5.4 分离和提纯
将所得溶液过滤,滤液转入分液漏斗中,静置后分出醚层。水层用12 mL无水乙醚萃取两次,合并有机相,有机相用无水碳酸钾干燥。
2.5.5 蒸馏
将干燥后的有机相滤入100 mL干燥的圆底烧瓶中,水浴蒸出乙醚,待无乙醚馏分后,再用电热套加热收集139—142 ℃馏分,称重并计算产率。
3 结果与讨论
3.1 产物表征
由图3和图4的测试结果得知,产物的相关测试与表征结果与文献吻合良好,证明本实验的改进方法正确,所得产物为目标产物。

图3 2-甲基-2-己醇的红外光谱图(IR)图
由图3得知:3370cm-1为羟基伸缩振动吸收峰,2964cm-1为甲基中C-H伸缩振动吸收峰,2933cm-1为亚甲基伸缩振动吸收峰,1378cm-1、1469cm-1甲基中C-H弯曲振动吸收峰。

图4 2-甲基-2-己醇的核磁共振氢谱(1HNMR)图
由图4得知:1H NMR (400 MHz, CDCl3) δ 1.67 (br, 1H), 1.53-1.44 (m, 2H), 1.40-1.31 (m, 4H), 1.23 (s, 6H), 0.94 (t, J = 7.1 Hz, 3H)。
3.2 初始加热顺序的改变对反应引发时间的影响
在保证引发剂的剂量和淬灭剂种类一致的前提下(碘粒用量为1粒,其他液体试剂均为200 μL),探索了初始加热顺序的改变是否会对反应引发时间产生影响。试验结果如表3所示:在依照经典方法进行反应时,碘做引发剂时反应引发最快,为55 s;碘甲烷和1,2-二溴乙烷引发速度相当,分别为95 s和100 s;碘丁烷的引发速率最慢,为630 s。改变加热顺序后,碘甲烷、1,2-二溴乙烷和碘丁烷的引发速率均有显著的提高,例如碘甲烷的引发时间缩短至15 s左右。这表明,更改加热顺序对碘甲烷、1,2-二溴乙烷和碘丁烷做引发剂是有利的;但是碘做引发剂时的引发速率却明显降低,这可能是加热状态下碘易升华,降低了反应体系中碘的浓度。

表3 初始加热顺序的改变对引发时间的影响
3.3 初始加热顺序的改变对产率的影响
在保证引发剂的剂量和淬灭剂种类一致的前提下(碘粒用量为1粒,其他液体试剂均为200 μL),探索了初始加热顺序的改变是否会对产率产生影响。试验结果如表4所示:在依照经典实验进行反应时,碘丁烷做引发剂时产率最高,为72.17%;碘甲烷和1,2-二溴乙烷次之,分别为65.21%和62.02%;碘做引发剂时产率最低,为55.07%。改变初始加热顺序后,产率均显著提高,由此证明,改变初始加热顺序对产率起到促进作用。综合考虑各引发剂的优缺点后,选用1,2-二溴乙烷为引发剂做进一步研究。
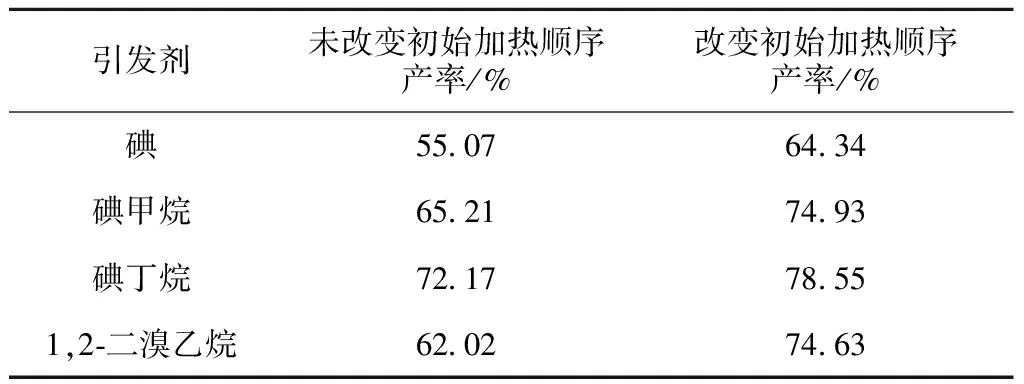
表4 改变初始加热顺序对产率的影响
3.4 改变淬灭剂对产率的影响
在引发剂为1,2-二溴乙烷,用量为200 μL的前提下,继续探索淬灭剂的改变是否对产率产生影响。实验结果如表5所示:无论是否改变初始加热顺序,使用饱和氯化铵溶液作为淬灭剂均可使产率提高10%左右。而在改变初始加热顺序,使用饱和氯化铵溶液作为淬灭剂时,则可比经典实验产率提高了20%左右。

表5 改变淬灭剂对产率的影响
3.5 1,2-二溴乙烷用量对引发时间的影响
根据表6数据分析,采用不同量的1,2-二溴乙烷做引发剂对引发时间有显著影响,但考虑到基础教学实验的原则和成本问题,推荐基础实验采用3~5滴1,2-二溴乙烷作为引发剂。
综上,引发反应时间短,产率较经典实验高,产率数值可重复性强,推荐应用于基础教学实验中。

表6 1,2-二溴乙烷的不同用量对引发时间的影响
4 结语
本研究立足于基础教学实验的条件和基础知识,以问题为导向,对现行基础实验进行了创新设计:
(1)通过改变初始加热顺序,营造隔绝空气和水分的条件。
(2)改变反应的引发剂,筛选出了效果较好的1,2-二溴乙烷做引发剂,减少副反应的发生,提高产率。
(3)淬灭剂为饱和氯化铵溶液,提高了实验的安全性和产率。
通过多次实验和一个学期基础实验教学实践,本改进方案使得基础教学实验成功率提高到100%,实验时长缩短了约30 min,产率提高了约20 %。
通过改进与创新设计,使得现有的实验教学进一步进行拓展升级,一方面,可以在教学中使学生获得成功感和自豪感,提高基础知识和实验操作技能,另一方面,在实验过程中也培养和发散了学生的科研思维,提高了学生的分析、思考和解决实际问题的能力。

