miR-30b-5p 抑制Notch信号通路活化对实验性自身免疫性葡萄膜炎的治疗作用△
殷学伟 郭励劼 周梦贤 屈如意 毕宏生 郭大东
葡萄膜炎是眼科常见的一类可复发的严重危害视觉健康的自身免疫性疾病,多采用激素和免疫抑制剂治疗,副作用较大。因此,深入探讨葡萄膜炎的发病机制、发现新的治疗靶点对临床治疗具有重要意义。MicroRNA(miRNA)是在基因转录后水平调控靶基因表达的一类功能性小分子RNA。Notch 信号通路是调节自身免疫性疾病和炎症反应的重要通路[1]。miRNA的表达异常与葡萄膜炎的发病进程关系密切。研究发现,在急性前葡萄膜炎患者的外周血中,miR-146a、miR-143、miR-205和 miR-9-3表达水平均显著降低,而miR-301a和miR-23a的表达水平明显升高,这证实miRNA在葡萄膜炎发病过程中发挥重要的作用[2];而miR-155可通过靶向作用于Ets-1基因调控Th17细胞的免疫应答,抑制miR-155可减少致病性Th17细胞的数量,从而减轻葡萄膜炎患者的发病程度[3];我们的前期研究发现,miRNAs的差异表达可能与葡萄膜炎的发病机制密切相关[4-8]。本研究拟以实验性自身免疫性葡萄膜炎(EAU)大鼠为模型,探讨miR-30b-5p调控Notch信号通路在葡萄膜炎发病中的作用机制,为建立以 miRNA 为作用靶点的新型治疗方法提供思路。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器光感受器间维生素A结合蛋白(IRBP)(上海生工公司);结核分枝杆菌(TB)(Difco公司,美国);完全弗式佐剂(CFA)(Sigma公司,美国);LV-rno-mir-30b(16507-1)病毒,阴性对照病毒CON238(上海吉凯基因);RNA提取试剂盒(北京Aidlab公司);逆转录试剂盒、qRT-PCR试剂盒(QIAGEN 公司,德国);兔抗DLL4多克隆抗体(北京博奥森公司),兔抗Notch1多克隆抗体(北京博奥森公司),免疫组化SP试剂盒(北京博奥森公司);封闭用山羊血清(Solarbio,SL038);苏木素(Thermo公司,美国);免疫组化笔(福州迈新公司);LightCycler 480 qRT-PCR仪(Roche公司,美国);全自动封片仪(Thermo公司,美国);Revolve正置/倒置荧光显微镜(Echo公司,美国)。
1.1.2 实验动物及分组处理健康雌性Lewis大鼠32只(购自北京维通利华实验动物技术有限公司),6~8周龄,160~180 g,随机分为对照组、EAU组、miR-30b-5p组及miR-30b-5p空载体(miR-30b-5p-N)组,每组各8只。对EAU组、miR-30b-5p组及miR-30b-5p-N组大鼠的腹壁两侧、后肢两足垫以及躯干上皮下各点分别注射200 μL含IRBP、TB、CFA和无菌PBS的乳糜液以诱导EAU模型,对照组大鼠于相同位置注射等体积的TB和CFA的乳糜液。在免疫后立即将携带miR-30b-5p的慢病毒和携带miR-30b-5p空载体的慢病毒分别相应注射于miR-30b-5p组和miR-30b-5p-N组的EAU大鼠脾脏(每只注射病毒量均为5×107TU),进行干预治疗处理。动物的使用均符合《实验动物管理条例》。
1.2 生物信息学预测分析通过Target Scan(http://www.targetscan.org/)对Notch1和Dll4基因与 miR-30b 的关系进行生物信息学预测,分析 miR-30b-5p 对 Notch 信号通路相关分子表达的调控作用。
1.3 qRT-PCR检测各组大鼠脾脏、淋巴结及眼组织中Notch1和Dll4 mRNA的表达变化免疫后12 d,分别取4组大鼠的脾脏、淋巴结和眼组织,提取RNA后进行反转录,引物序列为:GAPDH上游引物为5’-CACGGCAAGTTCAACGGCACAGT-3’,下游引物为5’-AGCGGAAGGGGCGGAGATGAT-3’,分子长度为222 bp;Notch1上游引物为5’-ATGGCCCCACCTGCAGACAAGATG-3’,下游引物为5’-GGCACGGCAGGCACAGCGATAG-3’,分子长度为113 bp;DLL4上游引物为5’-CAAGAATAGCGGCAGTGGTCGTAA-3’,下游引物为5’-GTAGCGCAGTCTTGTGAGGGTGTT-3’,分子长度为229 bp。反应体系为每孔20 μL,反应条件为:95 ℃、5 min,反应循环1次;95 ℃、20 s,57 ℃、25 s,60 ℃、25 s,循环45次。qRT-PCR程序完成后,按 2-ΔΔCt计算Notch1和Dll4 mRNA的表达水平。
1.4 免疫组织化学检测免疫后12 d,取各组大鼠相同部位的脾脏、淋巴结和眼组织进行切片,切片厚度约为10 μm。将切片置于室温环境10~15 min后用冰乙酸固定10~20 min。每个切片经PBS冲洗后均滴1.67 mol·L-1H2O2,置于室温环境10 min。各切片经PBS冲洗后一抗(Notch1 1400,Dll4 1500)4 ℃ 孵育过夜。将切片转入室温环境复温30 min。各个切片经PBS冲洗后,采用HRP标记的二抗(1200)孵育于室温中静置20 min。显微镜下观察DAB染色效果后用自来水冲洗以终止染色。苏木素染色后用自来水冲洗1 min。每张切片均滴10 g·L-1盐酸酒精,用清水冲洗1 min。碳酸锂饱和溶液1 min,用清水冲洗1 min。用梯度酒精脱水2 min。 二甲苯透明5 min。采用中性树胶封存,封存后于显微镜下观察。
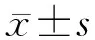
2 结果
2.1 生物信息学预测分析结果生物信息学预测分析结果表明,Notch 信号通路上 Notch1和Dll4基因均为 miR-30b 调控的靶基因,提示Notch1和Dll4在葡萄膜炎的发生发展过程中发挥了重要作用。因此,深入研究 miR-30b-5p 调控 Notch 信号通路相关分子表达的作用机制,对于阐释葡萄膜炎发生发展的病理机制具有重要意义。
2.2 大鼠脾脏、淋巴结及眼组织中Notch1和Dll4 mRNA的表达变化qRT-PCR检测显示,免疫后12 d,相比于对照组,EAU组、miR-30b-5p组和miR-30b-5p-N组大鼠脾脏、淋巴结和眼组织中Notch1和Dll4 mRNA水平均明显升高(均为P<0.05);与EAU组大鼠相比,经miR-30b-5p干预后,miR-30b-5p组大鼠脾脏、淋巴结和眼组织中Notch1和Dll4 mRNA水平均显著降低(均为P<0.05)。然而,miR-30b-5p-N组大鼠各组织中Notch1和Dll4 mRNA表达水平与EAU组相比差异均无统计学意义(均为P>0.05)(表1)。

表1 各组大鼠脾脏、淋巴结和眼组织中Notch1和Dll4 mRNA的相对表达水平
2.3 大鼠脾脏、淋巴结和眼组织中的Notch1和Dll4蛋白表达水平免疫组织化学检测结果发现,免疫后12 d,miR-30b-5p组大鼠脾脏、淋巴结和眼组织中Notch1和Dll4蛋白的表达均弱于EAU组,差异均有统计学意义(均为P<0.05),而miR-30b-5p-N组大鼠脾脏、淋巴结和眼组织中Notch1和Dll4蛋白的表达与EAU组相比差异均无统计学意义(均为P>0.05)(图1,图2)。
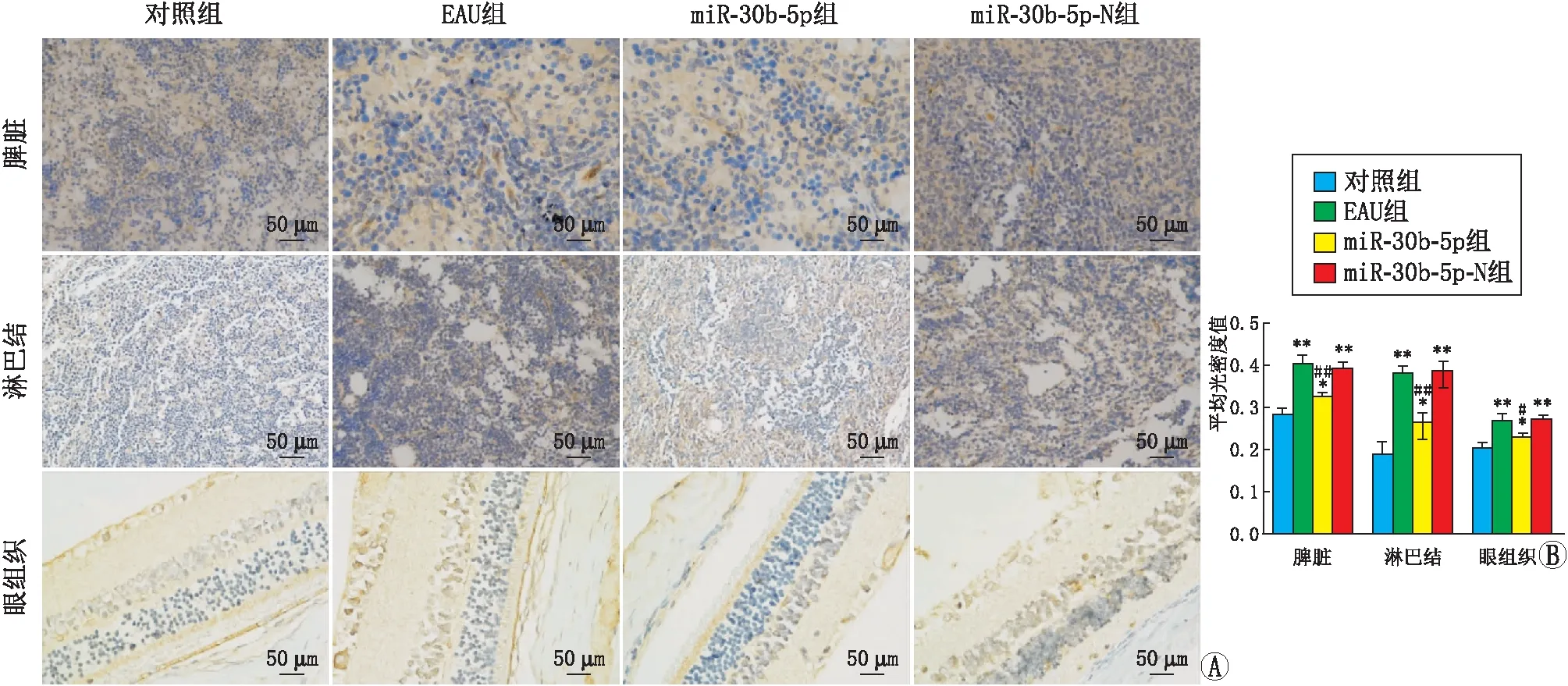
A:对照组、EAU组、miR-30b-5p组和miR-30b-5p-N组大鼠脾脏、淋巴结和眼组织中Notch1蛋白表达情况。B:平均光密度值分析的直方图,与对照组比较,*P<0.05,**P<0.01;与EAU组比较,#P<0.05, ##P<0.01。图1 免疫组织化学检测各组大鼠脾脏、淋巴结和眼组织中Notch1蛋白表达
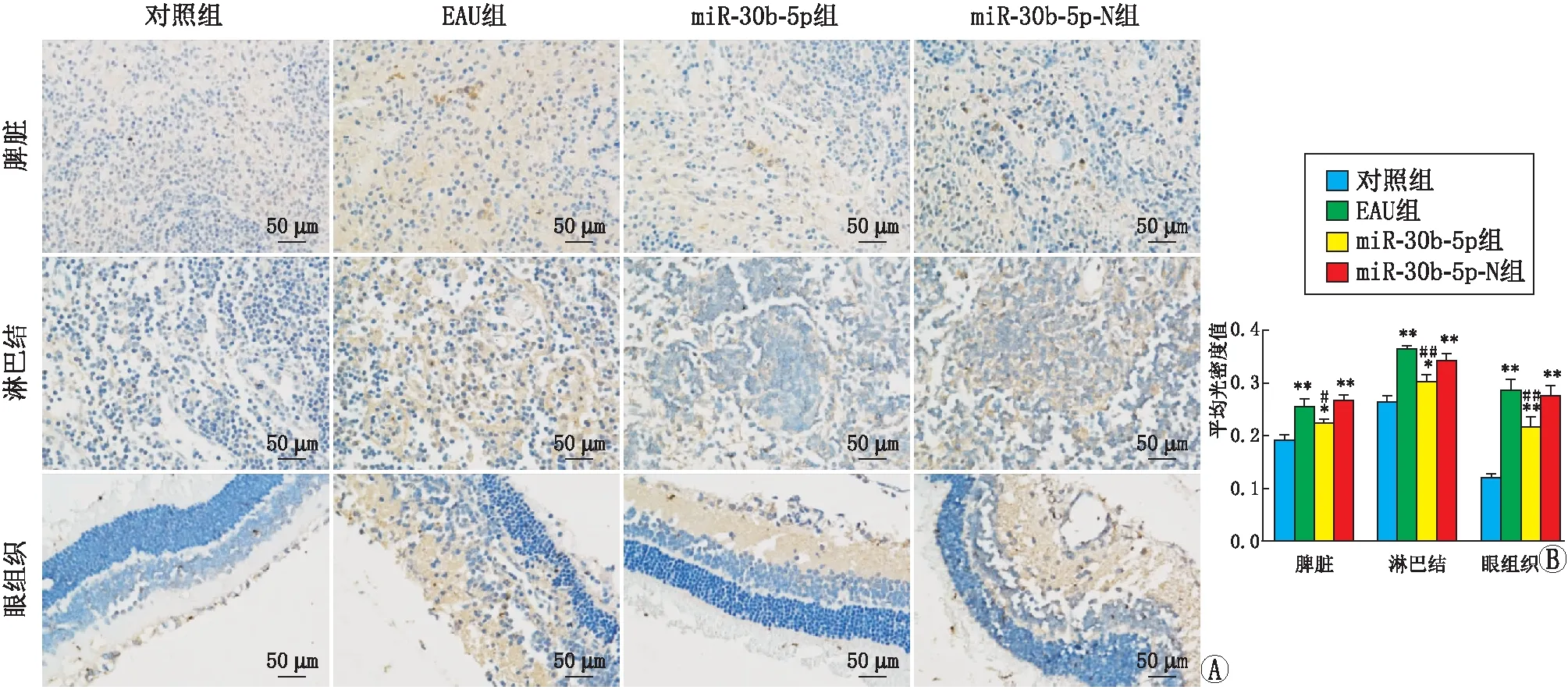
A:对照组、EAU组、miR-30b-5p组和miR-30b-5p-N组大鼠脾脏、淋巴结和眼组织中Dll4蛋白表达情况。B:平均光密度值分析的直方图,与对照组比较,*P<0.05,**P<0.01;与EAU组比较,#P<0.05,##P<0.01。图2 免疫组织化学检测各组大鼠脾脏、淋巴结和眼组织中Dll4蛋白表达
3 讨论
葡萄膜炎是严重危害人类健康的一类自身免疫性眼病,多发于青壮年。Notch信号通路是维持机体免疫平衡的重要信号通路,可通过调节相关细胞因子的表达进而诱导细胞的分化[9]。研究显示,Notch信号通路经Notch信号通路抑制剂DAPT阻断后,通路中Jagged-1信号分子可显著降低CD4+T细胞中ROR-γt的表达,并下调与Th17相关的炎性细胞因子IL-17A、IL-17F、IL-23a和IL-12rb1的表达水平[10];Notch信号通路阻断剂可明显抑制葡萄膜炎小鼠的发病进程[11-12]。临床研究结果显示,在活动性白塞氏病患者中阻断Notch信号通路可抑制Notch信号分子的激活[13]。我们前期的研究结果也显示,EAU大鼠淋巴结、脾脏和眼组织中的T淋巴细胞经Notch信号抑制剂DAPT体外干预后,Notch1、DLL4、IL-17、ROR-γt的表达水平明显下降,表明葡萄膜炎的发病机制伴随着Notch1、DLL4、IL-10、IL-17、ROR-γt和Foxp3的表达升高,以及CD4+/CD8+和Th17/Treg比例失衡。DAPT抑制Notch信号可有效下调Notch1、DLL4、IL-17的表达和ROR-γt的转录,降低Th17水平,恢复CD4+/CD8+、Th17/Treg平衡[14]。在本研究中,免疫后12 d,相比于对照组,EAU组大鼠各组织中Notch1和Dll4 mRNA以及蛋白水平均升高(均为P<0.05),在EAU中伴随着Notch信号通路相关分子的高表达,提示Notch信号通路的活化在葡萄膜炎的发生发展中发挥作用。此外,有研究显示,抗Dll4抗体治疗可显著降低EAU在诱导期和应答期症状的严重程度,提示Dll4介导的Notch信号通路在EAU中发挥重要作用[15]。这与本研究结果一致,提示Notch 信号通路相关分子在葡萄膜炎的发病过程中具有重要作用。 抑制Notch信号可改善EAU的炎症反应,这可能为葡萄膜炎患者提供潜在的免疫治疗策略。
miRNA是一类可调控靶基因表达的功能性小分子RNA,miRNA的表达异常可能与葡萄膜炎的发病机制密切相关。Jadideslam等[16]发现,白塞氏病患者中miR-21、miR-146b的表达明显降低,miR-326的表达升高。miR-223-3p可通过抑制转录因子FOXO3的表达促进EAU中Th17细胞的自身反应[17]。Meira-Strejevitch等[18]研究表明,眼弓形体病引起的后葡萄膜炎患者中miR-155-5p和miR-29c-3p的表达均升高,而miR-21-5p和miR-125b-5p均呈下调表达。我们的前期研究发现 ,EAU大鼠的外周血淋巴细胞中的miRNA中,36条呈上调表达,31条呈下调表达[19];后续研究显示,在EAU大鼠脾脏和淋巴结中,miR-30b-5p调控Atg5、Atg12和Becn1自噬基因的表达,miR-30b-5p可通过影响自噬通路进而影响葡萄膜炎的发生发展[5],同时,我们前期研究也证明miR-30b-5p也可以通过调节IL-10和TLR4阳性细胞的水平来影响葡萄膜炎的发生,进而影响葡萄膜炎的发展[7]。
本研究成功建立了EAU大鼠模型,并且成功将携带miR-30b-5p慢病毒的EAU大鼠进行体内脾脏注射治疗,干预治疗后,各组大鼠脾脏、淋巴结和眼组织中的Notch1和Dll4的基因与蛋白水平变化结果基本一致。结果显示,免疫后12 d,相比于对照组,EAU组、miR-30b-5p组和miR-30b-5p-N组大鼠脾脏、淋巴结和眼组织中Notch1和Dll4 mRNA水平均明显升高,提示在葡萄膜炎的发病过程中存在着Notch信号通路的激活;经miR-30b-5p干预后,miR-30b-5p组大鼠脾脏、淋巴结和眼组织中Notch1和Dll4 mRNA水平均显著降低。然而,miR-30b-5p-N组大鼠各组织中Notch1和Dll4基因水平与EAU组相比差异无统计学意义,提示miR-30b-5p可抑制葡萄膜炎发病过程中Notch信号通路的激活,进而发挥治疗葡萄膜炎的作用。免疫组织化学检测蛋白水平结果趋势与qRT-PCR检测基因水平结果基本一致,即免疫后第12 d,相比于EAU组,miR-30b-5p组大鼠脾脏、淋巴结和眼组织中的Notch1和Dll4蛋白表达水平明显下调;而miR-30b-5p-N组大鼠脾脏、淋巴结和眼组织中的Notch1和Dll4蛋白表达水平与EAU组相比差异均无统计学意义,结果进一步表明,miR-30b-5p慢病毒可明显降低Notch信号通路相关分子的表达。当然,本研究结果是建立在采用携带miR-30b-5p的慢病毒通过脾脏注射EAU大鼠进行治疗的基础上,还无法应用于临床,下一步我们拟通过采用携带miR-30b-5p的慢病毒通过玻璃体内注射治疗EAU大鼠,进一步客观地评价miR-30b-5p对葡萄膜炎的治疗作用,为临床应用提供依据。
综上所述,本研究初步揭示了EAU的发病机制与Notch信号通路的活化有关,Notch信号通路的激活伴随着Notch1和Dll4水平的升高,miR-30b-5p 可有效降低Notch信号通路相关分子Notch1和Dll4的高表达,抑制Notch信号通路的激活,减轻EAU的免疫炎症状态。通过携带miR-30b-5p的慢病毒感染技术可显著抑制Notch信号通路的活化,平衡葡萄膜炎的免疫状态,减轻EAU的发病程度,为临床应用miRNAs治疗葡萄膜炎等免疫性疾病提供了一定的研究基础和理论依据。

