GhCDPK4 基因的克隆和功能分析
侯梦娟朱新霞孔 辉史光珍
(石河子大学 生命科学学院,绿洲城镇与山盆系统生态兵团重点实验室,新疆 石河子 832003)
钙依赖性蛋白激酶(Calcium-dependent protein kinase,CDPK)是已知的钙离子敏感蛋白,是植物中较大、分化程度较高的基因家族之一。CDPK 蛋白结构域由四部分组成,分别是高度可变的N 端结构域、高度保守起催化作用的丝氨酸/苏氨酸激酶结构域、一个抑制蛋白自身活性的自抑制结构域和C端有EF 手型结构的类钙调素结构域(Ca M-LD)。正常情况下,CDPK 的自抑制区与丝氨酸/苏氨酸激酶结构域的C-球形结构的催化位点结合,维持CDPKs 处于稳态。当植物受到外界干旱、盐害或不适温度刺激时,细胞内Ca2+浓度会瞬时升高,CDPK 可感知此信号,C端Ca M-LD 的EF手型结构就与Ca2+结合,从而解除抑制,使CDPK 发挥激酶活性,将感受到的Ca2+信号向下游传递和级联放大,引发相关基因的表达,改变植物细胞的生理生化过程,提高植物对不良环境的耐受性[1-2]。
CDPKs在植物中多以基因家族形式存在,数量较多,广泛分布在植物器官、组织、细胞和亚细胞中,积极参与植物的生长发育和抗逆过程。如拟南芥AtCPK17和AtCPK34过量表达导致花粉管去极化生长[3],过表达AtCPK4或AtCPK11基因能促进拟南芥种子发芽和幼苗生长,提高植株的耐旱能力[4],过表达AtCPK6、AtCPK8和AtCPK10可以显著提高植株的耐旱能力[5-7],过表达AtCPK23的植株对干旱和盐胁迫很敏感[8],AtCPK21突变体对高渗胁迫有较强的耐性[9],过表达水稻OsCPK9可以提高植株的耐旱能力[10],过表达OsCPK12可以提高植株的耐盐能力[11],玉米ZmCPK14负向参与非生物胁迫[12]。说明CDPKs在植物响应非生物胁迫过程中,既可以正向参与,也可能负向参与,CDPKs的功能可能相同,也可能不同。
棉花是重要的经济和油料作物,也是纺织工业的主要原料。中国是棉花的主产区之一,新疆为典型的干旱、半干旱气候特征,雨量少,干旱、盐碱化土地面积大,发掘棉花干旱、盐碱相关Gh-CDPKs基因,探究其在非生物逆境中所起的作用,对阐明棉花抵御非生物逆境的机制,提高棉花抗逆性意义重大。目前虽已从陆地棉基因组中鉴定出CDPKs家族基因,众多的棉花CDPKs基因家族成员,在根、茎、叶、花瓣、雄蕊、雌蕊以及不同发育阶段的胚珠和纤维等不同组织中都有表达,说明它们功能可能呈现多样化[13],而对单个CDPK基因的具体功能研究鲜有报道[14-15]。在陆地棉基因组数据[16]中发现棉花GhCDPK4基因响应干旱、盐胁迫的诱导。为了探究GhCDPK4基因的功能,本研究以棉花品种‘新陆早42’为材料,克隆得到属于CDPK 家族的基因GhCDPK4,通过基因重组技术,构建GhCDPK4基因的过表达载体并转化模式植物烟草,分析转基因植株在干旱和盐胁迫处理下的表型、抗氧化酶活性和细胞膜稳定性变化,为进一步研究GhCDPK4基因的功能和提高棉花的抗逆性提供候选靶基因。
1 材料与方法
1.1 材料
陆地棉‘新陆早42’(Gossypium hirsutumL.CV.Xinluzao 42)种子由新疆石河子农业科学研究院棉花研究所提供。野生型(wild type,WT)烟草(NicotianatabacumL.)‘NC89’、大肠杆菌(Esherichia coli)DH5α、根癌农杆菌(Agrobacteriumtumefaciens)和植物表达载体pCAMBIA2300均由石河子大学绿洲城镇与山盆系统生态兵团重点实验室保存。
1.2 方法
1.2.1GhCDPK4基因的克隆和序列分析 参照天根生物科技有限公司RNA 提取试剂盒说明书提取样品的RNA,采用Ta Kara公司cDNA 合成试剂盒合成cDNA。利用Primer Premier 5.0软件设计分别带有KpnⅠ和PstⅠ酶切位点的特异性引物GhCDPK4-KpnⅠF和GhCDPK4-PstⅠR(序列见表1)。以棉花cDNA 为模板进行PCR 扩 增,反 应 体 系(20 μL)为Mix 10 μL、dd H2O 8μL、模板1μL、引物1μL。PCR 程序为94 ℃预 变 性5 min;94 ℃变 性1 min,55 ℃退 火30 s,72 ℃延伸1 min 30 s,35个循环;72 ℃延伸8 min。PCR 产物通过琼脂糖凝胶电泳鉴定后回收与p MD-19T 克隆载体连接,连接产物转化大肠杆菌DH5α感受态细胞,经过PCR 及质粒双酶切筛选鉴定的阳性克隆,送上海生工生物工程有限公司进行测序。最后,利用在线网站http://smart.embl-heidelberg.de对GhCDPK4基因所编码的蛋白进行蛋白结构域分析。
1.2.2GhCDPK4基因过表达载体的构建 将测序验证正确的转p MD-19T-GhCDPK4质粒与转pCAMBIA2300质粒的大肠杆菌株系扩大培养,抽提质粒,分别用PstⅠ和KpnⅠ双酶切,酶切回收纯化后,用T4DNA 连接酶进行过夜连接,连接产物转化感受态细胞,37 ℃过夜培养后,在Kan(50μg/m L)抗性平板上挑取单菌落,进行菌落PCR 检测,然后阳性菌落扩大培养后,提取重组质粒,用PstⅠ和KpnⅠ进行双酶切鉴定,鉴定为阳性的重组质粒命名为pCAMBIA2300-Gh-CDPK4。
1.2.3 烟草的转化及转基因鉴定 采用电穿孔转化法将p CAMBIA2300-GhCDPK4植物过表达载体转入农杆菌GV3101感受态细胞中,叶盘法转化烟草‘NC89’,用卡那霉素进行筛选,分化出丛生芽后,移入生根培养基中培养,半月后移栽入营养土和蛭石体积比为3∶1的塑料花盆中,待幼苗长至3~4片叶片时,用植物基因组DNA 提取试剂盒,提取烟草基因组DNA,进行PCR检测。
1.2.4 基因表达量分析 提取野生型和转基因烟草叶片的总RNA 反转录为cDNA,以Actin为内参基因,利用在线网站GenScript(https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool#)设计GhCDPK4荧光定量PCR 的特异引物(表1)。实时荧光定量PCR 参照带有ROX 的Platinum SYBR Green qPCR Super Mix-UDG 试剂盒说明书进行,采用2-ΔΔCT方法对数据进行分析[18]。

表1 本试验所用引物Table 1 Primers used in this study
1.2.5 转基因烟草胁迫处理及生理指标测定选取鉴定成功并且长势相近的转基因烟草,以野生型烟草为对照,分别进行(1)自然干旱处理18 d;(2)浇灌300 mmol/L 浓度的NaCl溶液,间隔4 d灌一次,共处理20 d。每个处理设置3个生物学重复。干旱和盐胁迫处理后,观察表型并采样,分别测定过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)活性、丙二醛(MDA)质量和相对电导率,采用Jungklang等[17]方法测定相对电导率、CAT、SOD 和POD,采用Du等[18]方法测定丙二醛(MDA)含量,每个指标重复测3次。
2 结果与分析
2.1 GhCDPK4 基因的获得和蛋白结构预测
利用所设计的引物在大约1 500 bp处扩增出清晰明亮的条带,片段长度与在http://ibi.zju.edu.cn/cotton/网站录入GhCDPK4基因蛋白编码序列(CDS)一致(图1),测序结果经比对与GhCDPK4基因CDS序列碱基一致,该基因共编码511个氨基酸。对其编码的蛋白质结构域进行预测,发现该蛋白含有1个丝氨酸/苏氨酸蛋白激酶结构和4个EF-hand(图2),是典型的植物CDPK 蛋白。根据其在陆地棉染色体的排布,将目的基因命名为GhCDPK4。
图1 PCR 产物电泳图Fig.1 Products of PCR amplification
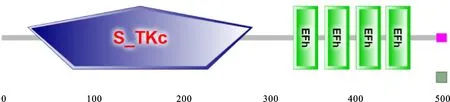
图2 GhCDPK4蛋白结构Fig.2 Structure of GhCDPK4 protein
2.2 GhCDPK4 过表达载体的构建
植物过表达载体pCAMBI2300-GhCDPK4载体T-DNA 区构建如图3-A。用基因重组技术将p MD-19T-GhCDPK4的GhCDPK4基因片段插入到pCAMBIA2300 载体上,分别进行PCR扩增鉴定(图3-B)与PstⅠ和KpnⅠ双酶切验证(图3-C),发现目的基因GhCDPK4已成功整合到pCAMBIA2300载体上,表明植物过表达载体构建成功。
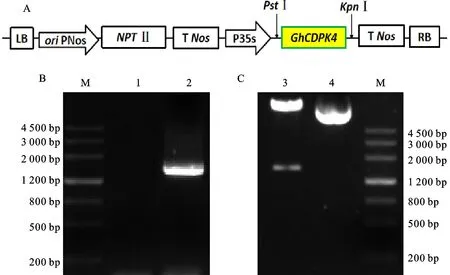
图3 GhCDPK4 过表达载体的构建和验证Fig.3 Construction and verification of GhCDPK4 overexpression vector
2.3 转基因烟草的获得
提取转基因烟草的基因组DNA,利用Gh-CDPK4基因特异性引物进行PCR 鉴定(图4-A),鉴定出15株转基因烟草。对转基因烟草进行基因表达量分析(图4-B),结果显示在转基因烟草叶片中GhCDPK4基因呈现高水平表达,说明GhCDPK4基因在烟草中成功表达。

图4 过表达GhCDPK4 基因烟草株系的获得Fig.4 Acquisition of tobacco lines over expressing GhCDPK4 gene
2.4 逆境胁迫后表型变化
野生型烟草与转基因烟草在未进行干旱和盐处理时,长势差异不大(图5-A 和5-C)。自然干旱胁迫处理后,野生型烟草老叶干枯发黄,叶片萎蔫严重,过表达GhCDPK4基因烟草植株叶片发黄,萎蔫较轻(图5-B);在NaCl溶液胁迫处理后,野生型烟草老叶干枯发黄脱落,过表达GhCDPK4基因烟草植株叶片发黄,萎蔫较轻(图5-D)。表明过表达GhCDPK4基因烟草对干旱和盐胁迫的耐受性升高。

图5 野生型与过表达基因烟草表型Fig.5 Phenotype of wild-type and overexpressed gene tobacco
2.5 逆境胁迫后生理指标检测
逆境胁迫通常会产生活性氧(ROS),引起氧化损伤。为了应对ROS的过量积累,植物通常会产生各种抗氧化酶,主要包括SOD、POD 和CAT。这些酶在清除活性氧和平衡细胞活性氧水平方面起着重要作用。丙二醛(MDA)是ROS引起的脂质过氧化产物,它与相对电导率一起可以反映质膜的受损伤程度。因此笔者测定了3种抗氧化酶的活性和相对电导率以及MDA 的含量。结果如图6所示,在正常生长条件下,野生型烟草与过表达GhCDPK4基因烟草的相对电导率、CAT、SOD、POD 的活性及MDA 含量没有显著性的差异。干旱处理后,与野生型烟草相比,过表达GhCDPK4基因烟草的相对电导率和MDA含量显著降低,分别降低1.21 倍和1.20 倍,CAT、SOD 和POD 活性显著升高,分别是野生型烟草的1.40倍、1.63倍和1.50倍。NaCl溶液处理后,与野生型烟草相比,过表达GhCDPK4基因烟草的相对电导率显著降低,降低1.39倍。SOD 和CAT 活性显著升高,是野生型烟草的1.54倍和1.38倍。POD 活性升高但不显著,而MDA 含量没有显著差异。
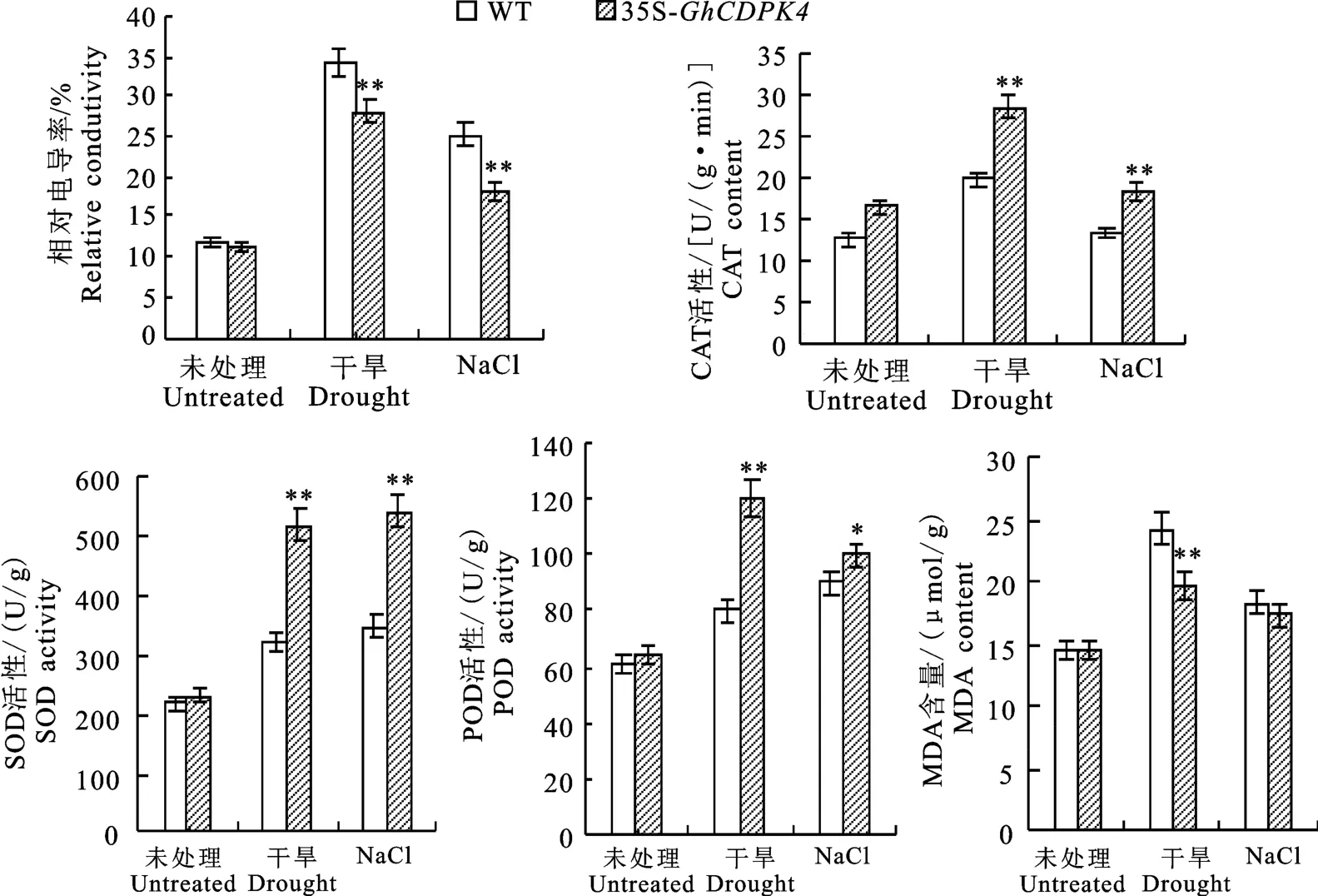
图6 野生型与过表达GhCDPK4 基因烟草的生理指标Fig.6 Physiological indicators of wild-type and overexpressed GhCDPK4 gene in tobacco
3 讨论
Ca2+作为常见的第二信使,在植物响应外界刺激中起着关键作用。干旱、盐碱等刺激会导致细胞质内Ca2+浓度发生变化,CDPK 因具有独立的激酶结构域和类似于钙调素的钙离子结合域,可以直接感知和结合Ca2+,并能把Ca2+信号在细胞内放大和传递,进一步调控下游相关基因的转录表达,启动相应的生理生化代谢过程,减轻或避免胁迫对植物造成伤害[19]。
氧化损伤或活性氧(ROS)稳态的调节已经成为CDPKs保护植物免受胁迫的另一种机制。在水稻中,OsCPK12通过调节ROS的稳态来增强对盐胁迫的耐受性[20]。此外,OsCPK10 蛋白在水稻植株中的组成性表达通过调控过氧化氢酶蛋白的积累,增强过氧化氢的解毒作用。这种活性导致脂质过氧化的下降,从而保护细胞膜的完整性和耐旱性[21]。过表达OsCPK4的水稻植株表现出更强的保水能力,减少了膜脂过氧化和电解质渗漏,从而产生了耐旱和耐盐性[22]。在生姜中,盐胁迫、干旱和茉莉酸处理可快速诱导ZoCDPK1的表达。ZoCDPK1基因在烟草中的过表达导致种子发芽率、相对含水量、胁迫响应基因的表达及叶片叶绿素含量和光合效率高于野生型对照[23]。
本研究中,在干旱和盐胁迫下,过表达Gh-CDPK4基因 烟 草 的SOD、CAT 和POD 活 性 显著升高,相对电导率显著降低,生长状况也比野生型好,说明GhCDPK4基因可通过调节CAT、SOD 和POD 的积累,较好地促进植物及时清除体内产生的活性氧,提高植物对超氧化物的解毒能力,保护细胞膜的完整性,减轻干旱、盐胁迫对植物体造成损伤。干旱处理后,过表达GhCDPK4基因烟草的MDA 含量显著降低,而盐处理后,过表达GhCDPK4基因烟草与野生型烟草MDA 含量差异不显著,说明此试验中干旱处理可能对细胞膜的损伤程度更大些,GhCDPK4基因能显著降低干旱对膜的损伤,推测GhCDPK4基因在干旱胁迫中所起的作用可能比在盐胁迫中所起作用更大些。
提高植物抗逆性对农业生产和环境的可持续性发展至关重要。植物在自然条件下遭受的非生物胁迫往往不只一种,有时是多种非生物胁迫叠加,同时非生物胁迫还和生物胁迫相互关联,植物胁迫应答还和生长发育、激素信号等有关,这就使得植物的抗逆机制研究不再单一,还要考虑多个信号、多种机制交错调控。棉花CDPKs家族基因成员众多,除了GhCDPK8、GhCDPK38、Gh-CDPK54、GhCDPK55、GhCDPK1、GhCDPK32和GhCDPK4基因被证明参与盐或(和)干旱响应应答外,其他CDPKs基因是否参与和如何参与都需要进一步研究证明,而有关GhCDPK4如何调控干旱和盐胁迫下游相关基因的表达,对胁迫植物新陈代谢、生长发育的影响及与其他信号途径的交联都有待进一步研究。
4 结论
本研究从陆地棉中克隆得到属于CDPK 家族的基因GhCDPK4,过表达GhCDPK4基因可通过调节抗氧化系统酶CAT、SOD 和POD 的积累,显著提高植物对干旱、盐胁迫的适应性。

