BMP-2/bFGF双基因转染的骨髓间充质干细胞复合生物陶瓷骨促进兔桡骨缺损修复
韩操,张丽娜,颜南,王正东
(沈阳医学院 1.附属中心医院手外科,沈阳 110024;2.附属中心医院重症医学科,沈阳 110024;3.医学应用技术学院康复教研室,沈阳 110034;4.基础医学院解剖教研室,沈阳 110034)
骨缺损是指由于外伤或手术造成的部分骨质损伤或缺失,需要植骨等介入技术进行修复的严重疾病。骨缺损可导致骨不连、患肢功能恢复差,甚至截肢[1],因此急需研发骨缺损的修复方法。双相陶瓷样生物骨(biphasic ceramic-like biologic bone,BCBB)可修复动物桡骨缺损,有良好的生物相容性和骨传导能力,是具有巨大潜力的异质骨源性材料[2]。骨髓间充质干细胞(bone marrow stem cell,BMSC)具有自我更新能力和多项分化潜能,能在不同条件下分化为成骨细胞、成软骨细胞、脂肪细胞和成肌细胞等,是骨组织工程的理想种子细胞[3]。BMSC的分化进程受多种细胞因子调控,骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)是一种重要的骨诱导因子,可诱导BMSC成骨分化[4]。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是成纤维细胞生长因子家族的基本成员,可促进BMSC的迁移、增殖和分化[5]。但是,目前关于BMP-2和bFGF转染的BMSC对骨修复能力影响的研究较少。促红细胞生成素产生肝细胞(erythropoietin-producing hepatocyte,Eph)配体ephrin-B2是由破骨细胞表达的一种跨膜配体,与和它结合的酪氨酸激酶受体Eph受体B4(EphB4)共同控制骨稳态。EphB4和ephrin-B2的相互作用产生双向信号,影响表达EphB4的成骨细胞和表达ephrin-B2的破骨细胞,导致成骨细胞的形成增强,破骨细胞的形成受到抑制,共同导致骨形成。但EphB4/ephrin-B2的调控机制尚不清楚,BCBB是否通过EphB4/ephrin-B2信号通路参与挠骨修复未见报道。
本研究将双表达BMP-2/bFGF的慢病毒转染兔BMSC后,将该细胞复合到陶瓷骨中,植入骨缺损兔体内,探讨动物模型中BMP-2/bFGF双基因转染的BMSC复合生物陶瓷骨对骨缺损的治疗作用,以及该作用与EphB4/ephrin-B2信号通路的关系,为临床骨缺损的治疗提供新的实验依据。
1 材料与方法
1.1 兔BMSC的分离培养
4月龄雌性新西兰白兔购自北京维通利华公司,腹腔注射2%戊巴比妥钠(30 mg/kg)麻醉。切开腿部皮肤和肌肉层,取出股骨,去除软组织,剪断股骨,暴露髓腔。用含1%青链霉素的PBS冲洗,再用洗脱液洗脱,200目滤网过滤,500g离心10 min。去掉上清,加入DMEM培养基和等体积Percoll细胞分离液(北京索莱宝公司),重悬细胞,1 000g离心30 min。将细胞分离液液面中的细胞吸出,用含10%胎牛血清的DMEM培养基(美国Gibco公司)在37 ℃、5%CO2的恒温培养箱中培养,通过免疫荧光检测细胞CD44和CD34阳性率对细胞进行鉴定。
1.2 细胞转染
取上述培养、鉴定后的兔BMSC,用胰酶消化并铺板,培养过夜后,将BMP-2/bFGF过表达的慢病毒(上海吉凯基因公司)滴加到细胞中,放入37 ℃培养箱中培养24 h;换液后继续培养,待细胞长满后,加入嘌呤霉素进行筛选,筛选后的细胞继续培养,用于后续实验。
1.3 细胞转染效率验证
通过Western blotting验证兔BMSC的BMP-2/bFGF基因转染效率。收集细胞,将RIPA裂解液(上海碧云天公司)加入细胞中,冰上孵育30 min,超声破碎仪超声,4 ℃ 12 000 r/min离心20 min,取上清,BCA试剂盒(上海碧云天公司)检测蛋白浓度,加入蛋白缓冲液(上海碧云天公司),煮样5 min,上样于聚丙烯酰胺凝胶,电泳分离蛋白,将蛋白转移到PVDF膜上;5%脱脂奶粉封闭;BMP-2(1∶1 000稀释)和bFGF(1∶1 000稀释)抗体(美国Abcam公司)4 ℃孵育过夜,PBST洗膜,山羊抗兔二抗(1∶5 000稀释,美国Invitrogen公司)室温孵育1 h,PBST洗膜,ECL试剂盒(上海碧云天公司)进行化学发光,并使用Image J进行灰度分析。
1.4 动物分组和取材
将50只4月龄新西兰白兔随机分为对照组(Control组)、模型组(Model组)、生物陶瓷骨组(BCBB组)、BMSC组(BCBB+BMSC组)和BMP-2/bFGF双 基因转染的BMSC组(BCBB+BMSC+BMP-2/bFGF组),每组10只。除Control组外,各组兔禁食12 h。免耳缘静脉注射3%戊巴比妥钠麻醉,固定于手术台,于前肢一侧桡骨中段剪毛备皮。消毒后在桡骨外侧剥离骨膜,暴露骨面,并用骨钻垂直制造缺损。Model组不植入BCBB,BCBB组植入BCBB,BCBB+BMSC组植入与未转染的BMSC复合的BCBB,BCBB+BMSC+BMP-2/bFGF组植入与BMP-2/bFGF双基因转染的BMSC复合的BCBB。逐层缝合,术后连续7 d肌肉注射青霉素。继续饲养,待造模后8周,脱颈椎法处死兔,取出缺损侧桡骨组织,部分保存于-80 ℃,另一部分固定于4%多聚甲醛中。
1.5 实时定量PCR检测
对缺损部位挠骨组织中碱性磷酸酶(alkaline phosphatase,ALP)、Runt相关转录因子2(Runt-related transcription factor-2,Runx2)、骨桥蛋白(osteopontin,OPN)和Ⅰ型胶原(collagen Ⅰ,Col Ⅰ)基因进行PCR检测,以GAPDH为内参。骨组织中加入裂解液裂解后,收集各样本于无酶EP管中,使用RNA试剂盒提取总RNA,并测定纯度。再按照PrimeScriptTMRT reagent kit说明进行反转录,获得cDNA。以稀释后的cDNA为模版,进行实时PCR。PCR反应条件:95 ℃起始变性30 s,进行40个循环,95 ℃变性5 s,60 ℃复性30 s。引物序列:ALP,F 5’-AACGTGGCCAAGAAC ATCATCA-3’,R 5’-TGTCCATCTCCAGCCGTGTC-3’;Runx2,F 5’-GCACCCAGCCCATAATAGA-3’,R 5’-T TGGAGCAAGGAGAACCC-3’;OPN,F 5’-CAAATAC CCAGATGCTGTGGC-3’,R 5’-TCCTGGCTGTCCAC ATGGTC-3’;Col Ⅰ,F 5’-AGGGCTCCAACGAGATC GAGA-3’,R 5’-AGGAAGCAGACAGGGCCA-3’;GAPDH,F 5’-CAGGGCTGCCTTCTCTTGT-3’,R 5’-T CCCGTTGATGACCAGCTTC-3’。
1.6 HE染色
将4%多聚甲醛固定的桡骨组织在15% EDTA溶液中浸泡3周,每5 d更换1次EDTA溶液。蒸馏水冲洗,梯度乙醇脱水,二甲苯透明及石蜡包埋,切成5 μm厚的切片。实验前60 ℃烘干切片4 h,二甲苯脱蜡,梯度乙醇水化,蒸馏水洗涤。苏木素染色,自来水洗涤,1 %盐酸乙醇分化,自来水冲洗,碳酸锂返蓝,流水冲洗,伊红染色。梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下观察并拍照。
1.7 免疫荧光实验
将上述石蜡切片依次放入二甲苯和梯度乙醇中脱蜡至水,EDTA缓冲液微波抗原修复,恢复至室温后,PBS洗涤3次,驴血清室温封闭30 min,Col Ⅰ、OPN抗体(1∶100稀释,英国Abcam公司)4 ℃过夜孵育,第2天PBS洗涤3次,山羊抗兔荧光二抗(1∶3 000,英国Abcam公司)室温孵育1 h,PBS洗涤3次,DAPI染色15 min,PBS洗涤3次,用抗荧光淬灭液封片,荧光显微镜下观察并拍照。
1.8 Western blotting
将RIPA裂解液(上海碧云天公司)加入骨膜组织中,冰上孵育30 min,匀浆机匀浆,后续步骤与上述转染效率验证一致,所用抗体为EphB4和ephrin-B2(1∶1 000,英国Abcam公司)。
1.9 统计学分析
采用SPSS 22.0软件对数据进行统计分析。计量资料以表示,多组间比较采用单因素方差分析和Tukey事后检验。P< 0.05为差异有统计学意义。
2 结果
2.1 兔BMSC的分离和鉴定
分离后的BMSC经免疫荧光检测,发现体外培养的兔BMSC表面CD44表达为阳性,CD34表达为阴性。见图1。

图1 兔BMSC的免疫荧光鉴定 ×100Fig.1 Identification of rabbit bone marrow mesenchymal stem cells by immunofluorescence ×100
2.2 BMP-2/bFGF双基因转染兔BMSC
慢病毒转染后的BMSC经Western blotting鉴定,发现与未转染细胞相比,转染细胞中BMP-2和bFGF蛋白表达均显著上调(P< 0.05)。见图2。
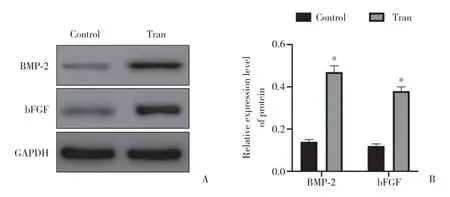
图2 Western blotting检测双基因转染兔BMSC后BMP-2和bFGF的表达Fig.2 Post transfection identification of BMP-2 and bFGF in rabbit bone marrow stem cells by Western blotting
2.3 BMP-2/bFGF双基因转染的兔BMSC复合生物陶瓷骨对桡骨Runx2、Col Ⅰ、ALP、OPN表达的影响
实时定量PCR结果显示,与Control组相比,Model组兔桡骨组织Runx2、Col Ⅰ、ALP、OPN表达水平显著降低(P< 0.05);与Model组相比,BCBB组、BCBB+BMSC组、BCBB+BMSC+BMP-2/bFGF组兔桡骨组织Runx2、Col Ⅰ、ALP、OPN表达水平显著升高(P<0.05);与BCBB组和BCBB+BMSC组相比,BCBB+BMSC+BMP-2/bFGF组兔桡骨组织Runx2、Col Ⅰ、ALP、OPN表达水平显著升高(P< 0.05)。见图3。
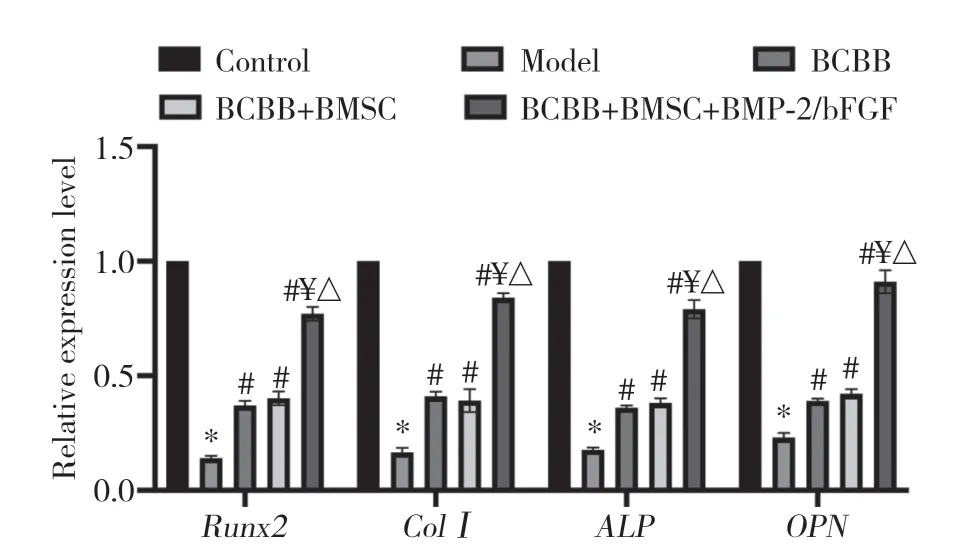
图3 Runx2、Col Ⅰ、ALP和OPN在兔桡骨组织中的相对表达量Fig.3 Relative expression of Runx2,Col Ⅰ,ALP,and OPN in rabbit radius
2.4 BMP-2/bFGF双基因转染的兔BMSC复合生物陶瓷骨对桡骨Lane-Sandhu组织学评分的影响
与Control组相比,Model组兔桡骨组织Lane-Sandhu组织学评分显著降低(P< 0.05);与Model组相比,BCBB组、BCBB+BMSC组和BCBB+BMSC+BMP-2/bFGF组兔桡骨组织Lane-Sandhu组织学评分显著升高(P<0.05);与BCBB组和BCBB+BMSC组相比,BCBB+BMSC+BMP-2/bFGF组兔桡骨组织Lane-Sandhu组织学评分显著升高(P< 0.05)。见图4。

图4 兔挠骨Lane-Sandhu组织学评分Fig.4 Lane-Sandhu histological scores of rabbit radius
2.5 BMP-2/bFGF双基因转染的兔BMSC复合生物陶瓷骨对桡骨组织形态的影响
采用HE染色检测骨组织形态。Control组兔桡骨组织骨细胞排列整齐,组织结构正常;Model组兔桡骨组织可见纤维结缔组织填充缺损区,无成骨表现;BCBB组和BCBB+BMSC组兔桡骨组织可见大量条索状板层骨形成,骨细胞排列整齐;BCBB+BMSC+BMP-2/bFGF组兔桡骨组织可见骨板层呈同心圆排列,骨小梁粗大,破骨细胞增生活跃。见图5。

图5 兔挠骨形态学观察 ×100Fig.5 Rabbit radial tissue morphology ×100
2.6 BMP-2/bFGF双基因转染的兔BMSC复合生物陶瓷骨对桡骨Col Ⅰ和OPN表达的影响
免疫荧光结果显示,与Control组相比,Model组兔桡骨组织Col Ⅰ和OPN表达显著降低(P< 0.05);与Model组相比,BCBB组、BCBB+BMSC组、BCBB+BMSC+BMP-2/bFGF组兔桡骨组织Col Ⅰ和OPN和表达显著升高(P< 0.05);与BCBB组和BCBB+BMSC组相比,BCBB+BMSC+BMP-2/bFGF组兔桡骨组织Col Ⅰ和OPN表达显著升高(P< 0.05)。见图6。

图6 兔挠骨中Col Ⅰ和OPN的免疫荧光结果 ×400Fig.6 Col Ⅰ and OPN in rabbit radial bone visualized by immunofluorescence ×400
2.7 BMP-2/bFGF双基因转染的兔BMSC复合生物陶瓷骨对桡骨骨膜EphB4和ephrin-B2水平的影响
Western blotting结果显示,与Control组相比,Model组兔桡骨组织骨膜EphB4和ephrin-B2水平显著降低(P< 0.05);与Model组相比,BCBB组、BCBB+BMSC组骨组织中EphB4和ephrin-B2水平无统计学差异(P>0.05);与Model组、BCBB组 和BCBB+BMSC组 相 比,BCBB+BMSC+BMP-2/bFGF组兔桡骨组织中EphB4和ephrin-B2水平显著升高(P< 0.05)。
3 讨论
目前,大面积骨缺损的治疗仍是临床难题,自体骨移植和异体骨移植是两种主要治疗方法,但它们都有一些难以克服的缺点。在过去的几十年里,人们开发了大量人工合成生物材料用于修复骨缺损。其中,基于磷酸钙的生物陶瓷是最有前途的用于临床的生物材料,它们具有良好的生物相容性和骨诱导性。虽然在不添加任何生长因子或细胞的情况下,骨诱导多孔磷酸钙陶瓷可用于治疗动物的大面积骨缺损,在一定程度上可与自体骨移植相媲美,但其在促进骨细胞分化和成骨方面的疗效还有待开发。

图7 Western blotting检测兔挠骨骨膜中EphB4和ephrin-B2的表达水平Fig.7 Levels of EphB4 and ephrin-B2 in rabbit radial periosteum
近年来,与干细胞复合形成的组织工程骨的研发与应用受到关注。由于BMSC具有多向分化能力,因此被作为组织工程的种植细胞用于临床研究,但BMSC移植后仅部分转化为成骨细胞,存在成骨能力较弱等缺点[6]。因此,增强BMSC的成骨分化并提高其成骨效率是目前亟待解决的问题。BMP-2是最有效的骨诱导蛋白之一,它促进成骨细胞分化,从而促进骨修复;bFGF在细胞增殖和血管生成中发挥重要作用,是骨修复过程中的关键因子[7]。因此,本研究采用慢病毒载体方法双转染BMP-2和bFGF到兔BMSC中,成功建立了稳定过表达BMP-2和bFGF的BMSC。将该细胞与陶瓷骨复合后植入骨缺损兔体内,发现BMP-2/bFGF双基因转染的BMSC复合生物陶瓷骨能够显著改善挠骨缺损情况,同时上调缺损桡骨组织Runx2、ALP、OPN和ColⅠ的表达,促进组织再生修复,提高Lane-Sandhu组织学评分,提示BMP-2/bFGF双基因转染的BMSC可显著增加BMSC对骨缺损的修复作用。
ColⅠ是骨中最丰富的有机基质成分,是骨的主要组成成分[8]。OPN是一种细胞外酸性蛋白,对正常的早期愈合组织形成和新生血管是必要的[9]。ALP是参与骨组织矿物形成的糖蛋白,是参与骨形成的重要因子[10]。Runx2被认为是骨发育和成骨细胞分化的主要调节因子之一[11-12]。本研究发现,BMP-2/bFGF双基因转染的BMSC复合生物陶瓷骨增加缺损桡骨组织中Runx2、ColⅠ、ALP和OPN的表达,提示BMP-2/bFGF双基因转染的BMSC可增加BMSC对成骨的促进作用。
EphB4/ephrin-B2信号通路是骨改建过程中成骨细胞-破骨细胞间信号传递的一条新通路,这条信号通路是通过破骨细胞表面表达的ephrin-B2和成骨细胞表达的EphB4跨膜蛋白受体间产生双向信号传导,从而实现信息的传递和互相调控。Ephrin-B2通过c-Fos/NFATc1抑制破骨细胞功能,而EphB4通过Dlx5、Osx和Runx2促进成骨细胞功能。EphB4通过增强RhoA的活性,诱导成骨细胞的分化。EphB4/ephrin-B2参与的信号通路促进骨形成,同时抑制过度的骨吸收,因而对于维持骨体内平衡起至关重要的作用[13]。本研究发现,BMP-2/bFGF双基因转染的BMSC复合生物陶瓷骨增加缺损桡骨组织中ephrin-B2和EphB4的表达,提示BMP-2/bFGF双基因转染的BMSC 可能通过激活EphB4/ephrin-B2信号通路发挥促进成骨的作用。
综上所述,本研究发现BMP-2/bFGF双基因转染的BMSC复合生物陶瓷骨对兔桡骨缺损存在修复作用,其机制与激活骨组织中的EphB4/ephrin-B2信号通路有关。

