烟嘧磺隆降解菌Chryseobacterium sp. LAM-M5的分离、鉴定及其降解机理研究
马青云 江旭 李情情 宋金龙 周义清 阮志勇,4,5
(1. 中国农业科学院农业资源与农业区划研究所/CAAS-CIAT可持续农业联合实验室,北京100081;2. 中国农业科学院研究生院,北京100081;3. 中国水产科学研究院,北京 100141;4. 西藏农牧学院资源与环境学院,林芝 860000;5. 烟台大学生命科学学院,烟台 264005)
化学除草剂在保障粮食产量和质量方面发挥了重要的支撑作用。然而,中国作为除草剂生产和使用大国,每公顷农田中除草剂的平均使用量为世界平均水平的 1.5-4 倍[1],除草剂残留正成为限制中国现代农业绿色发展的瓶颈问题之一[2]。磺酰脲类除草剂属于高效、低毒、高选择性的新型除草剂,被广泛应用于水稻、玉米、小麦、大豆等田间杂草的防控,其用量也逐年递增[3]。2015 年全世界磺酰脲类除草剂的销售额已达20.19亿美元,占整个除草剂市场的11.0%[4]。烟嘧磺隆是磺酰脲类除草剂的代表性品种(图1),年销售额达2.82亿美元[5],由于其淋溶性较强,易对土壤及地下水造成污染,对生态环境和人类健康存在潜在的威胁[6-8],同时影响轮作和后茬敏感作物,并危害水生生态系统的稳定。
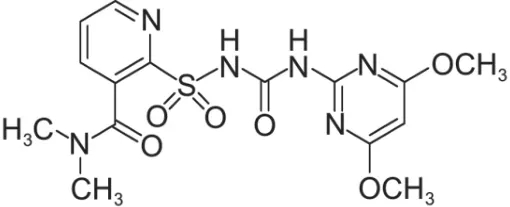
图1 烟嘧磺隆化学结构式[3]Fig.1 Chemical structural formula of nicosulfuron
烟嘧磺隆在自然环境中可通过化学水解[9]、微生物代谢[10]和光催化实现降解[11]。微生物代谢降解是实现烟嘧磺隆从环境中去除的最主要过程,也是最有效和环境友好的途径。迄今为止,已经从农田土壤、工厂排污口、河流、活性污泥等多个生态系统中分离出了多个烟嘧磺隆降解菌株。Zhao 等[12]从磺酰脲类除草剂污染的农田土壤中分离得到的粪产碱杆菌(Alcaligenes faecalis)ZWS11,在6 d内对初始质量浓度为 500 mg/L的烟嘧磺隆的降解率达 80% 以上。代鹏飞等[13]从农药厂的活性污泥中分离到一株能以烟嘧磺隆为唯一碳源生长的假单胞菌(Pseudomonas)YN-8,在7 d内对100 mg/L 的烟嘧磺隆降解率为65.4%。张国民等[14]从玉米田土壤中分离到一株红假单胞菌(Rhodopseudomonas),在7 d内对400 mg/L的烟嘧磺隆降解率为32.3%。Wang等[15]从人工湿地土壤中分离得到的克雷伯氏菌(Klebsiella)Y1,在 6 d内对100 mg/L的烟嘧磺隆降解率为78.90%。Carles等[16]从烟嘧磺隆污染的农田土壤中分离到一株(Pseudomonas fluorescens)SG-1,在1 d内对2.5 mg/L的烟嘧磺隆降解率为77.5%。此外,研究人员还分离到了具有烟嘧磺隆降解能力的真菌,例如,Feng等[17]从活性污泥中分离到一株青霉菌(Penicillium)YC-WC1,在6 d内能完全降解100 mg/L的烟嘧磺隆。许多研究人员从降解菌株中发现了多种降解相关的功能基因及酶,例如,李顺鹏等[18]从嗜甲基菌(Methylophilussp.)S113 菌株中获得了噻吩磺隆水解酶基因tsmE,该基因的表达产物在1 h 内能够将100 mg/L 的噻吩磺隆完全水解。Ruan等[19]对库特氏属(Kurthia huakuii)LAM0713菌株克隆得到一个新的酯酶基因sue,该基因的表达产物在 15 min 内对50 mg/L的醚磺隆降解率达43.2%。宋金龙[20]从黄篮状菌(Talaromyces flavus)LZMl中纯化得到的黄素单加氧酶fmo,在15 min内对50 mg/L烟嘧磺隆的降解率达 71.7%。
目前已报道的烟嘧磺隆降解菌的多样性十分有限,仅集中在芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)等几个属中,难以满足不同环境条件下烟嘧磺隆污染的生物修复需求,因此,有必要从不同环境样品中分离得到更多更丰富的烟嘧磺隆降解菌资源,并进行功能评价及降解机理研究。本研究从合肥某烟嘧磺隆生产厂的活性污泥中分离并筛选得到一株能以烟嘧磺隆为唯一氮源生长菌株,对其进行分类鉴定和降解机理研究。
1 材料与方法
1.1 材料
1.1.1 样品采集 供试样品采自安徽合肥某磺酰脲类除草剂生产厂废水处理池的活性污泥,采集后装入灭菌自封袋中带回实验室,用于烟嘧磺隆降解菌的分离。
1.1.2 主要试剂 烟嘧磺隆(分析纯,> 95%)购自上海阿拉丁有限公司,Taq DNA 聚合酶(MT201)、dNTPs、DNA Marker、所用引物购自博迈德有限公司,乙腈(色谱纯)等有机试剂均购自美国Sigma-Aldrich公司。
1.1.3 培养基 GSM培养基:5.0 g葡萄糖,0.2 g NaCl,0.1 g CaCl2,0.5 g K2HPO4,0.2 g MgSO4·12H2O,pH 7.0,无 机 盐 培 养 基:1.0 g Na3HPO4·12H2O,0.5 g K2HPO4,0.2 g MgSO4·12H2O,pH 7.0。在115℃条件下高压灭菌20 min。牛肉膏蛋白胨固体培养基:3.0 g牛肉膏,10.0 g蛋白胨,5.0 g NaCl,20.0 g琼脂,1 000 mL水,pH 7.4-7.6,121℃条件下高压灭菌20 min,液体培养基中不加琼脂。
1.2 方法
1.2.1 烟嘧磺隆降解菌的富集与筛选 取10 g污泥样品添加到100 mL含终浓度为50 mg/L的烟嘧磺隆的无机盐培养基中,于30℃、160 r/mim的摇床上避光培养30 d,然后以5%的接种比例将该体系转接至100 mL含150 mg/L烟嘧磺隆的新鲜无机盐培养基中,每次提高烟嘧磺隆浓度50 mg/L,并使烟嘧磺隆终浓度达到200 mg/L。驯化3个月后将培养液用无菌水进行倍比稀释后涂布到含50 mg/L烟嘧磺隆的无机盐固体培养基上。将出现的菌落划线纯化后放置- 80℃冰箱保藏备用。
1.2.2 烟嘧磺隆降解菌的初步鉴定 将获得菌株接种到牛肉膏蛋白胨固体培养基上,30℃恒温培养 2 d后观察菌落形态,采用革兰氏染色法确定菌株革兰氏类型。将菌株接种于牛肉膏液体培养基中并置于30℃,160 r/mim的摇床上培养过夜,利用DNA提取试剂盒提取菌液DNA,经1% 琼脂糖凝胶电泳检测目的条带,以该DNA为模板进行PCR扩增。利用细菌通用引物1492R和27F扩增该菌株中的16S rRNA基因[21],纯化的PCR产物由北京博迈德测序公司进行测序。PCR反应体系为(25 μL):模板DNA 1 μL;正向及反向引物各 1 μL;Taq PCR Mix 12.5 μL;ddH2O 8.5 μL。PCR 程序如下:95℃,初始变性 5 min;95℃,变性 30 s;55℃退火 30 s;72℃延伸 1.5 min,循环 30 次;72℃,延伸 10 min。将测序结果提交至EzBioCloud[22]进行序列比对,根据比对结果,选择相似性高的菌株作为参比并下载相关模式菌株的16S rRNA基因序列,通过 CLUSTAL X[23]进行多序列比对,使用MEGA7.0[24]构建系统发育树确定该菌的分类地位。
1.2.3 菌株降解性能测定 将菌株LAM-M5接种于牛肉膏蛋白胨液体培养基中,于30℃,165 r/min的恒温摇床上避光培养48 h。将培养液在8 000 r/min的转速下离心5 min,弃上清,收集菌体。用0.13mol/L磷酸盐缓冲溶液(pH 7.2)洗涤菌体3次后重悬,以5.0%(V∶V)接种比例接入含终浓度50 mg/L烟嘧磺隆的GSM培养基中,于30℃、165 r/min条件下避光培养,研究降解菌对烟嘧磺隆的降解效果,以未接种的相同体系作为空白对照,所有实验均重复3次,定期取样检测液体培养基中烟嘧磺隆残留量。
烟嘧磺隆的测定采用高效液相色谱法[25],根据标准物质的保留时间定性、标准物质的峰面积外标法定量。本实验采用Agilent 1200 LC高效液相色谱:色谱柱:Dikam Diam onsil C18,柱长 250 mm×4.6 mm,内径5 μm;柱温:30℃;流速1.0 mL/min;流动相:乙腈∶水∶冰乙酸 =(30∶70∶0.05,V∶V∶V);进样量10 μL,检测波长245 nm。根据公式计算降解能力:降解率/% =[1 -(实测残量/对照样实测残量)]× 100%[26]。
1.2.4 菌株降解烟嘧磺隆的特性研究 菌株的降解特性研究包括菌株在不同温度、pH及接种量条件下对烟嘧磺隆的降解能力。设置不同温度(15、20、25、30和35℃),不 同pH值(5、6、7、8和9)和不同接种量(0.0%、2.0%、4.0%、6.0%、8.0%和10.0%,V∶V),将菌株接种至不同条件下含烟嘧磺隆GSM培养基中作为处理组,以相同条件下不接入菌株为对照组,测定烟嘧磺隆残余浓度计算菌株的降解率。
1.2.5 短链有机酸的鉴定 利用HPLC检测并鉴定菌株LAM-M5在含烟嘧磺隆的GSM培养基中产生的短链有机酸情况,检测条件:流动相为磷酸二氢铵(0.02 mmol/L,pH 2.7)与甲醇的混合物(比例为85∶15,V∶V),进样量为10 μL,光电二极管阵列检测器的波长为210 nm,流速为1.0 mL/min,柱温为30℃。以分析纯级的草酸、L -苹果酸、α-酮戊二酸、柠檬酸和富马酸作为参照标样。
1.2.6 菌株LAM-M5降解烟嘧磺隆中间产物的检测 将菌株LAM-M5按1.2.3的方法培养并制备OD600为1.0的菌悬液。取5.0%的LAM-M5菌悬液接种到含有50 mg/L烟嘧磺隆的GSM培养基,以相同条件但不接菌的GSM培养基作为空白对照,分别培养3 d后取样,上述所有实验均设3次重复。使用配备电喷雾电离的Xevo三重四极杆(Xevo-TQD)质谱仪(Waters Corp,Milford,MA,USA)进行检测。质量模式m/z为100-450[27],Masslynx NTV的正模式(ESI +)和负模式(ESI -)的ESI源被用于收集和分析获得的数据[28]。
1.2.7 菌株LAM-M5全基因组测序及分析 将菌株LAM-M5送至诺禾致源科技有限公司(北京,中国)进行基因组测序,具体流程参考文献[29]。菌株全基因组测序完成后,分析菌株的基因组成分,分析预测编码基因、非编码 RNA、重复序列、CRISPR 等基因组成分,并使用KEGG、GO、Swissprot、NR、COG等数据库对编码基因序列进行功能注释。结合已报道降解相关的基因,搜索并分析该菌株中可能存在的与烟嘧磺隆降解相关的功能基因信息。
2 结果
2.1 烟嘧磺隆降解菌株的分离
将富集培养得到的富集液进行烟嘧磺隆的降解验证,发现富集液对烟嘧磺隆几乎无降解作用,接下来对富集液进行平板稀释涂布,共获得18株细菌,其中菌株LAM-M5的降解能力最强,在GSM培养基中7 d(30℃,5%接种量)对50 mg/L的烟嘧磺隆的降解率可达92.39%,选作后续研究菌株。
2.2 烟嘧磺隆降解菌株的鉴定
菌株LAM-M5在牛肉膏蛋白胨固体培养基上培养48 h后,菌落呈金黄色,不透明(图2)。革兰氏阴性,无鞭毛。

图2 菌株LAM-M5在牛肉膏蛋白胨培养基平板上的菌落形态Fig.2 Colony morphology of strain LAM-M5 on the beef extract peptone medium plate
将菌株LAM-M5的16S rRNA基因序列(1 505 bp)提交至Genbank数据库中(序列登录号为:MW647553)。将该基因序列信息在EzBiocloud网站上进行比对,结果表明,LAM-M5的16S rRNA基因序列与Chryseobacterium lacusYLOS41T相似性最高,达到99.93%。利用 NJ(neighbor joining method)法构建系统发育树(图3)可以看出,菌株LAM-M5与来自Chryseobacterium属的菌株聚在一起,因此,初步将该菌株鉴定为Chryseobacteriumsp. LAM-M5。自NCBI数据库中下载菌株Chryseobacterium lacusYLOS41T的全基因组信息,通过OrthoANIu algorithm(https://www.ezbiocloud.net/tools/ani)分析菌株间的平均核苷酸一致性(average nucleotide identity,ANI)。结果表明,菌株LAM-M5的基因组序列与Chryseobacterium lacusYLOS41T的ANI值是97.74%,利 用Genome-to-Genome Distance Calculator 2.1(http://ggdc.dsmz.de/)计算菌株间的DNA杂交同源性(DNA-DNA hybridization,DDH),菌株LAM-M5与Chryseobacterium lacusYLOS41T间的DDH值为79%,两个数值均高于定义同种的阈值(ANI 95%-96%和DDH 70%)[30],因此将该菌株LAM-M5鉴定为Chryseobacterium lacus,这是首次关于金黄杆菌属(Chryseobacterium)菌株降解烟嘧磺隆的报道。
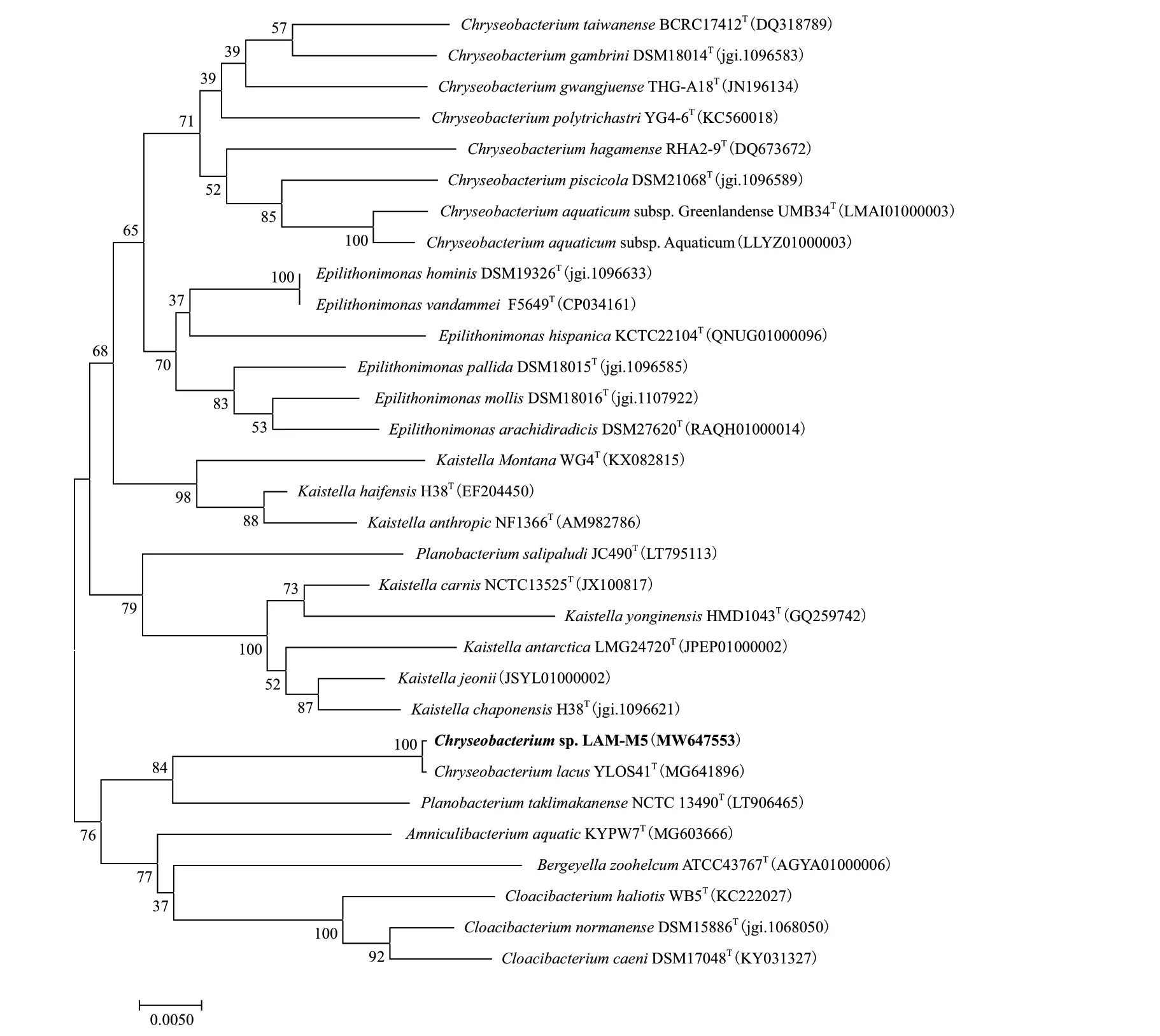
图3 基于16S rRNA基因序列构建的NJ系统发育树Fig.3 Neighbour-joining phylogenetic tree based on the 16S rRNA gene sequences
2.3 烟嘧磺隆的降解特性
LAM-M5可以在较宽的pH值范围(5-9)内降解烟嘧磺隆(图4-A),降解率随pH值的降低而增加。初始pH值为6.0时,菌株LAM-M5对烟嘧磺隆的降解效果最佳,可达92.39%。在第3天时,开始对50 mg/L烟嘧磺隆表现出明显的降解,此时体系pH值开始下降;第7天时,体系pH值降至3.5,此时菌株LAM-M5对50 mg/L的烟嘧磺隆降解率达到92.39%。菌株LAM-M5对温度具有较好的适应性,它在15℃-35℃范围内均能降解烟嘧磺隆,且降解效率随温度增加而增加(图4-B),在35℃时降解效果最佳,达到98.39%。菌株LAM-M5的初始接种量对烟嘧磺隆的降解率也有影响,随着接种量的增加,降解效率有明显的增加,初始接种量为10% 时,降解效率最高,达到99.6%。
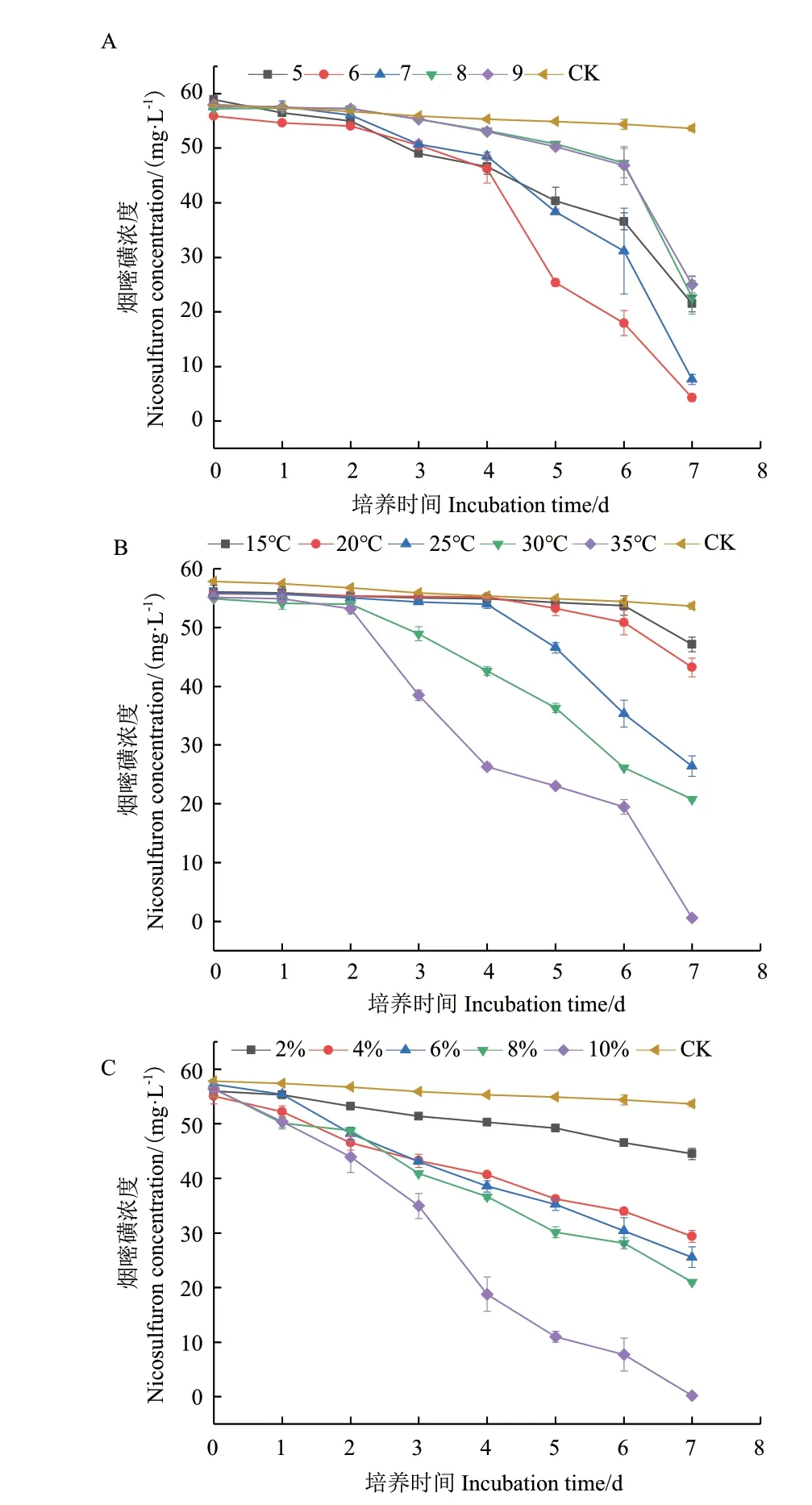
图4 不同pH值(A)、温度(B)、接种量(C)对菌株LAM-M5 降解烟嘧磺隆降解率的影响Fig.4 Effects of different pH(A),temperature(B)and initial inoculum ratio(C)on the degradation of nicosulfuron by strain LAM-M5
同时验证了菌株LAM-M5对其他田间常用除草剂的降解,例如,磺酰脲类除草剂氯嘧磺隆和三酮类除草剂硝磺草酮,在相同的培养条件和降解体系内,菌株LAM-M5对这两类除草剂在7 d内均无降解。
2.4 菌株LAM-M5降解烟嘧磺隆过程中产生的短链有机酸的鉴定
本研究中,菌株LAM-M5在含烟嘧磺隆的GSM培养基中培养时,体系pH值在7 d之内从7.0降至3.0左右(图5)。利用HPLC对菌株的培养液进行了检测,在培养液中检测到了大量L -苹果酸,由于烟嘧磺隆在酸性条件下极不稳定,推测菌株LAM-M5通过代谢葡萄糖产生大量L-苹果酸,降低环境pH值,从而使烟嘧磺隆发生脲桥断裂而降解。
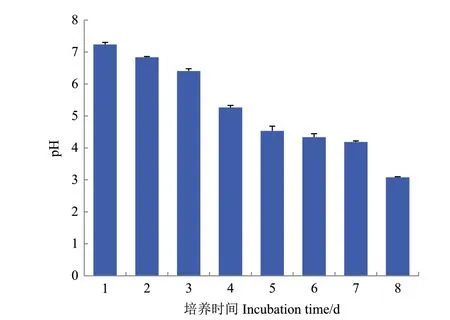
图5 LAM-M5降解烟嘧磺隆过程中pH值的变化Fig.5 Change of pH value during the nicosulfuron degradation by strain LAM-M5
2.5 菌株LAM-M5降解烟嘧磺隆代谢产物的检测及其代谢途径的推测
通过高效液相色谱与质谱联用[31],对菌株LAM-M5在含烟嘧磺隆的GSM液体培养基中培养3 d后的中间代谢产物进行检测与分析。ESI源检测结果表明,在阴离子和阳离子模式下,共检测到5个片段,质荷比分别为409m/z,259m/z,228m/z,156m/z,304m/z。根据已报道的代谢途径及中间产物的化学结构[31-33],对检测片段的物质类型和产生途径进行了推断,其中阴离子模式中的259.44m/z(2-(N-氨基甲酰磺酰磺酰基)- N,N-二甲基丙酰胺)是由于磺酰脲桥C-N键的断裂产生,并进一步断裂酰胺键产生228.38m/z(2-氨基磺酰基-N,N-二甲基丙酰胺)。阳离子模式下质荷比为304.18m/z(N-(4,6-二甲氧基嘧啶-2-基氨基甲酰基)-1-(甲基亚氨基)甲磺酰胺)的产生是由于烟嘧磺隆中吡啶环的开环[34];在阳离子模式下检测到的155.41m/z(2-氨基-4,6-二甲氧基嘧啶)产物是由304.18m/z产物的磺酰脲桥的酰胺键断裂产生。综上,推测得出了菌株LAM-M5在GSM培养基中对烟嘧磺隆可能的降解途径(图6)。
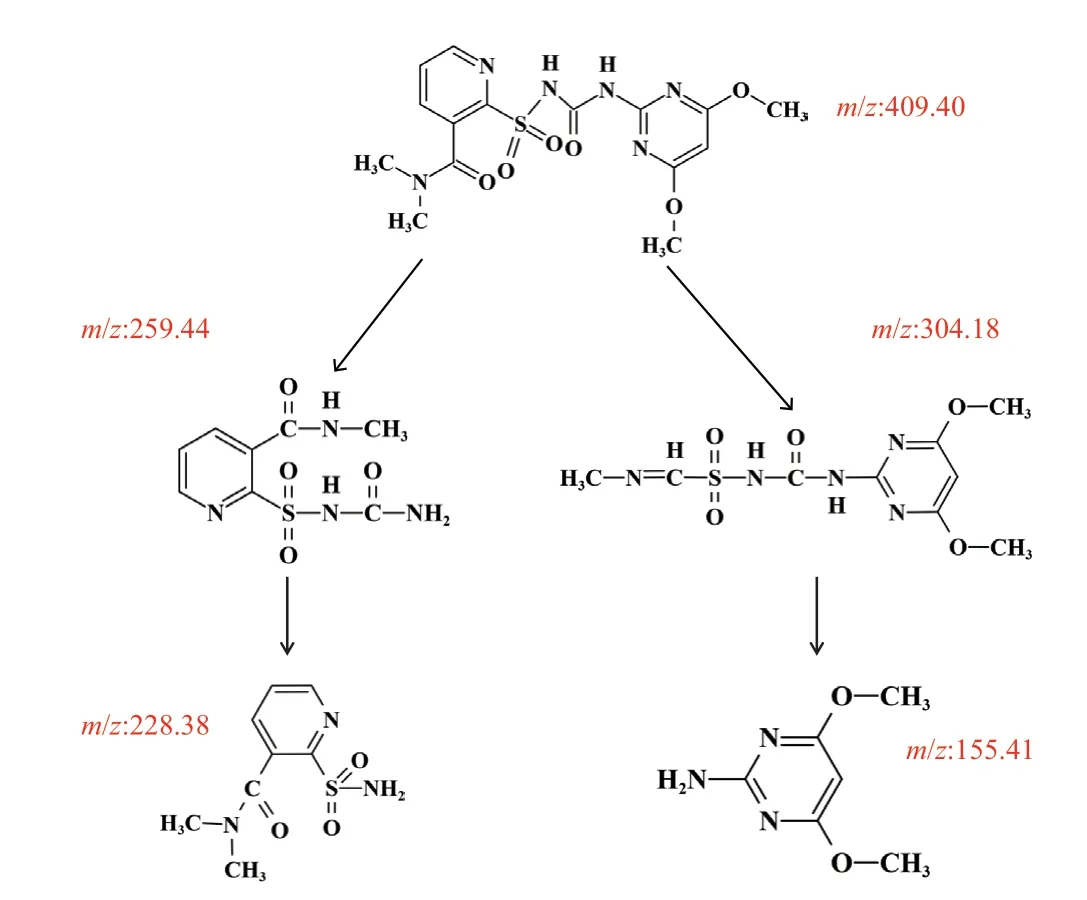
图6 菌株LAM-M5降解烟嘧磺隆的代谢途径Fig .6 Proposed metabolic pathways of nicosulfuron degradation by strain LAM-M5
2.6 菌株LAM-M5基因组分析
2.6.1 菌株LAM-M5基因组测序数据分析 通过对菌株LAM-M5的基因、重复序列、非编码 RNA 等的预测,获得了该菌株基因组的组成基本情况信息(表1)。菌株LAM-M5的基因总长度为5.704 Mb,基因组中含基因数量达6 366个,平均长度 896 bp。串联重复序列共 280个,总长为 17 086 bp,占基因组全长的 0.2707%。小卫星序列 211个,微卫星序列 0个,tRNA 121个,rRNA 14个。
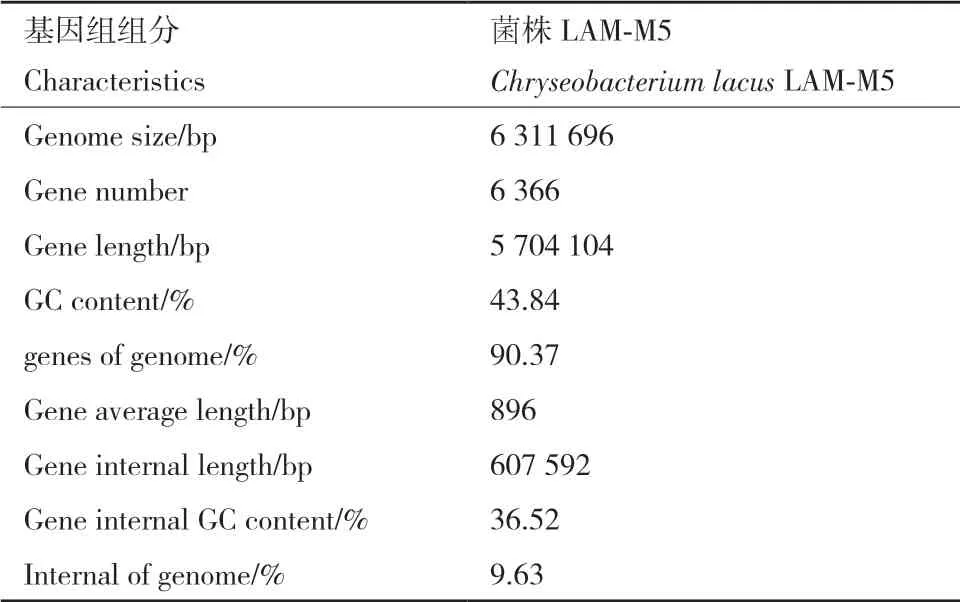
表1 LAM-M5的基因组组分结果统计Table 1 Genomic characteristics of strain LAM-M5
2.6.2 菌株LAM-M5对烟嘧磺隆降解酶基因的预测 在该研究中,对菌株LAM-M5进行基因组Swiss-port的数据库分析,同时结合已报道的烟嘧磺隆的降解基因分析,对菌株LAM-M5中可能参与烟嘧磺隆降解的相关基因进行了预测,结果如表2所示。

表2 菌株LAM-M5 基因组中7个降解酶相关的基因Table 2 7 genes related to degradation enzymes in the genome of strain LAM-M5
3 讨论
烟嘧磺隆长期使用造成的残留会对土壤及地下水造成污染,对生态环境和人类健康存在潜在的威胁,同时损害后茬敏感农作物,并危害水生生态系统的稳定性。因此寻找高效、环境友好、经济的除草剂污染环境治理方法十分迫切。微生物修复技术无毒、无残留,避免了二次污染,是消除烟嘧磺隆残留及保障农产品安全的有效途径之一。目前已经从各种环境样本中通过富集驯化等方式获得了许多烟嘧磺隆的降解资源。但是这些降解资源仅限于环境中的优势属,例如芽孢杆菌属(Bacillus),假单胞菌属(Pseudomonas)等。环境中存在着丰富的微生物资源,许多具有降解功能的菌株资源未被发掘,可尝试通过培养组学[35]的方法获得更多的烟嘧磺隆降解的菌株资源,丰富除草剂的微生物降解资源库。本实验从某烟嘧磺隆生产厂的活性污泥中,分离出一株烟嘧磺隆高效降解菌株LAM-M5,通过16S rRNA的基因序列比对,初步将菌株鉴定为Chryseobacterium lacusLAM-M5。
在已报道的烟嘧磺隆微生物降解途径与相关机制中,烟嘧磺隆主要通过脲桥上的C-N键断裂完成降解。Zhao等[12]在粪产碱杆菌(Alcaligenes faecalisZWS11)对烟嘧磺隆的降解产物中检测到了N,N-二甲基-2-氨基磺酰基-3-吡啶甲酰胺和2-氨基-4,6-二甲氧基嘧啶,并由此推断这两个降解产物是由磺酰脲桥的C-N键断裂直接得到的。Zhang等[36]根据粘质沙雷氏菌(Serratia marcescensN80)对烟嘧磺隆的主要降解产物推测了其降解途径,其中化合物N,N-二甲基-2-氨基磺酰基-3-吡啶甲酰胺和2-氨基-4,6-二甲氧基嘧啶均是在微生物作用下直接从烟嘧磺隆获得,分别来自于磺酰脲桥上 C-N 键的断裂。现有的研究发现,不同种类微生物对烟嘧磺隆的降解途径均存在差异,并导致所产生的中间降解产物有所不同[37],但是几乎所有的烟嘧磺隆降解体系中都能直接检测到产物N,N-二甲基-2-氨基磺酰基-3-吡啶甲酰胺和2-氨基-4,6-二甲氧基嘧啶,表明这两种化合物是在微生物作用下直接由烟嘧磺隆产生的。但是在本研究中,检测到的2-氨基-4,6-二甲氧基嘧啶并不能在菌株LAM-M5的作用下直接获得,而是由中间产物N-(4,6-二甲氧基嘧啶-2-基氨基甲酰基)-1-(甲基亚氨基)酰胺键断裂后生成的。表明菌株LAM-M5对烟嘧磺隆的降解过程和机制不同于粪产碱杆菌和粘质沙雷氏菌。
在以前的报道中,对黄篮状真菌(Talaromyces flavusLZM1)[21]和腊状芽孢杆菌(Bacillus cereus)[32]降解烟嘧磺隆的代谢产物进行了比较深入的研究。这两个菌在降解烟嘧磺隆过程中均能直接产生259.44 m/z(2-氨基磺酰基-N,N-二甲基烟酰胺),304.18 m/z(N-(4,6-二甲氧基嘧啶-2-基氨基甲酰基)-1-(甲基亚氨基)甲磺酰胺)和另外一个346m/z(2-(1-(4,6-二甲氧基-嘧啶-2-)-脲基)-N,N-二甲基-烟酰胺)产物,说明这两个菌均能通过3种途径降解烟嘧磺隆。而在本研究中,虽然我们尝试不同时间取样和改变检测条件,但是346 m/z这个产物却始终检测不到,说明菌株LAM-M5对烟嘧磺隆的降解过程和机制不同于黄篮状真菌和腊状芽孢杆菌。
同时监测到该菌株与烟嘧磺隆共培养过程中,体系的pH值从7.0减少到3.0,环境酸化,而烟嘧磺隆在酸性条件下极不稳定,从而造成烟嘧磺隆的脲桥发生断裂,推测这可能是一种微生物自我保护机制。通过对菌株的全基因组信息分析,发现该菌株的基因序列中含有大量已报道的参与烟嘧磺隆降解过程的功能基因,如水解酶[19]、氧化酶[37]、酯酶[38]、过氧化氢酶[39]等。
4 结论
从活性污泥中获得了一株烟嘧磺隆的高效降解菌,初步鉴定为Chryseobacterium lacusLAM-M5,该菌最适的降解条件为35℃,pH 6.0,接种量10%时菌株对50 mg/L的烟嘧磺隆降解率最高可达 92.39%。菌株在以葡萄糖为碳源时,通过产生大量的L-苹果酸导致体系内pH值下降,造成烟嘧磺隆脲桥断裂。菌株Chryseobacterium lacusLAM-M5对烟嘧磺隆具有较高的降解能力。

