白头翁皂苷A对肝癌细胞增殖、迁移、侵袭和放疗敏感性的影响及机制
尹玉婷,黄炜
上海市中医药大学附属龙华医院药学部,上海 200032
肝癌具有易转移、侵袭及预后不良等特点[1],5年生存率仅为16.8%[2]。肝癌以手术治疗为主,放疗等为辅,但肝癌细胞敏感性低限制了放疗在临床的应用[3-4]。近年来,中医药在癌症治疗上已经取得了明显的效果。白头翁含有多种化学成分(三萜皂苷类、三萜酸和糖蛋白等),具有抗炎、抗菌、抗病毒、免疫调节和抗肿瘤等药理活性,参与肿瘤细胞的增殖、凋亡和自噬等过程[5-6]。白头翁皂苷A(PSA)是白头翁皂苷类分离提取的单体成分之一[7],可抑制乳腺癌细胞的增殖,增加其放疗敏感性[8]。SIRT1在肝癌细胞中表达上调,miR-29c通过调控SIRT1表达调节肝癌细胞的增殖、凋亡和化学耐药性[9]。PSA在肝癌细胞中的增殖、转移和放疗敏感性的作用机制尚不明确。因此,2018年6月—2019年8月,本研究通过体外培养肝癌细胞(HepG2细胞),探讨PSA对HepG2细胞增殖、迁移、侵袭和放疗敏感性的影响及其作用机制。
1 材料与方法
1.1 细胞、试剂及仪器 HepG2细胞购自上海生命科学院细胞库;胎牛血清、RPMI-1640培养基购自美国Gibco公司;LipofectamineTM2000试剂盒、TRIzol试剂盒购自美国Invitrogen公司;PSA购自上海翰香生物科技有限公司;si-NC、si-SIRT1、pcDNA、SIRT1序列和引物由上海吉玛制药技术有限公司合成;MTT试剂盒购自上海生工生物工程股份有限公司;Transwell、Matrigel胶购于美国Corning公司;反转录试剂盒、AceQ qPCR SYBR®Green Mix试剂盒购自日本TaKaRa公司;SIRT1抗体购自美国Abcam公司。Synergy HT型酶标仪购自美国Bio Tek公司;BDS200型倒置相差显微镜购自重庆奥特光学仪器有限公司;Applied Biosystems PCR热循环仪购自美国Thermo Fisher公司。
1.2 细胞培养及分组 将细胞置于含胎牛血清的RPMI-1640培养基内培养,然后置于恒温培养箱,条件设置为37℃、5%CO2。收集对数生长期的细胞,调整细胞密度为1×106/mL,接种到96孔板,分别用不同浓度(0、10、15、20 mg/L)PSA干预24 h,根据实验结果,分别将0、20 mg/L PSA干预的细胞记为对照组、PSA组。
1.3 细胞增殖能力检测 采用MTT法。取以上两组细胞,调整细胞密度为3×104/mL,接种到96孔板中,并在每孔加入5 g/L MTT溶液,在恒温培养箱内继续培养4 h,加入DMSO溶液150μL,用酶标仪检测每孔490 nm波长处的OD值。细胞活力(%)=实验组OD值/对照组OD值×100%。
1.4 细胞迁移、侵袭能力检测 采用Transwell实验。细胞迁移能力检测:取以上两组细胞,离心后通过无血清的RPMI-1640培养基,调整细胞悬液密度至2×105/mL。在Transwell上室加入细胞悬液200μL,下室加入含血清的RPMI-1640培养基500μL。在恒温培养箱培养24 h,用甲醇固定,结晶紫染色30 min后,随机选取3个视野,100倍显微镜下观察细胞迁移数目,计数取平均值。细胞侵袭能力检测:将无血清的RPMI-1640培养基、Matrigel胶按照5∶1混合稀释,调整细胞悬液,其余步骤同迁移能力检测。
1.5 细胞放疗敏感性检测 采用克隆形成实验、单击多靶模型。取以上两组细胞,接种至6孔板内,然后分别给予0、2、4、6、8 Gy X射线照射24 h,在恒温培养箱内继续培养10~14 d。去培养基,PBS清洗2次,甲醇固定15 min,结晶紫染色30 min。在显微镜下选取细胞≥50个集落数,计算细胞存活分数。采用单击多靶模型在Graph Pad Prism 7.0拟合细胞存活曲线,模拟单击多靶模型,并计算以下参数:平均致死剂量(D0)、准闭剂量(Dq)、2 Gy细胞存活分数(SF2)、外推值(lnN=Dq/D0)、参数值(k=1/D0)、放射增敏比(SER)。
1.6 细胞内SIRT1 mRNA表达检测 采用qRT-PCR法。通过TRIzol试剂盒提取以上两组细胞的总RNA后,检测其细胞浓度和纯度,然后反转录合成cDNA,经AceQ qPCR SYBR®Green Mix试剂盒进行PCR扩增。反应体系20μL:cDNA 1μL,正、反向引物各0.5μL,2×SYBR Green 10μL,无菌蒸馏水8μL。反应条件:95℃预变性30 s,95℃变性20 s、58℃退火30 s、72℃延伸30 s共40个循环。以GAPDH为内参。用2-ΔΔCt法计算SIRT1 mRNA相对表达量。SIRT1正向引物5'-GTTGTGTGCCTTCGTTTTGGA-3',反向引物5'-AGGCCGGTTTGGGCTTATACA-3';GAPDH正向引物5'-AGCTACTGGCGTCTTCACC-3',GAPDH反向引物5'-CCACGATGCCAAAGTTGTCA-3'。
1.7 细胞内SIRT蛋白表达检测 采用Western blotting法。取以上两组细胞加入裂解液后,提取各组细胞的总蛋白。按照蛋白上样量50μg在凝胶电泳处理,将蛋白转移至PVDF膜内。室温封闭培养1.5 h并加入5%脱脂奶粉,然后加入一抗SIRT,稀释比例为1∶800,PBS清洗3次,加入山羊抗鼠IgG二抗稀释1∶5 000,PBS继续清洗3次,暗室内加入化学发光液显影、定影。Quantity One软件分析灰度值,以CAPDH为内参。目的蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。
1.8 统计学方法 采用SPSS21.0统计软件。符合正态分布的计量资料用±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
随PSA浓度的增加,HepG2细胞活力、迁移细胞数目、侵袭细胞数目均逐渐降低(P均<0.05),见表1。经0、2、4、6、8 Gy X射线照射后,对照组细胞存活分数分别为100%、61.0%、35.4%、16.2%、6.0%,PSA组细胞存活分数分别为100%、28.1%、7.5%、1.4%、0.5%。与对照组比较,PSA组细胞存活分数低(P均<0.05)。单击多靶模型参数见表2。与对照组比较,PSA组SIRT1 mRNA、蛋白表达低(P均<0.05),见表3。
表1 不同浓度PSA对Hep G2细胞增殖、迁移、侵袭的影响(±s)
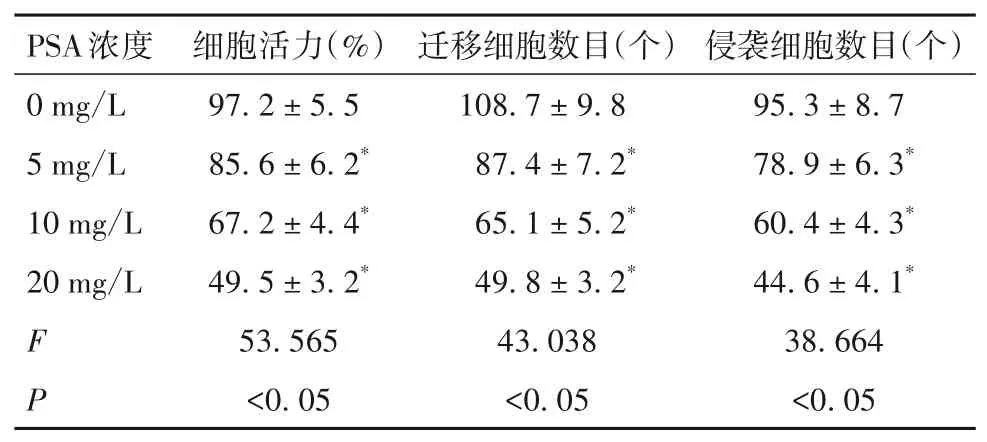
表1 不同浓度PSA对Hep G2细胞增殖、迁移、侵袭的影响(±s)
注:与0 mg/L比较,*P<0.05。
?
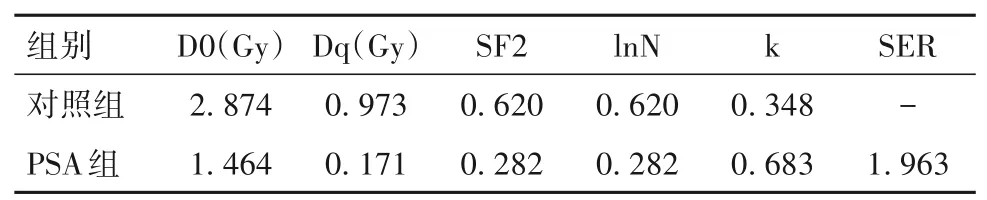
表2 对照组与PSA组单击多靶模型参数
表3 对照组与PSA组SIRT1表达比较(±s)

表3 对照组与PSA组SIRT1表达比较(±s)
?
3 讨论
肝癌是全球癌症死亡较高癌症之一,每年死亡患者高达70万例[10],其发病受多种因素的影响,如家族遗传、肥胖、环境和病毒感染等[11-12]。近年来,由于国民生活质量逐步提高,肝癌患者发病呈现年轻化趋势,严重威胁人类的生命健康安全。肝癌起病隐匿,在肝癌早期临床症状不甚明显,多数肝癌患者发现时已经处理中晚期,这是肝癌患者治疗面临的一大难题。随着医疗水平的进步,放疗是临床治疗肝癌的主要手段,但仍存在5年生存率低、复发和产生放疗耐药性等问题[13]。
白头翁属于毛莨科植物白头翁的干燥根,具有清热解毒、凉血止痢的功效,可用于治疗痢疾、湿疹和血痣等[14]。白头翁具有丰富的化学成分,其中有效成分皂苷对肿瘤的治疗效果明显。任楠楠等[15]研究结果显示,白头翁皂苷B4处理宫颈癌细胞,可通过激活Notch信号通路抑制宫颈癌细胞的增殖和自噬。不同浓度白头翁皂苷可过抑制MAPK信号通路抑制肺癌细胞增殖,并诱导细胞凋亡[16]。有研究结果显示,白头翁皂苷B4可抑制肝癌细胞增殖,使细胞周期阻滞,并诱导细胞凋亡[17]。彭超军[18]研究结果显示,PSA可以明显抑制非小细肺癌细胞的增殖,增加放疗敏感性,并诱导其细胞凋亡。以上均说明白头翁皂苷的抗肿瘤效果良好,对肝癌细胞具有增殖抑制和凋亡促进的作用,但是其对肝癌细胞迁移、侵袭和放疗敏感性的机制研究相对较少。鉴于此,本研究采用不同浓度PSA处理HepG2细胞,通过MTT、Transwell实验检测PSA对HepG2细胞增殖、迁移、侵袭的影响,结果显示HepG2细胞活力、迁移细胞数、侵袭细胞数呈剂量效应关系降低,提示PSA可抑制明显抑制肝癌细胞增殖、迁移和侵袭。
电离照射细胞后,一些细胞会延迟死亡,这种细胞死亡程度与照射剂量有关,常用存活细胞分数表示,因此使用单击多靶模型对存活细胞分数与照射剂量进行拟合,计算得出相关参数值。使用多靶单击模型计算多个参数,其中D0反映每个细胞平均被击中所需的辐射剂量,Dq反映修复亚致死细胞损伤能力的大小,SF2反映敏感程度,lnN反映细胞内放射敏感区域,k是与射线的质及细胞敏感性有关的常数,SER反映细胞敏感度变化,SER越大反映辐射敏感程度越大[19]。本研究使用20 mg/L的PSA处理HepG2细胞,结果显示,PSA组细胞存活分数明显降低高于对照组,提示PSA对肝癌细胞的放疗敏感性增加,这与相关研究[18]结果相似。
Sirtuins蛋白家族具有多种催化功能,在调节葡萄糖和脂质代谢中具有重要作用。SIRT1是Sirtuins蛋白家族其主要成员之一,可介导参与肿瘤细胞的增殖、凋亡、迁移、侵袭和放射治疗等生物学过程[20-21]。SIRT1在肝癌细胞中高表达,杜仲醇可以下调SIRT1抑制肝癌细胞的增殖、迁移和侵袭,并诱导其细胞凋亡[22]。下调SIRT1表达可促进肝癌细胞增殖、迁移,诱导其凋亡[23]。有研究发现,miR-204-5p通过下调SIRT1表达促进肝癌细胞增殖和药物敏感性,并 诱 导 细 胞凋 亡[24]。miR-150-5p通 过抑 制SIRT1表达诱导肝癌细胞凋亡,增加肝癌细胞的放疗敏感性[25]。以上说明SIRT1与肝癌发展密切相关,可以作为肝癌治疗和诊断的作用靶点。本研究结果显示,PSA处理HepG2细胞后,细胞中SIRT1 mRNA、蛋白表达下调,提示PSA可调控SIRT1表达。PSA可通过调控SIRT1的表达影响肝癌的恶性进展。
综上所述,PSA可以明显抑制肝癌细胞的增殖、迁移和侵袭,增加其放疗敏感性,其作用机制可能与SIRT1有关,这为PSA对肝癌细胞的研究提供新的实验研究基础。本研究也存在不足之处,关于PSA对肝癌细胞的具体作用机制,及其可能相关的信号通路,需进一步探索。

