体外膜肺氧合联合主动脉内球囊反搏在高危患者经皮冠状动脉介入治疗中的应用
刘锋锋,郑建杰,2
(1.西安交通大学,陕西 西安 710049;2.西安交通大学第一附属医院心外科,陕西 西安 710061)
经皮冠状动脉介入术(percutaneous coronary intervention,PCI)是冠心病患者有效的治疗手段,能协助重建冠脉血运,疏通堵塞的血管;但该手术操作复杂,治疗难度大,手术风险高[1]。对于高龄、身体状态差,以及病情复杂等高危患者而言,不仅会增加治疗风险,一旦操作不当,会直接威胁患者的生命安全[2]。为了保证高危患者能顺利、安全的完成PCI 术,临床多通过采取预防性机械装置辅助降低其死亡风险,减少术中并发症。主动脉内球囊反搏(IABP)和体外膜肺氧合(ECMO)[3]均为生命支持的有效辅助手段,联合使用能有效提升治疗效果,稳定患者的血流动力学[4,5]。基于此,本研究选择我院收治的行PCI 术的高危患者为研究对象,探讨IABP 联合ECMO 的应用价值和效果,现报道如下。
1 资料与方法
1.1 一般资料 选择2019 年1 月-2021 年5 月西安交通大学第一附属医院收治的行PCI 术治疗的高危患者50 例,依据随机数字表法分为对照组和观察组,每组25 例。对照组男14 例,女11 例;年龄60~83 岁,平均年龄(72.02±3.11)岁;BMI 19~32 kg/m2,平均BMI(25.99±2.31)kg/m2;欧洲心脏手术危险因素系统评分4~13 分,平均(7.59±1.59)分;冠心病病程1~10 年,平均病程(5.36±0.59)年。观察组男15例,女10 例;年龄62~83 岁,平均年龄(72.69±3.28)岁,BMI 19~31 kg/m2,平均BMI(25.33±2.29)kg/m2;欧洲心脏手术危险因素系统评分4~14 分,平均(8.01±1.66)分;冠心病病程1~11 年,平均病程(5.55±0.60)年。两组性别、年龄、BMI、欧洲心脏手术危险因素评分及冠心病病程比较,差异无统计学意义(P>0.05),有可比性。本研究已获得医院伦理委员会批准,患者及家属知情同意,并已签署知情同意书。
1.2 纳入与排除标准 纳入标准:高危因素标准:①左室射血分数≤30%;②急性冠脉综合征;③冠状动脉左主干病变≥70%;④冠状动脉弥漫性病变;⑤单侧颈内动脉狭窄≥70%;满足2 个及以上者。符合PCI 手术指征;术前符合置入IABP 和ECMO;年龄≥60 岁。排除标准:①冠脉介入手术禁忌证;②CPR 时间超过20 min 以上;③凝血功能障碍;④精神疾病史;⑤药物过敏史[6];⑥认知、交流障碍;⑦晚期恶性肿瘤;⑧合并脑血管疾病,包括脑出血及大面积脑梗塞[7];⑨冠心病合并主动脉瓣中重度关闭不全;⑩预计生存期<1 个月。
1.3 方法 对照组在IABP 辅助下行PCI,观察组在IABP 联合ECMO 下行PCI 术,具体操作如下:①IABP:于左侧股动脉常规穿刺,置入7.5F 鞘管,沿着导丝选择合适球囊导管,将其送至降主动脉近端,体外连接至IABP 泵,将球囊外端与皮肤缝合固定,用肝素盐水定时冲洗导管,使用心电模式触发球囊进行反搏,反搏比例1∶1[8];②ECMO:ECMO 仪器为德国MAQUET Cardiopulmonary AG 产品(型号规格:RotaFlow);术前正确评估患者的病情,常规行双侧股动、静脉超声,明确双侧股动静脉血管是否有斑块、狭窄、迂曲、闭塞等并发症,无法经外周置入插管的改为腋动脉进行插管[9]。插管前ECMO 置入过程均在导管室完成。局麻状态下经皮穿刺,采用Seldinger 法分别行股动、静脉穿刺,透视下将泥鳅导丝置入血管腔,建立轨道;置入管道前,体内给与80~100 U/kg 肝素抗凝;ACT 达标后置入ECMO 动脉插管15~17F(6 cm),股静脉插管21~23F,股静脉开口位于右房下腔开口2 cm 处,然后建立V-AECMO[10]。根据患者的体重及循环情况调整相关参数,设置氧浓度为60%~70%,流量为30~40 ml/(kg·min);ECMO 后氧分压为150~200 mmHg,二氧化碳分压为35~45 mmHg,治疗期间普通肝素抗凝,每30 min检测活化凝血时间,维持在180~220 s 内,患者的体温维持在36 ℃左右,术后根据手术中冠脉开通情况、心脏功能、循环血压、心率等指标,确定是否撤机,或者持续辅助。撤离ECMO 时,其管道内的血液部分输回体内,会短暂性发生失血或血红蛋白下降,因此,术后应常规补充红细胞和血浆,确保血红蛋白≥90 g/L[11]。此外,对术前血红蛋白较低的患者进行血液预充,减少晶体导致的血液稀释;③PCI 术:常规穿刺桡动脉并置入鞘管,沿着导丝送至主动脉窦,结合患者的血管病变情况选择合适的导丝,1.5~2.5 mm 顺应性球囊进行病变处理,合理选择冠脉药物涂层支架扩张冠状动脉,最后行血管造影检查有无冠脉夹层、血栓、穿孔以及支架膨胀不全等并发症,并及时处理和预防;若造影显示血管流通,心功能良好,收缩压≥90 mmHg,将流量降至1 L/min,待血流动力学稳定后可选择恰当时机撤除ECMO;持续观察,将患者送回病房休息,待患者平均动脉压>70 mmHg,尿量>1 ml/(kg·h)[12],患者心力衰竭症状改善、心律正常并且血流动力学稳定,周围循环良好时可选择拔除主动脉球囊。
1.4 观察指标 比较两组的住院时间、IABP 使用时间、入院到球囊通过时间、院内死亡率、脱机成功率、院外生存情况,以及术前后的左心室射血分数。
1.5 统计学方法 采用SPSS 23.0 统计学软件进行分析,计数资料用[n(%)]表示,行字2检验,计量资料用(),行t检验,P<0.05 表示差异有统计意义。
2 结果
2.1 两组治疗相关指标比较 观察组住院时间、IABP使用时间及入院到球囊通过时间较对照组长(P<0.05),见表1。
表1 两组治疗相关指标比较()
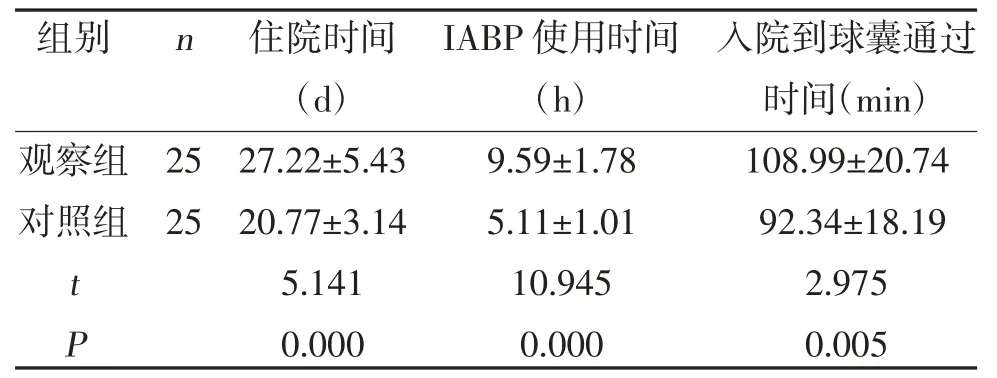
表1 两组治疗相关指标比较()
2.2 两组预后情况比较 观察组院内死亡率低于对照组,脱机成功率、院外生存率高于对照组(P<0.05),见表2。
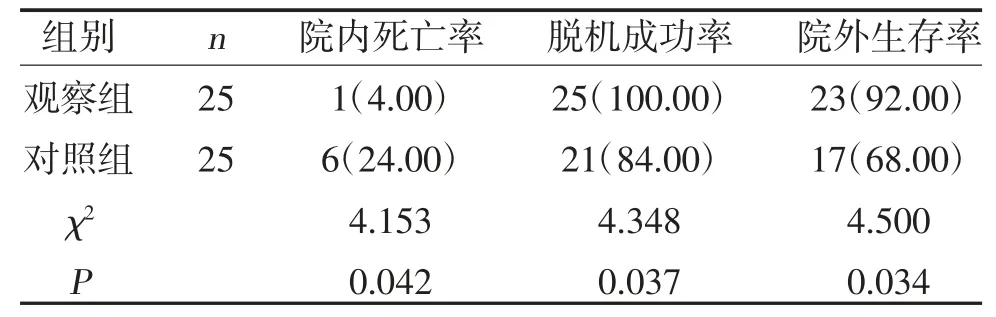
表2 两组预后情况比较[n,(%)]
2.3 两组左室射血分数比较 两组左室射血分数均较治疗前升高(P<0.05);但两组左室射血分数比较,差异无统计学意义(P>0.05),见表3。
表3 两组左室射血分数比较(,%)

表3 两组左室射血分数比较(,%)
注:与对照组比较,*P>0.05
3 讨论
冠状动脉病变是老年人中较多发的疾病类型,随着年龄的增长和各方面因素的影响,导致血管发生冠状动冠脉粥样硬化病变,进而引发严重慢性疾病,给患者的健康、生活乃至生命造成严重威胁[13]。冠状动脉病变患者多数合并其他严重疾病,机体功能差;高龄、肥胖、心功能差、高血压等因素导致患者手术治疗难度增加。目前,针对高危PCI 患者的归类分为以下几种:①高龄、身体功能差;②合并病情危重、心源性休克、心肾功能不全;③冠状动脉病变复杂,存在主干分叉病变、多支血管病变等,此类患者行PCI 时还需加强辅助支持治疗才能提高预后效果,降低临床病死率[14,15]。
PCI 手术治疗能有效改善冠脉缺血、缺氧情况,重建动脉血运,但是治疗期间易产生各种并发症,进而影响其术后心功能恢复;使用机械循环辅助装置配合能在PCI 术中提供额外的血流动力学支持,使患者在术中安全、顺利的度过危险期,达到理想的康复效果[16]。本研究使用IABP 和ECMO 治疗,两种辅助循环装置联合治疗能进一步降低患者的死亡率,提高其预后生存质量。邱承杰等[17]研究显示,ECMO联合LABP 的院内死亡率、院外生存率与LABP 组有显著性差异,原因是联合治疗能保护心室功能,确保稳定的血流动力学状态,保证各脏器正常血流灌注,同时还能提高PCI 的治疗成功率,因此其死亡率偏低。本研究中观察组生存率和脱机成功率均高于对照组,死亡率低于对照组(P<0.05),与上述的研究结论相似。观察组IABP 时间、住院时间和入院到球囊通过时间均较对照组长,分析原因为联合治疗能给予血流动力学支持,一般在患者心肺功能得到平稳恢复后先撤去ECMO,然后继续观察,并持续使用IABP 促使其舒张期动脉压增高,头颅动脉和冠脉血流灌注增加以恢复病情,减少器官功能障碍,因此IABP 的使用时间会延长。此外,IABP 的操作原理主要是通过主动脉内球囊来增加心脏舒张早期主动脉内的压力来改善冠脉血流速度[18],进而增加血流量,改善心肌供氧。另外,球囊还能在舒张晚期达到快速减少动脉内压的作用,其目的是减轻心脏负荷,但心功能改善并不能完全依靠球囊,其改善程度取决于心脏自身功能和自身节律,而且此操作并不能良好提供循环支持[19]。ECMO 属于心肺支持技术,此技术能完全代替心脏功能,维持血液正常循环,通过氧合器和离心泵分别代替肺功能和左心室的收缩功能,为心肺衰竭患者提供循环辅助支持,由此证实联合治疗有助于稳定呼吸循环,促进心功能恢复[20]。本研究中,两组治疗后的左室射血分数均较治疗前升高(P<0.05),与上述研究吻合。
综上所述,高危患者行PCI 术治疗中辅助ECMO 联合IABP 是一种可行且有益的治疗方案,对提高患者的生存率和改善心功能具有积极作用,值得临床借鉴。

