烟草鸢尾丝囊霉菌的生物学特性及分子检测
李小杰,刘剑君,白静科,刘 畅,陈玉国,苗 圃,邱 睿,陆施羽,李淑君*
烟草鸢尾丝囊霉菌的生物学特性及分子检测
李小杰1,刘剑君2,白静科1,刘 畅1,陈玉国1,苗 圃3,邱 睿1,陆施羽1,李淑君1*
(1.河南省农业科学院烟草研究所,烟草行业黄淮烟区烟草病虫害绿色防控重点实验室,河南 许昌 461000;2.中国烟草总公司河南省公司,郑州 450046;3.河南省烟草公司洛阳市公司,河南 洛阳 471000)
针对近年来河南省许昌、洛阳、三门峡等部分烟区烟草漂浮苗鸢尾丝囊霉根腐病发生较重的问题,采用菌丝生长速率法初步分析了病原菌的生物学特性,并根据NCBI数据库中鸢尾丝囊霉菌代表菌株CBS 524.87的5个编码基因CDS序列,设计筛选鸢尾丝囊霉菌的特异性扩增引物并应用。生物学特性分析结果表明,在PDA培养基上,鸢尾丝囊霉菌菌丝生长的适宜温度为25~35 ℃,致死温度为50 ℃,处理10 min;生长适宜pH为4.0~8.0,最适pH为6.0;连续光照条件有利于菌丝生长。筛选获得了特异性扩增鸢尾丝囊霉菌的引物对7个,对于基因组DNA扩增的灵敏度约为0.182 ng/μL;利用特异引物AiT3分别对接种育苗基质和烟苗进行分子检测,可特异性的检测出鸢尾丝囊霉菌,检测的灵敏度分别为每克基质含菌量为2.5×10-2g病原菌菌丝和0.5 ng/μL烟苗根系基因组DNA。本研究为鸢尾丝囊霉菌的快速分子检测提供了技术支撑,对苗期鸢尾丝囊霉根腐病病原的准确识别和预测预报提供了依据。
烟草;鸢尾丝囊霉;生物学特性;特异引物;分子检测
丝囊霉()属鞭毛菌亚门真菌,是卵菌纲、水霉目、水霉科中的一属,由丝囊霉属真菌引起的植物病害在国内外均有报道[1-8]。由鸢尾丝囊霉()引起的烟草漂浮苗根腐病是烟草上的一种新病害[9],近年来在河南省许昌、洛阳、三门峡等烟区苗床发生较重。目前对该病害及其病原菌的认识水平有限,还不能准确识别并进行及早诊断,导致防治效果不佳,严重影响烟苗质量,给烟草生产带来较大威胁。目前对该病害的检测还停留在传统的病害诊断方法,还未见有关鸢尾丝囊霉分子检测的研究报道。利用PCR及其相关联的RT-qPCR、LNA-qPCR、巢氏PCR等分子技术对植物病害病原菌进行检测的研究报道目前已较多[10-12],其中设计特异性引物是分子检测的关键,肖艳松等[13]以烟草靶斑病菌rDNA-ITS序列为靶标,设计特异性引物Rs-1,建立了靶斑病菌的特异性PCR检测体系;封松利等[14]根据烟草黑胫病菌rDNA-ITS序列,筛选出两对检测引物YYI-F/R和YYH-F/R,能特异性扩增标靶病原菌;李小杰等[15]采用RAPD方法筛选获得了6对可用于烟草青枯病菌PCR检测的特异性引物。
本研究拟对烟草漂浮苗根腐病病原菌鸢尾丝囊霉进行生物学特性分析,筛选特异性扩增引物并对其进行分子检测,以期为病害的早期快速诊断及预测预报提供理论依据。
1 材料与方法
1.1 供试菌株
病原菌鸢尾丝囊霉菌()YW-1由河南省农业科学院烟草研究所植物保护研究室提供并保存。
1.2 鸢尾丝囊霉菌YW-1的生物学特性测定
1.2.1 温度对菌丝生长的影响 参照文献[16]方法,将鸢尾丝囊霉菌饼分别置于25、35、40、45、50 ℃的水浴中加热10 min,接种至PDA平板中央,置于25 ℃光照培养箱中培养,同时以25 ℃恒温培养的鸢尾丝囊霉菌为对照处理,3 d后利用十字交叉法测量各处理的菌落直径。每个处理设置3个重复,每个重复接种3皿。
1.2.2 pH对菌丝生长的影响 参照文献[16]方法,调节PDA培养基pH至4、5、6、7、8、9、10、11、12,将直径为5 mm的鸢尾丝囊霉菌饼接种至不同pH的平板中央,置于25 ℃光照培养箱中培养,3 d后利用十字交叉法测量各处理的菌落直径。每个处理设置3个重复,每个重复接种3皿。
1.2.3 光照时间对菌丝生长的影响 参照文献[16]方法,将直径为5 mm的鸢尾丝囊霉菌饼接至PDA平板中央,将平板置于人工气候培养箱中,25 ℃条件下分别进行连续光照、12 h光照/12 h黑暗、连续黑暗的培养,3 d后利用十字交叉法测量各处理的菌落直径。每个处理设置3个重复,每个重复接种3皿。
1.3 鸢尾丝囊霉菌特异引物设计、筛选与扩增
按照真菌基因组DNA提取试剂盒(Order NO. B518259)说明书方法操作,提取鸢尾丝囊霉菌基因组DNA。从NCBI数据库中下载鸢尾丝囊霉菌代表菌株CBS 524.87的5个编码基因CDS序列(表1),通过Primer-Blast设计鸢尾丝囊霉菌特异引物,引物合成由生工生物(上海)完成。分别以鸢尾丝囊霉菌()、烟草疫霉菌()、烟草交链孢菌()、烟草立枯丝核菌()、烟草胶孢炭疽菌()、烟草拟茎点霉菌(sp.)和烟草尖孢镰刀菌()等7种供试烟草病原菌以及贝莱斯芽孢杆菌Ba-0321的基因组DNA为模板,利用PCR技术筛选出能够特异性扩增鸢尾丝囊霉菌的引物。PCR反应体系:2×Taq PCR Mix 12.5 μL,10 μmol/L正、反向引物各1 μL,基因组DNA 1 μL为模板,超纯水补足至25 μL。PCR扩增条件为:95 ℃预变性5 min;94 ℃变性45 s,59 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃延伸8 min;4 ℃保存。PCR反应结束后,取5 μL扩增产物于1.5%的琼脂糖凝胶中电泳,在BIO-RAD凝胶成像系统上观察、拍照。回收PCR扩增条带,送至生工生物进行测序。
1.4 特异引物检测的灵敏度测定
以鸢尾丝囊霉菌基因组DNA为模板(模板浓度为18.2 ng/μL),并将模板进行101、102、103、104、105、106、107倍稀释。分别吸取1 μL DNA为模板,利用特异引物进行PCR扩增,并进行电泳检测。PCR反应体系和程序同1.3。

表1 鸢尾丝囊霉菌编码基因名称及大小
1.5 接种基质中鸢尾丝囊霉菌的分子检测
将鸢尾丝囊霉置于PDA培养基上,于25 ℃培养箱中培养3 d,将10 g菌丝刮至40 mL无菌水中进行匀浆,以该匀浆液为原液,依次进行10倍梯度稀释,分别得到10-1、10-2、10-3、10-4、10-5、10-6、10-7稀释液。分别吸取10 mL梯度稀释液加入10 g过筛的灭菌基质中,以加无菌水的基质作为空白对照。称取400 mg基质样品,加入等量石英砂,放入自动研磨仪(BIO-DL Easy Extct P型)进行样品的预处理,参照FastDNA® Spin Kit for Soil说明书提取样品总DNA作为模板,利用筛选出的特异引物进行PCR扩增。
1.6 接种烟苗中鸢尾丝囊霉菌的分子检测
采用水培接种法,将生长至4~5片叶的烟苗置于盛有无菌水的50 mL灭菌离心管中,每管放置1株烟苗,以浸没整个根系。缓苗1 d后,每株烟苗根系部位接种一块直径为5 mm的鸢尾丝囊霉菌菌饼,以空白PDA琼脂块为对照处理,每个处理设置3个重复,每个重复接种5株烟苗。分别于接种后1、2、3 d取样检测,具体方法为:将烟苗取出,无菌水冲洗干净后用灭菌滤纸吸干水分,各截取烟苗接种部位的根系0.1 g,利用植物基因组DNA提取试剂盒(CW0531M,康为世纪)提取各处理样品基因组DNA,利用鸢尾丝囊霉菌特异引物进行PCR扩增及灵敏度测定。
1.7 数据分析
利用Excel软件对数据进行统计分析,利用DPS 7.05软件进行差异显著性检验,采用Duncan新复极差法进行多重比较。
2 结 果
2.1 鸢尾丝囊霉菌YW-1的生物学特性
试验结果表明(图1),随着温度的升高,鸢尾丝囊霉菌的生长受到不同程度的抑制。在25~35 ℃之间,鸢尾丝囊霉菌良好生长,处理间无显著差异;超过40 ℃时,菌株生长开始受到抑制,超过50 ℃时,菌株菌丝生长受到完全抑制,菌落直径几乎为0,说明鸢尾丝囊霉菌的致死温度为50 ℃。pH 4.0~8.0范围内,菌株菌丝生长较快,其中pH 6.0时生长最快,pH 9.0~13.0时,菌丝生长逐渐变慢,说明鸢尾丝囊霉菌适宜在偏酸和中性环境中生长(图2)。菌株菌丝生长受光照时间的影响较大,在连续光照条件下生长最快,菌丝直径达7.48 cm,显著高于连续黑暗、12 h光照/12 h黑暗交替处理,说明光照时间越长越有利于该菌株的生长(图3)。

注:图中不同小写字母表示p<0.05水平差异显著;不同大写字母表示p<0.01水平差异显著。下同。

图2 不同pH条件下鸢尾丝囊霉菌丝的生长测定

图3 不同光照条件下鸢尾丝囊霉菌丝的生长测定
2.2 鸢尾丝囊霉菌的特异引物筛选及灵敏度分析
根据鸢尾丝囊霉菌代表菌株strain CBS 524.87的5个编码基因CDS序列,通过NCBI数据库中的Primer-Blast设计出鸢尾丝囊霉菌特异引物7对(表2)。特异性检测结果表明,设计出的7对特异引物均能特异性扩增出鸢尾丝囊霉菌,且条带明亮单一,无杂带(图4)。序列分析结果表明,这7个特异引物对扩增出的DNA片段序列只与NCBI数据库中CBS 524.87的5个编码基因的序列相似性在97%以上,由此表明,所筛选出的7对引物均可用于特异性检测鸢尾丝囊霉菌。
利用筛选出的7个特异引物对,分别以梯度稀释的鸢尾丝囊霉菌基因组DNA为模板进行PCR扩增。结果表明,特异引物AiT1~AiT7检测的灵敏度均可达到10-2的稀释度,即约0.182 ng/μL,其中特异引物AiT3扩增的条带更亮更单一(图5),因此以下试验均选用该引物进行鸢尾丝囊霉的PCR扩增。
2.3 接种基质中鸢尾丝囊霉菌的分子检测
分别从每克基质含菌量为0.25、0.25×10-1、0.25×10-2、0.25×10-3、0.25×10-4、0.25×10-5、0.25×10-6、0.25×10-7g菌丝的基质中提取总DNA,并取1 μL DNA为模板进行特异引物的PCR扩增,结果表明,利用特异引物AiT3可对基质中鸢尾丝囊霉菌进行分子检测,且检测的灵敏度约为每克基质含菌量2.5×10-2g菌丝(图6)。

表2 鸢尾丝囊霉菌的特异引物序列
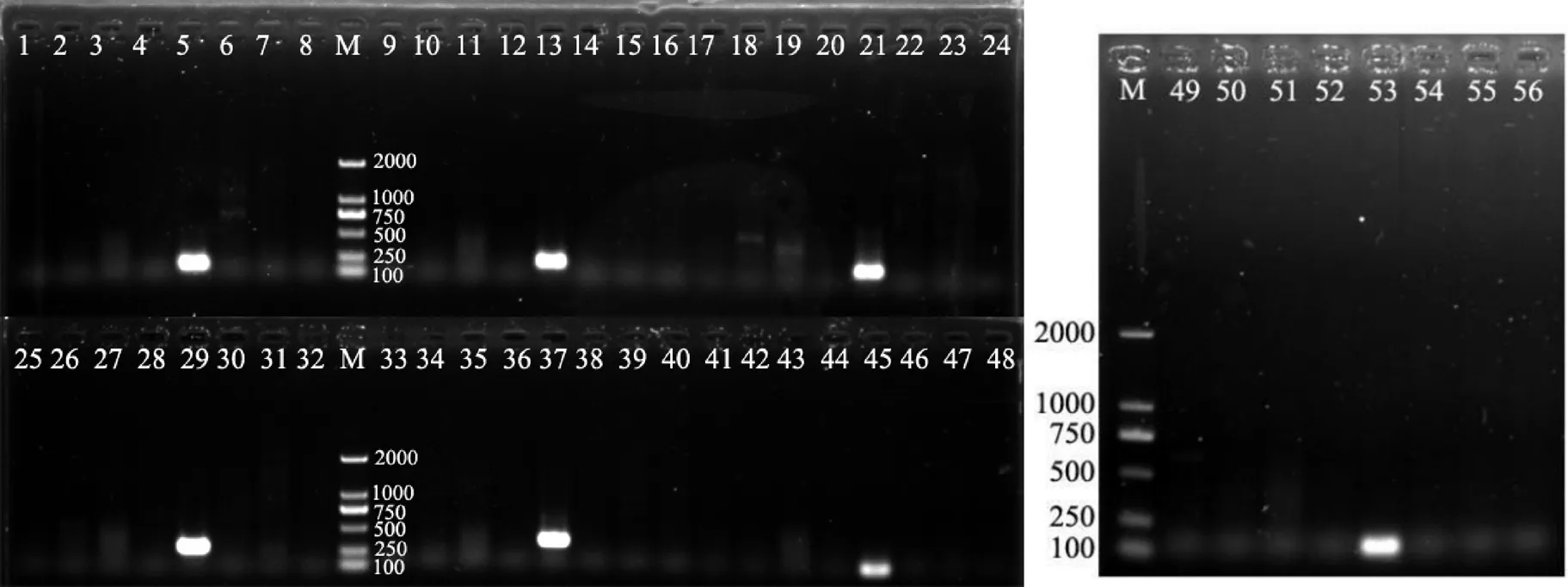
注:M,DL2000 DNA Marker;编号1~8、9~16、17~24、25~32、33~40、41~48、49~56分别为特异引物AiT1、AiT2、AiT3、AiT4、AiT5、AiT6、AiT7的PCR扩增,模板分别为烟草交链孢菌、烟草尖孢镰刀菌、烟草立枯丝核菌、烟草疫霉菌、鸢尾丝囊霉菌、烟草胶孢炭疽菌、烟草拟茎点霉菌、贝莱斯芽孢杆菌Ba-0321基因组DNA。
2.4 接种烟苗中鸢尾丝囊霉菌的分子检测
接种鸢尾丝囊霉菌YW-1后1 d,烟苗未表现出发病症状。接种后2 d,烟苗根系出现轻微变褐,但叶片健康且未萎蔫。接种后3 d,烟苗根系严重变褐且出现腐烂现象,叶片变黄萎蔫(图7a、b)。利用特异引物AiT3进行PCR扩增,结果表明,接种后1 d在接种烟苗根系和空白对照中均未检测出鸢尾丝囊霉菌,接种2 d后,在接种烟苗根系中均能够检测出鸢尾丝囊霉菌,而对照中均未检测出该病原菌(图7c)。分别以梯度稀释的烟苗根系基因组DNA为模板进行PCR扩增,结果表明,特异引物AiT3检测的灵敏度可达到10-2的稀释度,即约0.5 ng/μL(图7d)。以上结果说明,筛选出的特异引物AiT3可用于烟苗组织中鸢尾丝囊霉菌的快速检测。

注:M,DL2000 DNA Marker;编号1~8、9~16、17~24、25~32、33~40、41~48、49~56分别为特异引物AiT1、AiT2、AiT3、AiT4、AiT5、AiT6、AiT7的PCR扩增,模板分别为鸢尾丝囊霉菌基因组DNA的10、10-1、10-2、10-3、10-4、10-5、10-6、10-7稀释液。

注:M,DL2000 DNA Marker;编号1~9分别为空白对照、每克基质含菌量为0.25、0.25×10-1、0.25×10-2、0.25×10-3、0.25×10-4、0.25×10-5、0.25×10-6、0.25×10-7 g菌丝的基质总DNA。
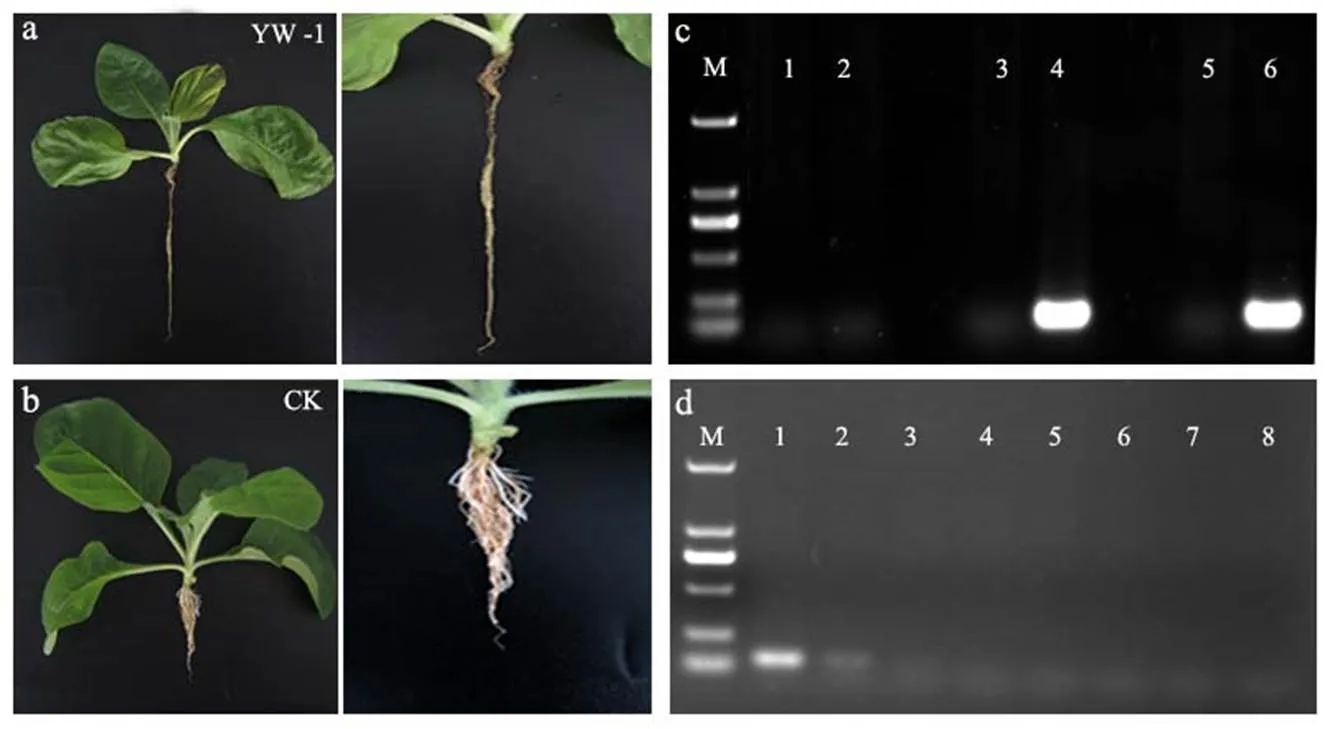
注:a,接种鸢尾丝囊霉菌后3 d烟苗及根系发病情况;b,空白对照;c,泳道1、3、5为空白对照,2、4、6分别为接种后1、2、3 d;d,泳道1~8分别为烟苗根系基因组模板DNA的10、10-1、10-2、10-3、10-4、10-5、10-6、10-7稀释液;M为DL2000 DNA Marker。
3 讨 论
目前国内外关于植物病原丝囊霉菌生物学特性的研究报道较少,李敏权等[8]研究表明甜菜黑腐丝囊霉()在PDA培养基上的最适生长温度为25~27 ℃,33 ℃为其致死温度,最适pH为5.0~9.9;唐德志等[17]报道了豌豆丝囊根腐霉()菌丝在CMA培养基上的生长适温为28~32 ℃,40 ℃不能生长;有研究发现,鸢尾丝囊霉()卵孢子在玉米粉汤(CMD)或福氏定殖液(FDL)培养基上的最适萌发温度为25 ℃,最适pH为6.4,但未报道其致死温度[18]。本研究表明引起烟草漂浮苗根腐病的鸢尾丝囊霉菌在PDA培养基上的适宜生长温度为25~35 ℃,致死温度为50 ℃,高于已报道的其他丝囊霉属真菌的致死温度,这可能与菌种或使用的培养基不同有关。鸢尾丝囊霉菌生长适宜的pH在4.0~8.0之间,表明该菌比较适宜在偏酸和中性环境中生长,与前人研究基本一致[8,18]。
本研究首次利用生物信息学和分子生物学方法设计并筛选出能够特异性扩增鸢尾丝囊霉菌的引物对7个,灵敏度可达0.182 ng/μL鸢尾丝囊霉菌基因组DNA。筛选出的特异引物可用于育苗基质和烟草组织中鸢尾丝囊霉菌的快速分子检测,检测的灵敏度分别为每克基质含菌量为2.5×10-2g病原菌菌丝和0.5 ng/μL烟苗根系基因组DNA,该研究结果为烟草鸢尾丝囊霉的快速分子检测提供了基础和技术支撑,弥补了丝囊霉分子检测的空白。有研究表明,影响PCR检测灵敏度的因素有靶序列的拷贝数、模板的纯度、PCR反应体系等[19],在模板量相同的情况下,高拷贝片段相对于单拷贝更易扩增出来,且模板的纯度越高、质量越好,扩增的灵敏度也就越高。因此,下一步将对PCR扩增模板、反应体系等条件进行优化,以提高对鸢尾丝囊霉分子检测的灵敏度。同时研究定量PCR技术在该病害分子检测中的应用,从而实现对该病害发生与流行的准确预测预报。
4 结 论
本研究针对近年来河南省许昌、洛阳、三门峡等烟区烟草漂浮苗鸢尾丝囊霉根腐病发生较重的问题,明确了病原鸢尾丝囊霉菌的最适生长温度为25~35 ℃,致死温度为50 ℃,最适pH为6.0。设计并筛选出特异性扩增鸢尾丝囊霉菌的引物对7个,建立了鸢尾丝囊霉菌的分子检测技术,灵敏度可达0.182 ng/μL病原菌基因组DNA,实现了对育苗基质和烟苗中鸢尾丝囊霉的快速检测,为烟草苗期鸢尾丝囊霉根腐病病原的准确识别和预测预报提供了重要依据。
[1] WEIMER J L. Root rot of austrian winter peas and vetches[J]. Phytopathology, 1940, 30(8): 708-711.
[2] ICHITANI T, KODAMA T, HORIMOTO K, et al.sp. nov. causing Aphanomyces basal rot of Dutch iris in Japan[J]. Annals of the Phytopathological Society of Japan, 1986, 52(4): 590-598.
[3] JONES F R, DRECHSLER C. Root rot of peas in the United States caused by(N. sp.)[J]. Journal of Agricultural Research, 1925, 30: 293-325.
[4] WICKER E, MOUSSART A, DUPARQUE M, et al. Further contributions to the development of a differential set of pea cultivars () to investigate the virulence of isolates of[J]. European Journal of Plant Pathology, 2003, 109(1): 47–60.
[5] 陈庆河,翁启勇,何玉仙,等. 福建省豌豆根腐病病原及致病性研究[J]. 福建农业学报,2004,19(1):28-31.
CHEN Q H, WENG Q Y, HE Y X, et al. Pathogeny and pathogenicity of root disease of peas in Fujian province[J]. Fujian Journal of Agricultural Sciences, 2004, 19(1): 28-31.
[6] 刁治民. 青海豌豆根腐病病原菌种类及致病性的研究[J]. 微生物学杂志,1996(1):31-34.
DIAO Z M. Study on the pathogen and pathogenicity of root disease of peas in Qinghai[J]. Journal of Microbiology, 1996(1): 31-34.
[7] 唐德志,何苏琴,李玉奇,等. 甘肃豌豆根病的病原菌种类及致病力研究[J]. 西北农业学报,1993,2(2):37-39.
TANG D Z, HE S Q, LI Y Q, et al. Study on the pathogen and pathogenicity of root disease of peas in Gansu[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 1993, 2(2): 37-39.
[8] 李敏权,林淑洁,徐秉良,等. 影响甜菜黑腐丝囊霉的几种生态学和生物学因子[J]. 应用与环境生物学报,2003,9(2):183-185.
LI M Q, LIN S J, XU B L, et al. Ecological and biological factors affecting[J]. Journal of applied and Environmental Biology, 2003, 9(2): 183-185.
[9] 李小杰,李淑君,李成军,等. 鸢尾丝囊霉()引起的烟草漂浮苗根腐病的初步报道[J]. 中国烟草学报,2018,24(2):125-128.
LI X J, LI S J, LI C J, et al. Preliminary report on tobacco seedling root rot induced byin floating bed[J]. Acta Tabacaria Sinica, 2018, 24(2): 125-128.
[10] 莫瑾,王哲,周慧平,等. 利用多重PCR技术快速检测4种水稻病原细菌[J]. 植物保护,2021,47(3):160-164.
MO J, WANG Z, ZHOU H P, et al. A multiplex PCR rmethod for rapid detection of four rice pathogenic bacteria[J]. Plant Protection, 2021, 47(3): 160-164.
[11] 程承,李石力,刘颖,等. 试验土壤中烟草青枯病菌的RT-qPCR检测分析[J]. 烟草科技,2017,50(1):12-16.
CHENG C, LI S L, LIU Y, et al. RT-qPCR detection and quantitative analysis ofin soil[J]. Tobacco Science & Technology, 2017, 50(1): 12-16.
[12] 陈杰,朱天辉. 核桃枝枯病小新壳梭孢巢式PCR检测方法的建立[J]. 植物保护,2018,44(3):124-129,162.
CHEN J, ZHU T H. Establishment of nested PCR method for detecting the branch dieback of walnut caused by[J]. Plant Protection, 2018, 44(3): 124-129,162.
[13] 肖艳松,钟权,吴文信,等. 湖南烟草靶斑病的病原鉴定及分子检测[J]. 湖南农业大学学报(自然科学版),2020,46(6):711-715.
XIAO Y S, ZHONG Q, WU W X, et al. Pathogen identification and molecular detection of tobacco target spot in Hunan Province[J]. Journal of Hunan Agricultural University (Natural Sciences), 2020, 46(6): 711-715.
[14] 封松利. 河南省烟草黑胫病菌和根黑腐病菌群体遗传多样性分析及分子检测体系的建立[D]. 郑州:河南农业大学,2014..
FENG S L. Population genetic diversity and molecular detection ofandin Henan Province[D]. Zhengzhou: Henan Agricultural University, 2014.
[15] 李小杰,刘畅,李成军,等. 基于RAPD分子标记的烟草青枯病菌特异引物筛选及效果评价[J]. 中国烟草学报,2021,27(2):72-78.
LI X J, LIU C, LI C J, et al. Screening and evaluation of specific primers forbased on RAPD technology[J]. Acta Tabacaria Sinica, 2021, 27(2): 72-78.
[16] 张琳,彭琳,邵郅伟,等. 南瓜炭疽病菌生物学特性及药剂防治[J]. 植物保护,2021,47(4):59-65.
ZHANG L, PENG L, SHAO Z W, et al. Biological characteristics and indoor fungicide screening ofcausing pumpkin anthracnose[J]. Plant Protection, 2021, 47(4): 59-65.
[17] 唐德志,何苏琴,李玉奇,等. 甘肃豌豆丝囊根腐病及其病原鉴定[J]. 植物保护,1991(4):4-5.
TANG D Z, HE S Q, LI Y Q, et al. Pathogen identification of root rot on pea in Gansu Province[J]. Plant Protection, 1991(4): 4-5.
[18] ICHITANI T, HIGASHIKAWA T. Germination ofoospores on the basal medium for selective isolation with addition of bactericides and fungicides[J]. Proceedings of the Kansai Plant Protection Society, 1986(28): 19-24.
[19] 王晓杰,康振生,黄丽丽. PCR技术在植物病害检测中的应用[J]. 云南农业大学学报,2005(2):179-182.
WANG X J, KANG Z S, HUANG L L. Application of PCR technology on the detection of plant disease[J]. Journal of Yunnan Agricultural University, 2005(2): 179-182.
Biological Characteristics and Molecular Detection ofHarmful to Tobacco Seedlings
LI Xiaojie1, LIU Jianjun2, BAI Jingke1, LIU Chang1, CHEN Yuguo1, MIAO Pu3, QIU Rui1, LU Shiyu1, LI Shujun1*
(1. Tobacco Research Institute of Henan Academy of Agricultural Sciences, Key Laboratory for Green Preservation & Control of Tobacco Diseases and Pests in Huanghuai Growing Area, Xuchang, Henan 461000, China; 2. Henan Provincial Tobacco Company, Zhengzhou 450046, China; 3. Luoyang Branch of Henan Provincial Tobacco Company, Luoyang, Henan 471000, China)
In view of the serious occurrence of root rot caused byin tobacco seedling bed of Henan Province in recent years, this study was carried out to clarify the biological characteristics of the pathogen and fro rapid detection at early stages. The biological characteristics of the pathogen were studied with the mycelial growth rate method, and specific amplification primers forwere designed and screened for application based on the CDS sequences of five coding genes of the representative strain CBS 524.87 in NCBI database. The results showed that the suitable temperature for mycelium growth ofwas 25-35 ℃on PDA plates, and the lethal temperature was 50 ℃ for 10 min. The suitable pH forgrowth was 4.0-8.0 and the optimum pH was 6.0. Continuous light was beneficial to mycelium growth for. Seven pairs of primers were designed and screened for the specific amplification of, and the sensitivity to genomic DNA amplification was about 0.182 ng/μL.could be specifically detected by the specific primer pair AiT3 for molecular detection of inoculated seedling substrate and tobacco seedlings respectively, with the detection sensitivity being 2.5×10-2g hyphae of per gram of substrate and 0.5 ng/μL tobacco seedling root genomic DNA. The results of this study provide technical support for the rapid molecular detection of, and provide an important basis for the accurate identification and prediction of root rot caused byat seedling stages.
tobacco;; biological characteristics; specific primers; molecular detection
10.13496/j.issn.1007-5119.2022.06.008
S435.72
A
1007-5119(2022)06-0053-07
河南省农业科学院科技创新团队专项项目(2022TD26);河南省烟草公司科技项目(2022410000240018)
李小杰(1983-),女,博士,助理研究员,主要研究方向为烟草病理学。E-mail:lixiaojie000631@sina.com
,E-mail:13603749396@126.com
2022-03-31
2022-08-19

