不同烤烟品种对青枯病胁迫的生理响应及抗性分析
姜淑祯,宋文静,杨 波,王卫锋,冯小虎,张 燕,况 帅,徐艳丽,董建新*
不同烤烟品种对青枯病胁迫的生理响应及抗性分析
姜淑祯1,2,宋文静1,杨 波3,王卫锋1,冯小虎4,张 燕1,2,况 帅1,徐艳丽1,董建新1*
(1.中国农业科学院烟草研究所,农业部烟草生物学与加工重点实验室,中国农业科学院青岛烟草资源与环境野外科学观测试验站,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.山东临沂烟草有限公司平邑分公司,山东 平邑 273300;4.江西省烟草公司抚州市公司,江西 抚州 344000)
为明确不同抗性烤烟品种(系)对青枯病侵染的响应机制,以抗病品种(系)岩烟97、G80、633K和易感品种翠碧一号、红花大金元为材料,通过盆栽试验研究了青枯菌侵染胁迫下不同抗性烤烟品种(系)发病情况、生物量、激素、丙二醛(MDA)含量及抗氧化酶系活性的变化。结果表明,易感品种的发病率和病情指数高于抗病品种,红花大金元和翠碧一号的发病率和病情指数分别达到80%、68.89和70%、41.11;与未接种青枯菌烟株(CK)相比,接菌后所有品种(系)的生物量和丙二醛(MDA)含量均显著下降,抗病品种(系)生物量降幅均显著小于易感品种,633K生物量降幅最小为37.47%,红花大金元降幅最大为84.01%。抗病品种(系)MDA含量降幅均显著大于易感品种,633K降幅最大为45.67%,红花大金元降幅最小为13.02%;各品种受青枯菌胁迫后超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均显著提高,抗病品种(系)的增幅大于易感品种;抗病品种(系)的茉莉酸(JA)和水杨酸(SA)含量均显著增加,易感品种SA含量显著增加,而JA含量显著降低。在青枯菌侵染胁迫下,抗病品种能够更有效地响应青枯菌侵染胁迫并作出应答,以此来抵御病原菌的侵染。
烤烟;青枯雷尔氏菌;烟草青枯病;丙二醛;抗氧化酶系;内源激素
烟草青枯病是我国植烟区最严重的土传病害之一,严重影响烟叶产质量,这其中作用最强的病原菌为青枯雷尔氏菌()[1]。遭受病原菌侵染胁迫的植株细胞内活性氧含量增加,得不到及时清除的活性氧会超量积累从而使细胞产生有毒物质丙二醛(MDA),破坏细胞膜结构并使其丧失功能。而植物体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶活性的增加可有效清除逆境产生的活性氧自由基,达到抵御病原菌侵染的效果,相关研究显示这一机制与植物的抗病性相关[2-4]。同时,植物内源激素水杨酸(SA)与茉莉酸(JA)可作为介导植物胁迫反应的关键内源因子,参与抵御病原菌的侵染,在针对病原菌的防卫反应中起着重要作用[5]。
国内外学者开展了一系列作物抗性与抗氧化酶及激素之间关系的研究。欧秀玲等[6]指出MDA含量可以作为鉴定棉花黄萎病抗性的生理生化指标;陈卓[7]和KASHYAP等[8]的试验表明,SOD、CAT和POD均参与抗青枯病反应,认为POD和SOD水平与青枯菌的诱导抗性呈正相关。在植物防御反应过程中JA和SA具有重要作用[9],王鹏飞等[10]和TAKAHASHI等[11]报道了茄科作物中SA和JA参与抗青枯病相关过程的调控,发现SA信号和JA信号在诱导青枯菌的抗性中起关键作用;DANG等[12]和LIU等[13]研究表明通过调节SA和JA介导的信号通路,可增强烟草对青枯菌的抗性。
近年来随着作物对抗逆性响应机制研究的不断增加,有关青枯病抗性机理的研究逐渐成为热点,目前,相关研究对烟草青枯病复杂的抗性机制解析仍然不够深入,往往局限于单一品种。本试验研究了具有不同青枯菌抗性的烤烟品种(系)在受到青枯雷尔氏菌侵染时,其表型特征、MDA含量、激素水平和抗氧化酶活性的响应程度,旨在明确不同抗性品种(系)对青枯菌特异性侵染的生理响应差异,为后续烟草青枯病抗性机理的研究奠定基础。
1 材料与方法
1.1 试验时间及地点
试验于2021年6月在中国农业科学院烟草研究所即墨烟草试验基地人工气候室进行,温度28 ℃,相对湿度70%,日照8 h。
1.2 试验材料
供试菌种青枯菌从福建省三明市明溪县益洋村发病烟田分离得到。
1.3 烟草青枯病病原菌液制备
1.3.1 供试培养基和主要试剂 NA液体培养基:葡萄糖10 g,蛋白胨5 g,牛肉膏3 g,酵母粉0.5 g,加去离子水定容至1000 mL,105 ℃灭菌30 min。
SMSA固体培养基:250 mL NA液体培养基中加入1%氯霉素125 mL,1%青霉素125 mL,1%结晶紫125 mL,1%放线菌酮2.5 mL,1%多粘菌素2.5 mL,1% TTC 1.25 mL。
无水乙醇,无菌水。
1.3.2 供试菌株培养和菌液制备 菌株的活化:将保存于常温条件下的SMGY6-2菌种在SMSA固体培养基上活化,然后置于30 ℃恒温培养箱中培养,直至出现单菌落。
菌株菌液的制备:待平板上长出单菌落后,挑取平板上的单菌落至灭菌的NA液体培养基中,在28 ℃、转速180 r/min的恒温摇床上培养至600=1.5。
1.4 育苗及接种处理
选取供试的健康烟草种子若干,播种于灭菌的基质育苗盘,待幼苗长至3叶1心时,分苗于66孔的基质育苗穴盘中培养。在温室大棚进行烟苗移栽,将长势相近的幼苗移栽至装有6 kg土壤(含0.11%N、0.11%P2O5、0.33%K2O)的盆中。待烟苗长至团棵后期时,采用伤根菌液灌注法接种600=1.5的菌液220 mL。
1.5 试验设计
选取易感青枯病烤烟品种红花大金元(HD)、翠碧一号(CB)和抗青枯病烤烟品种(系)633K、G80、岩烟97等5个品种(系)作为试验材料,每个品种设置未接种青枯菌(CK)和接种青枯菌(PSI)2个处理,每个处理各30株,在团棵后期进行接种处理,每7天拍照1次并记录长势变化,总计4次,于第28天取样保存,采集PSI处理抗病品种(系)健康植株中部叶片和感病品种发病植株中部叶片,同时采集CK处理所有品种中部叶片,分别将叶片放入不同的密封袋中并做好标记,立即放入液氮,置于−80 ℃的冰箱保存。
1.6 测定项目及方法
按标准《烟草病虫害分级及调查方法》(GB/T 23222—2008)[14]对单株烟株进行病情分级;生物量:烟株采样分根、茎和叶片3部分,105 ℃杀青30 min,70 ℃烘干至恒质量后称量;MDA含量测定方法采用硫代巴比妥酸法,参考况帅等[3]的方法测定;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性、总抗氧化活性(T-AOC)、茉莉酸(JA)和水杨酸(SA)的测定分别按照苏州科铭生物技术有限公司生产的相应试剂盒说明书方法进行测定。
1.7 数据分析
数据处理与分析及作图采用Excel 2010和Origin 2021软件, SPSS 26.0进行统计分析,采用单因素ANOVA算法进行方差分析,判断显著性差异(<0.05)。
2 结 果
2.1 不同抗性烤烟品种(系)接种青枯菌后的发病情况
如表1所示,易感品种红花大金元和翠碧一号的发病率和病情指数均高于抗病品种(系)633K、G80和岩烟97。红花大金元的病情指数和发病率最高,分别为68.89、80%;抗病品种(系)中,633K和G80没有发病。
青枯菌胁迫处理28 d后,易感品种翠碧一号和红花大金元都出现了明显的叶片萎蔫现象,红花大金元的病情指数更高;抗病品种(系)岩烟97、G80和633K的植株均可正常生长。
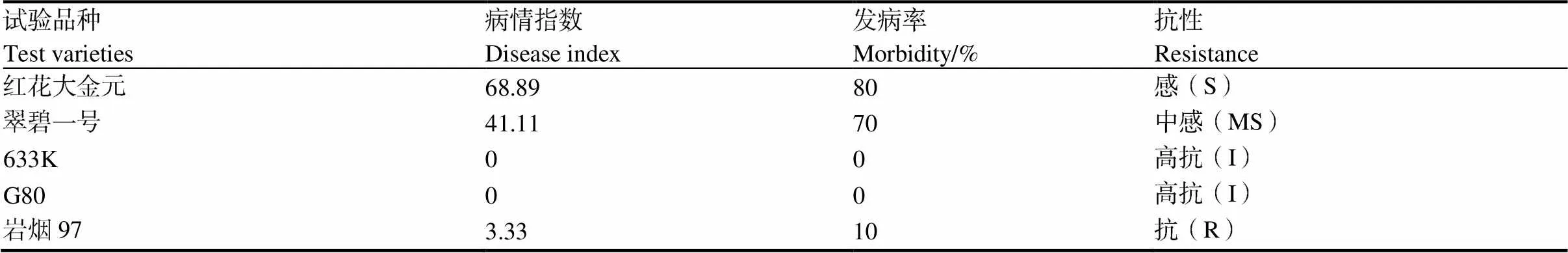
表1 青枯菌胁迫下不同品种发病情况
2.2 青枯菌胁迫对不同抗性烤烟品种(系)生物量的影响
由图1可知,处理28 d时,与未接种病菌烟株相比,青枯菌胁迫处理条件下,所有品种植株生物量均显著降低。抗病品种(系)降低幅度均小于易感品种;易感品种中,红花大金元生物量的降低幅度最大,为84.01%;抗病品种(系)中,633K的降低幅度最小,为34.47%。
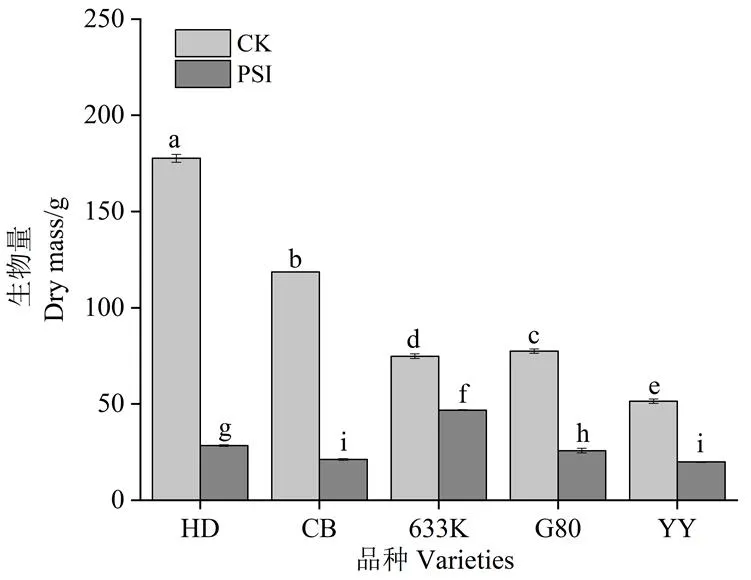
注:处理间小写字母不同表示组间差异有统计学意义(p<0.05)。HD,红花大金元;CB,翠碧一号。下同。
2.3 青枯菌胁迫对不同抗性烤烟品种(系)MDA含量的影响
由图2可知,处理28 d时,与未接种病菌烟株相比,在青枯菌胁迫处理条件下所有品种的MDA含量均显著下降。抗病品种(系)MDA含量的降幅均大于易感品种;易感品种红花大金元和翠碧一号中MDA含量的降幅分别为13.02%和24.55%;抗病品种(系)633K、G80、岩烟97中MDA含量降幅分别为45.67%、25.05%、28.50%。结果表明,抗病品种(系)能够通过减少MDA的含量更快地适应青枯菌胁迫并做出应答,提高抗病能力。抗病品种(系)633K降幅最大,易感品种红花大金元降幅最小。

图2 青枯菌胁迫对烟株MDA含量的影响
2.4 青枯菌胁迫对不同抗性烤烟品种(系)抗氧化酶活性的影响
由图3可知,处理28 d时,与未接种病菌烟株相比,在青枯菌胁迫处理条件下,除易感品种红花大金元外,其余品种的总抗氧化能力均显著降低,抗、感品种SOD、POD、CAT活性均显著提高。抗病品种(系)抗氧化酶系活性的变化幅度总体大于易感品种。易感品种中,红花大金元的SOD、POD、CAT活性增幅最小,分别为13.01%、59.00%、28.30%,总抗氧化活性(T-AOC)的降幅为2.88%;抗病品种(系)中,633K抗氧化酶活性增幅最大,SOD、POD、CAT活性的增幅分别为122.17%、130.12%、76.74%,T-AOC降幅为66.52%。
2.5 青枯菌胁迫对不同抗性烤烟品种(系)激素含量的影响
由图4可知,处理28 d时,与未接种病菌烟株相比,在青枯菌胁迫处理条件下抗病品种(系)的SA和JA含量均显著增加,其中,SA增幅最大的品种是633K,为331.08%,JA增幅最大的品种是岩烟97,为141.82%。易感品种SA含量均显著增加,增幅最小的品种是红花大金元,为365.48%,JA含量均显著降低,降幅最大的品种是红花大金元,为21.74%。
3 讨 论
MDA是膜脂过氧化分解的产物,通过对细胞膜产生伤害来加速病原菌的入侵,与植物抗逆性有密切联系[15-16]。本试验的研究结果表明,与未接菌处理相比,在青枯菌侵染处理条件下,各试验品种的MDA含量均显著降低,抗性品种(系)MDA含量的降低幅度均大于易感品种,表明在面对病原菌侵染胁迫时,各品种均可通过降低MDA含量来增加抗逆性,抗性品种(系)对MDA的清除更有效,这与代颖等[17]的研究相同。但孔祥华等[18]和刁倩楠等[19]的研究发现,接种病原菌后,抗、感病品种(系)的MDA含量较未接菌处理都有所提高,这与本试验结果不同,可能是由于植株所处的侵染时期不同导致的。相关研究[20-21]显示,在面对病原菌侵染胁迫时,各时期植物体内的MDA含量是不同的,呈现先上升后下降的趋势,侵染后期含量显著降低。
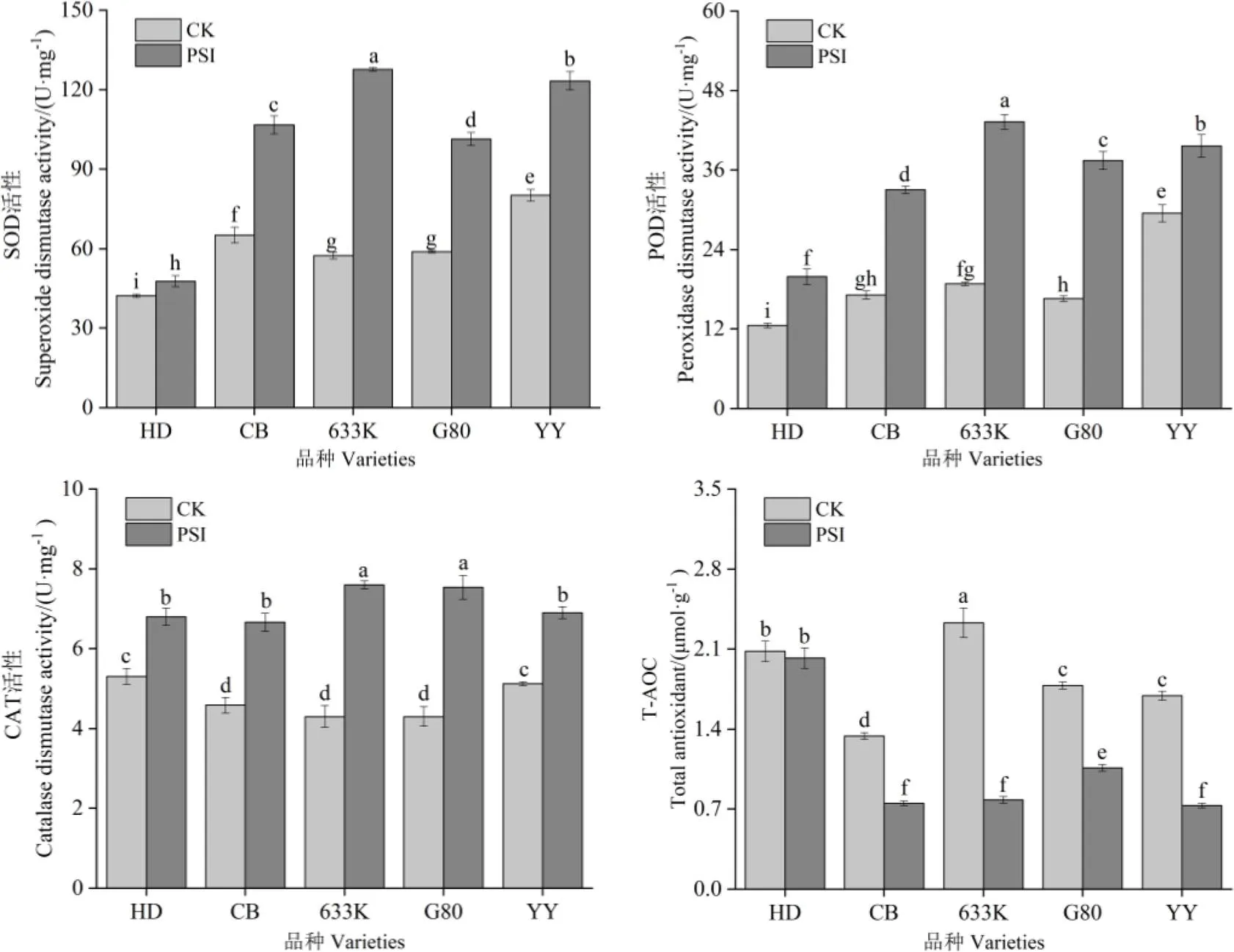
图3 青枯菌胁迫对烟株SOD、POD、CAT活性和总抗氧化活性的影响
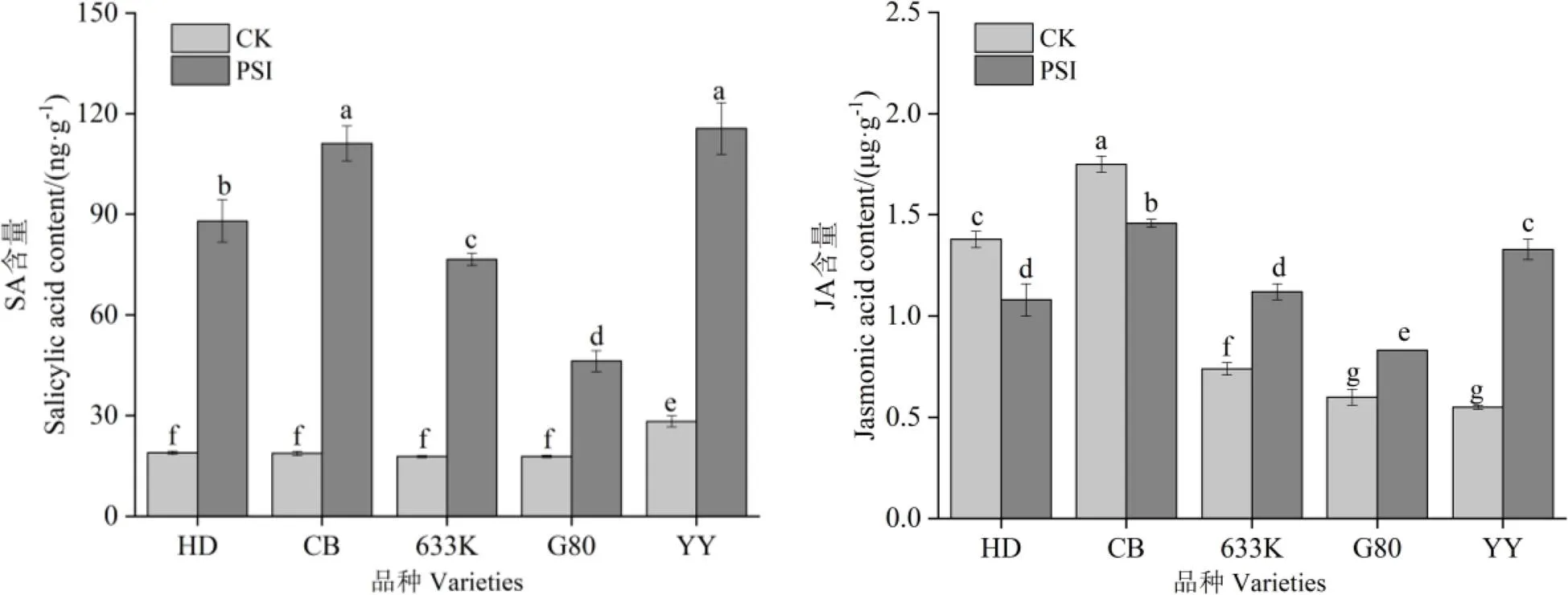
图4 青枯菌胁迫对烟株茉莉酸和水杨酸含量的影响
植物的防卫反应是在多种酶催化下的一系列复杂的生理生化反应,与植物的抗病性有着密切关系,SOD、POD、CAT等抗氧化酶是衡量植物体内防卫反应的重要指标[22-23]。林霞[24]和李淼等[25]研究发现,SOD、POD、CAT在抗病中具有重要作用,与抗病能力呈正相关。本试验的研究结果表明,在青枯菌胁迫下,抗、感病品种(系)的SOD、POD、CAT活性较未接菌处理都显著提高,但易感品种SOD、POD、CAT活性增加幅度普遍低于抗病品种(系),与陈亮等[26]和耿莉娜等[27]的研究结果一致。这表明植物在受到病原菌入侵时三者会协同工作,以此来提高自身的抗性。但是,各品种总抗氧化能力有所下降,其原因和机理有待进一步研究。
JA和SA与植物病害防御有着密切关系,病原菌入侵后,它们参与抗病过程并诱导植物的系统抗性[28]。SA及类似物本身无杀菌活性,主要是通过激活植物抗性反应,诱导POD、谷胱甘肽过氧化物酶(GPX)等活性的应激变化,使植物对细菌和病毒类产生系统抗性[29-30];JA参与了生物和非生物胁迫等重要的生物学过程,诱导了植株防御反应的关键物质合成,包括查尔酮合成酶(CHS),过氧化氢酶(CAT)等系列防御蛋白酶,参与抗性反应,此外,在植株受到细菌和真菌侵染时,诱导植物质膜ATP等生理指标形成防御结构,实现植株内源防御信号传导[29]。本试验研究发现,青枯菌的入侵导致抗、感病品种(系)的SA含量显著增加,抗病品种(系)JA含量显著增加,但感病品种JA含量显著减少。有关植物激素SA和JA在烟草中响应青枯病入侵的响应机制还有待进一步研究。
4 结 论
研究表明,综合表型特征和发病情况,红花大金元抗性最弱,633K抗性最强。青枯病侵染胁迫下,抗病品种(系)生物量降幅均显著小于易感品种,MDA含量降幅均显著大于易感品种,除岩烟97外,其他抗病品种(系)的SOD、POD、CAT酶活性增幅均显著大于易感品种,JA含量显著升高,表明抗病品种(系)的应答响应可以更加有效地抵御青枯菌的侵染。
[1] 陈进,魏凯. 烟草青枯病防治技术研究现状[J]. 农业与技术,2017,37(20):35.
CHEN J, WEI K. Research status of tobacco bacterial wilt control technology[J]. Agriculture and Technology, 2017, 37(20): 35.
[2] 漆永红,曹素芳,李雪萍,等. 燕麦镰孢菌侵染对不同抗性青稞叶片及根系生理指标的影响[J]. 中国农学通报,2019,35(32):101-107.
QI Y H, CAO S F, LI X P, et al. Fusarium avenaceum infection: effects on physiological indexes of leaves and roots of naked barley with different resistance[J]. Chinese Agricultural Science Bulletin, 2019, 35(32): 101-107.
[3] 况帅,冯迪,宋科,等. 低钾胁迫对烟草幼苗活性氧及抗氧化酶系统的影响[J]. 中国烟草学报,2018,24(2):48-54.
KUANG S, FENG D, SONG K, et al. Effects of low potassium stress on reactive oxygen species and antioxidant enzyme system in tobacco seedlings[J]. Acta Tabacaria Sinica, 2018, 24(2): 48-54.
[4] 赵永长,宋文静,董建新,等. 黄腐酸钾对干旱胁迫下烤烟幼苗活性氧代谢的影响[J]. 中国烟草科学,2017,38(4):29-36.
ZHAO Y C, SONG W J, DONG J X, et al. Effects of fulvic acid potassium on reactive oxygen metabolism of flue-cured tobacco seedlings grown under drought stress[J]. Chinese Tobacco Science,2017, 38(4): 29-36.
[5] 张明菊,朱莉,夏启中. 植物激素对胁迫反应调控的研究进展[J]. 湖北大学学报(自然科学版),2021,43(3):242-253,263.
ZHANG M J, ZHU L, XIA Q Z. Research progress on the regulation of plant hormones to stress responses[J]. Journal of Hubei University(Natural Science), 2021, 43(3): 242-253, 263.
[6] 欧秀玲,耿雅文,李凤,等. 棉花黄萎病病原菌诱导侵染对转基因抗病棉花生理性状的影响[J]. 生物技术通报,2013(6):94-98.
OU X L, GENG Y W, LI F, et al. Effects of induced infection of verticillium dahliae on physiological characters of transgenic cotton resistant to verticillium wilt[J].Biotechnology Bulletin, 2013(6): 94-98.
[7] 陈卓. 利用转录组解析马铃薯抗青枯病机理[D]. 黑龙江:八一农垦大学,2021.
CHEN Z. Analysis of potato resistance to bacterial wilt by transcriptome[D]. Heilongjiang: Bayi Agricultural Reclamation University, 2021.
[8] KASHYAP A, MANZAR N, RAJAWAT M, et al. Screening and biocontrol potential of Rhizobacteria native to gangetic plains and hilly regions to induce systemic resistance and promote plant growth in chilli against bacterial wilt disease[J]. Plants, 2021, 10(10): 2125-2125.
[9] JIANG N, FAN X, LIN W, et al. Transcriptome analysis reveals new insights into the bacterial wilt resistance mechanism mediated by silicon in tomato[J].International Journal of Molecular Sciences, 2019, 20(3): 761.
[10] 王鹏飞,王月华,胡子滢,等. 野生花生基因的克隆及表达分析[J]. 山东农业科学,2017,49(6):1-6.
WANG P F, WANG Y H, HU Z Y, et al. Cloning and expression analysis ofgene in wild peanut[J]. Shandong Agricultural Sciences, 2017, 49(6): 1-6.
[11] TAKAHASHI H, NAKAHO K, ISHIHARA T, et al. Transcriptional profile of tomato roots exhibitingthuringiensis-induced resistance to[J]. Plant Cell Reports, 2014, 33(1): 99-110.
[12] DANG F F, WANG Y N, SHE J J, et al. Overexpression of CaWRKY27, a subgroup IIe WRKY transcription factor of, positively regulates tobacco resistance toinfection[J]. Physiologia Plantarum, 2014, 150(3): 397-411.
[13] LIU Q P, LIU Y, TANG Y M, et al. Overexpression of NtWRKY50 increases resistance toand alters salicylic acid and jasmonic acid production in tobacco[J]. Frontiers in Plant Science, 2017, 8: 1710.
[14] 丁昂,谷从纪,衣盛月,等. 烟草黑胫病菌生理小种判别及鉴别寄主的筛选[J]. 昆明学院学报,2021,43(6):6-11.
DING A, GU C J, YI S Y, et al. Identification of physiological races ofvar.and screening of differential hosts[J]. Journal of Kunming University, 2021, 43(6): 6-11.
[15] 赵秀娟,唐鑫,程蛟文,等. 酶活性、丙二醛含量变化与苦瓜抗枯萎病的关系[J]. 华南农业大学学报,2013,34(3):372-377.
ZHAO X J, TANG X, CHENG J W, et al. Relationship between enzyme activity, malondialdehyde content and resistance towilt of momordica charantia[J].Journal of South China Agricultural University, 2013, 34(3): 372-377.
[16] 单长卷,赵新亮,汤菊香. 水杨酸对干旱胁迫下小麦幼苗抗氧化特性的影响[J]. 麦类作物学报,2014,34(1):91-95.
SHAN C J, ZHAO X L, TANG J X. Effects of exogenous salicylic acid on antioxidant properties of wheat seedling under drought stress[J]. Journal of Triticeae Crops, 2014, 34(1): 91-95.
[17] 代颖,杨雅馨,廖鑫,等. 尖孢镰孢菌侵染后大豆的生理生化指标检测[J]. 西南大学学报(自然科学版),2021,43(1):81-86.
DAI Y, YANG Y X, LIAO X, et al. Detection of physiological and biochemical indexes of soybean infected by[J]. Journal of Southwest University(Natural Science Edition), 2021, 43(1): 81-86.
[18] 孔祥华,侯董亮,张伟,等. 炭疽叶枯病菌诱导的不同苹果种质中防御酶活性及丙二醛含量比较[J]. 青岛农业大学学报(自然科学版),2017,34(1):5-8.
KONG X H, HOU D L, ZHANG W, et al. Comparison of defensive enzymes activities and malonaldehyde content induced byamong different apple resources[J]. Journal of Qingdao Agricultural University(Natural Science), 2017, 34(1): 5-8.
[19] 刁倩楠,曹燕燕,蒋雪君,等. 白粉病菌对不同甜瓜品种幼苗生理生化指标的影响[J]. 分子植物育种,2021,19(7):2346-2353.
DIAO Q N, CAO Y Y, JIANG X J, et al. Effects of powdery mildew on physiological and biochemical indexes of different melon varieties[J]. Molecular Plant Breeding, 2021, 19(7): 2346-2353.
[20] 张成玲,孙厚俊,谢逸萍,等. 甘薯黑斑病菌胁迫对不同甘薯品种抗氧化酶活性及MDA含量的影响[J]. 江西农业学报,2020,32(9):64-67.
ZHANG C L, SUN H J, XIE Y P, et al. Effects ofstress on antioxidant enzyme activity and MDA content of different sweet potato varieties[J]. Journal of Jiangxi Agricultural Science, 32(9): 64-67.
[21] 关峰,张景云,石博,等. 苦瓜枯萎病抗性鉴定及枯萎病菌胁迫下生理响应差异分析[J]. 植物生理学报,2019,55(10):1481-1488.
GUANG F, ZHANG J Y, SHI B, et al. Resistance identification towilt and difference in physiological response under stress off.sp.in bitter gourd[J].Plant Physiology Journal, 2019, 55(10): 1481-1488.
[22] 陈年来,乃小英,张玉鑫,等. 植物源诱导剂对甜瓜叶片防卫酶活性的影响[J]. 西北植物学报,2010,30(10):2016-2021.
CHEN N L, NAI X Y, ZHANG Y X, et al. Effects of plant-derived inducers on defense enzyme activities in muskmelon leaves[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(10): 2016-2021.
[23] 覃柳燕,郭成林,黄素梅,等. 棘孢木霉菌株PZ6对香蕉促生效应及枯萎病室内防效的影响[J]. 南方农业学报,2017,48(2):277-283.
TAN L Y, GUO C L, HUANG S M, et al. Growth-promoting effects ofstrain PZ6 on banana and its indoor control effect against banana fusarium wilt[J]. Journal of Southern Agriculture, 2017, 48(2): 277-283.
[24] 林霞. 樱桃抗茎腐病机理与效应因子PnAvh241功能初步研究[D]. 烟台:烟台大学,2019.
LIN X. Study on the cherry resistance mechanism of stem rot disease and the function of the RxLR effector PnAvh241[D]. Yantai: Yantai University, 2019.
[25] 李淼,檀根甲,李瑶,等. 不同抗性猕猴桃品种感染溃疡病前后几种保护酶活性变化[J]. 激光生物学报,2009,18(3):370-378.
LI M, TAN G J, LI Y, et al. Changes of activities of several protective enzymes in Kiwifruit cultivars with different resistance to bacterial canker[J]. Acta Laser Biology Sinica, 2009, 18(3): 370-378.
[26] 陈亮,陈年来. 西瓜叶片防御酶活性与枯萎病抗性的关系[J]. 河南农业科学,2019,48(1):77-83,114.
CHEN L, CHEN N L. Relationship between leaf defensive enzyme activities and resistance towilt in watermelon[J]. Journal of Henan Agricultural Sciences, 2019, 48(1): 77-83, 114.
[27] 耿莉娜,龙艳玲,徐宸,等. 感染赤星病后不同烟草品种叶片防御酶的变化[J]. 西南大学学报(自然科学版),2018,40(10):19-24.
GEN L N, LONG Y L, XU C, et al. Changes of defense enzymes in leaves of different tobacco varieties infected with brown spot disease[J]. Journal of Southwest University (Natural Science Edition), 2018, 40(10): 19-24.
[28] 汪尚,徐鹭芹,张亚仙,等. 水杨酸介导植物抗病的研究进展[J]. 植物生理学报,2016,52(5):581-590.
WANG S, XU L Q, ZHANG Y X, et al. Recent advance of salicylic acid signaling in plant disease resistance[J]. Journal of Plant Physiology, 2016, 52 (5): 581-590.
[29] 陆雯潘,璐琪,王雪艳. 水杨酸及茉莉酸介导植物抗病性的研究进展[J]. 贵州农业科学,2013,41(10):40-43.
LU W P, LU Q, WANG X Y. Research progress of salicylic acid and jasmonic acid mediated Plant disease resistance[J].Guizhou Agricultural Sciences, 2013, 41(10): 40-43.
[30] VERGNE E, GRAND X, BALLINI E, et al. Preformed expression of defense is a hallmark of partial resistance to rice blast fungal pathogen[J]. BMC Plant Biology, 2010, 10(3): 1-17.
Physiological Response and Resistance Analysis of Different Flue-cured Tobacco Varieties to
JIANG Shuzhen1,2, SONG Wenjing1, YANG Bo3, WANG Weifeng1, FENG Xiaohu4,ZHANG Yan1,2, KUANG Shuai1, XU Yanli1, DONG Jianxin1*
(1. Key Laboratory of Tobacco Biology and Processing, Ministry of Agriculture and Rural Affairs, Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. Pingyi Branch, Linyi Tobacco Corp. Ltd., Pingyi, Shandong 273300, China; 4. Fuzhou Tobacco Company of Jiangxi Province, Fuzhou, Jiangxi 344000, China)
In order to clarify the response mechanism of flue-cured tobacco varieties (lines) with different resistance toinfection, resistant varieties (lines)Yanyan 97, G80, 633K and susceptible varieties Cuibi No.1, Honghuadajinyuan were used as materials, and disease incidence, dry weight, hormones, Malondialdehyde content and antioxidant enzyme activities of different varieties (lines) were studied underinfection. The results showed that incidence rate and disease index of the susceptible varieties were higher than those of the resistant varieties. The incidence rate and disease index of Honghuadajinyuan and Cuibi No.1 reached 80%, 68.89 and 70%, 41.11, respectively; Compared with noinfection(CK), the dry weight and malondialdehyde (MDA) content of all varieties (lines) decreased significantly afterinfection. The decrease of dry weight in the resistant varieties (lines) was significantly less than that of the susceptible varieties. The decrease in dry weight of 633K was the smallest, 37.47%, and the decrease of the dry weight of Honghuadajinyuan was the largest, 84.01%. The decrease of MDA content in the resistant varieties (lines) was significantly greater than that in the susceptible varieties. 633K had the largest decrease of 45.67%, and Honghuadajinyuan had the smallest decrease of 13.02%; Afterinfection, the activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) of all varieties were significantly increased, and the increase of the resistant varieties (lines) was greater than that of the susceptible varieties; Jasmonic acid (JA) and salicylic acid (SA) contents of the resistant varieties (lines) were significantly up-regulated. For the susceptible varieties SA contents were significantly up-regulated but JA contents were significantly down-regulated. Under theinfection, the disease resistant varieties can respond more effectively to bacterial wilt infection, so as to resist the infection of pathogenic bacteria.
tobacco;; tobacco bacterial wilt; malondialdehyde; antioxidant enzymes; endogenous hormones
10.13496/j.issn.1007-5119.2022.06.004
S572.01
A
1007-5119(2022)06-0025-06
中国农业科学院科技创新工程(ASTIP-TRIC03);中国烟草总公司科技重大专项项目(110202001024 JY-07);中国烟草总公司江西省公司科技项目(2021.01.010)
姜淑祯(1998-),女,在读硕士研究生,主要从事土壤微生物研究。E-mail:3528699583@qq.com。
,E-mail:dongjianxin@caas.cn
2022-03-31
2022-10-08

