镉处理对亚麻生长发育的影响及镉在亚麻体内的分布
赵信林,王慧,邱化蛟,邱财生,龙松华,王玉富*,郭媛*
(1.中国农业科学院麻类研究所,湖南 长沙 410205;2.中南林业科技大学环境科学与工程学院,湖南 长沙 410004)
在人类活动因素和自然因素双重作用下,土壤、水体中的重金属污染情况日益严重[1-2],严重制约着中国农业可持续发展。在诸多有害重金属中,镉(Cd)因其移动性强、毒性高、易随食物链累积而备受关注[3-5],土壤Cd 污染修复任务紧迫。在各种修复手段中,植物修复模式因具有环保、成本低、易操作等优点而成为研究的热点。寻找适合Cd污染农田修复和利用的作物,一直是科研工作者的目标之一。
亚麻(Linum usitatissimumL.)是世界三大纤维和五大油料作物之一,是人类最早栽培的古老作物[6]。亚麻有200 多个品种,根据其用途分为纤维用、油用、油纤兼用3 种类型[7]。随着对亚麻研究的扩展和深入,亚麻在生物复合材料[8]、医用[9]等领域的利用已取得了较大进展,这使得亚麻的经济利用价值更加突出。此外,人们还发现亚麻对Cd 具有很强的吸收能力和耐性,如GUO 等[10]发现,一些亚麻品种每年每公顷可在土壤中移除60 g 的Cd,而BJELKOVÁ[11]则发现,某些亚麻品种在Cd 含量为1000 mg/kg 的土壤上依然可正常生长。同时,种植在Cd 污染农田上的亚麻还可作为能源作物用于生物燃料的生产[12]。可见,亚麻有潜力去替代那些经济利用价值低、生长缓慢、生物量小的超积累植物来实现Cd 污染土壤的修复和利用[13]。
关于用亚麻修复Cd 污染农田的研究较多,但大多数集中于高富集Cd 的亚麻品种筛选、亚麻对Cd 的修复效果及亚麻对Cd 胁迫生理响应等,而对生存在Cd胁迫下的亚麻体内积累的Cd 的亚细胞水平的分布情况研究较少。本研究中,探究不同水平Cd 处理对亚麻植株形态学的影响,进入亚麻植株体内的土壤Cd 在亚麻根、茎、叶等器官内的分布情况及根、茎、叶等器官内的Cd 在亚细胞水平上的分布情况。现将结果报告如下。
1 材料与方法
1.1 供试土壤与亚麻品种
供试土壤采集于湖南省益阳市沅江市。土壤有机质和全氮质量分数分别为26.9、1.31 g/kg;有效磷和速效钾质量分数分别为40.0、91.5 mg/kg;pH为7.35。
供试亚麻品种为中国农业科学院麻类研究所选育的中亚1 号,是中早熟纤维用亚麻品种。其株高约95~105 cm,原茎产量依据不同产地情况可达6~11 t/hm2,适合中国绝大部分产区种植,具有较强的抗倒伏品质。研究[10]表明,中亚1 号对Cd 具有较好的耐性和修复效果。
1.2 试验设计
去除在田间采集的土壤样品中的大石块、植物残体等,风干后过2 mm 筛,然后对土壤样品进行3 种处理:不加Cd 的对照(CK)、添加40 mg/kg 的低Cd 处理(Cd40)和添加80 mg/kg 的高Cd 处理(Cd80),其土壤有效Cd质量分数分别为0.14、17.40、51.50 mg/kg。由于在之前的田间试验中发现亚麻在自然环境中各种Cd 污染程度下的农田里均可较好的生长,本试验设计了更高浓度的Cd 处理,以便检验亚麻的耐Cd 潜力及Cd 在亚麻植株内的积累、分布情况。将处理好的土壤分别装入花盆中,静置2 月,使加入的Cd 达到转化平衡。2 月后,在每盆中加入适量的水,将花盆中土壤的含水量调整为田间持水量的70%,再将70 粒亚麻种子播种在表层土下2 cm 深度处。每周观察2 次亚麻出苗及长势情况。及时喷水,避免土壤干燥,治虫和除草视情况而定。
1.3 测定项目及方法
1.3.1 亚麻的形态指标和生物量测定
播种2 周后,计数每个处理的亚麻苗数,并计算出苗率。播种40 d 后收获亚麻,在每盆亚麻苗中选取10 株测定其株高、茎粗和叶片数;然后用蒸馏水洗净每盆的植株,并在吸干植株表面的水分后称其鲜质量;再取部分植株进行烘干,测定植株的含水率,进而根据含水率计算每盆亚麻植株的干生物量。
1.3.2 亚麻亚细胞组分的分离及Cd 含量的测定
取部分洗净并吸干植株表面水分的新鲜亚麻苗,将其分为根、茎和叶,采用差速离心法对此3部位的细胞进行亚细胞器分离,具体操作流程参照李德明等[14]和SUN 等[15]的方法并有所改进。称取0.5 g 样品于研钵中,加入20 mL 预冷的pH 7.4 的亚细胞缓冲溶液(250 mmol/L 蔗糖、1 mmol/L 二硫赤藓醇、50 mmol/L Tris-HCl),迅速将样品研磨成匀浆。对所得匀浆进行差速离心:以300 r/min 的速度离心30 s,沉淀为细胞壁组分;上层清液再以2000 r/min 的速度离心15 min,沉淀为细胞核和叶绿体组分;上层清液再以10 000 r/min 的速度离心20 min,沉淀为线粒体组分;其余上清液为可溶性部分,包括核糖体等。上述所有步骤均在4 ℃条件下进行。用去离子水洗涤细胞壁组分,过滤后将滤渣转移至消煮管,其余组分分别用去离子水洗入消煮管,60 ℃烘干后,用体积比为5∶1 的硝酸、高氯酸消解,最后采用ICP-MS 测定Cd 的含量。利用亚麻植株不同部位的4 个亚细胞组分的Cd 含量分别计算亚麻植株不同部位的Cd 含量。
1.4 数据处理
数据均使用Microsoft Excel 2016 进行整理;运用SPSS 22.0 进行方差分析,采用Duncan 法在P<0.05 的显著水平上进行多重比较。
2 结果与分析
2.1 Cd 处理对亚麻植株形态及生物量的影响
Cd 处理可影响亚麻的出苗率、株高、茎粗、叶片数,最终影响亚麻的生物量,但Cd 对亚麻的影响因质量分数不同而存在差异(表1)。从表1 可以看出,Cd40 对亚麻的出苗有一定的促进作用,Cd40的出苗率较CK 的提高了13.0%;Cd80 的出苗率较CK 的降低了19.6%,但差异无统计学意义;Cd80的出苗率显著低于Cd40 的。Cd 的存在对亚麻产生了不同程度的毒害作用,不论何种质量分数的Cd处理都会影响亚麻的株高、茎粗和叶片数。与CK相比,Cd40 在一定程度上降低了亚麻的株高、茎粗和叶片数,分别降低了20.7%、9.3%和7.0%;而Cd80 则无一例外地显著降低了亚麻的株高、茎粗和叶片数,分别降低达64.1%、51.9%和58.6%。Cd的存在不仅影响了亚麻植株形态,也显著影响了亚麻的生物量。与CK 相比,2 种水平的Cd 处理均显著降低了亚麻的生物量,且随着Cd 质量分数的增加,亚麻生物量的降低更加明显,Cd40 和Cd80 的生物量分别降低了20.6%和71.8%。

表1 C d 处理下亚麻的出苗率和植株形态特征及生物量Table 1 Seedling emergence rate, plant morphological characteristics and biomass of flax treated with Cd
2.2 Cd 处理下亚麻植株内Cd 的含量与分布
从表2 可以看出,土壤中的Cd 经亚麻根系吸收后会进入亚麻体内进行再分布,并且在亚麻体内各个器官中的分布差异明显,根、叶、茎中Cd 的质量分数依次降低,其中,根中的Cd 质量分数显著高于叶和茎的,且随着土壤Cd 质量分数的增加亚麻植株各器官的Cd 质量分数也显著增加。
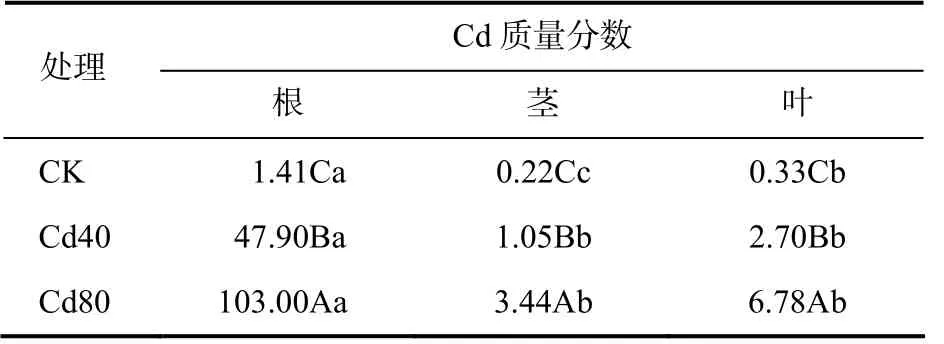
表2 C d 处理下亚麻的根和茎及叶中的Cd 质量分数Table 2 The mass fractions of Cd in root, stem and leaf of flax treated with Cd mg/kg
从表3 可以看出,在3 个器官中,在亚麻亚细胞水平上细胞壁和核糖体组分的Cd质量分数较高,显著高于细胞核与叶绿体、线粒体组分的Cd 质量分数;随着土壤Cd 质量分数的增加,各个器官的各亚细胞组分的Cd 质量分数也显著增加;细胞壁和核糖体是细胞内Cd 积累的主要位置。

表3 亚麻根和茎及叶在亚细胞水平上的Cd 质量分数Table 3 The mass fractions of Cd at subcellular level in roots, stems and leaves of flax mg/kg
3 讨论
本研究中,低浓度Cd 处理可促进亚麻出苗,而高浓度Cd 处理抑制亚麻出苗,这与郭媛等[16]的研究结果类似。其原因可能是低浓度Cd 处理刺激了亚麻种子内RNA 和蛋白质的合成,从而促进了种子的萌发和出苗[17]。与对照相比,Cd 处理降低了亚麻的株高、茎粗和叶片数。DOUCHICHE 等[18]在向沙培的亚麻品种Hermes 施加0.1 mmol/L 的Cd时,亚麻的株高、茎粗和叶片数也受到了显著的负面影响。本研究结果与其相似。本研究中,Cd 处理显著降低了亚麻的生物量,且该影响随着Cd 质量分数的增加而增加,这与已报道的研究[19]的结果相似。而导致亚麻生物量降低的原因可能是植株细胞内和分子水平上的一些生理生化过程由于Cd 处理而发生了变化[20]。此外,Cd 处理下植株体内活性氧的产生会导致调节植物正常功能的各种酶和官能团的堵塞或失活[21],最终抑制植株的光合作用,降低了有机物质的积累。
植物对重金属的耐受机制包括对重金属的排斥和积累,前者是指植物避免吸收重金属和限制重金属转移到枝叶,具有这类耐受机制的作物表现为根部重金属含量高于地上部重金属含量[22]。土壤中的Cd 经亚麻根系吸收后会进入亚麻体内进行再分布,从而导致植株不同器官的Cd 含量有所不同[23]。本研究中,亚麻植株的根、叶、茎中Cd 的质量分数依次降低。可见,亚麻对Cd 的耐受机制应该属于排斥机制。随着土壤Cd 含量的增加,亚麻植株各器官的Cd 质量分数也显著升高,这与前人的研究结果[12]一致。
重金属处理时,植物会通过各种途径抵御和减轻重金属对自身的伤害,如最大限度减少重金属的吸收或运输,并通过修饰或隔离进行解毒[23]。了解Cd 在亚麻体内亚细胞水平上的浓度和分布可在一定程度上阐明亚麻耐Cd和吸Cd的机制。本研究中,亚麻细胞壁和核糖体组分中Cd 的质量分数较高,显著高于细胞核与叶绿体、线粒体组分中的。细胞壁组分的Cd 质量分数较高,可能是位于细胞壁上的一些功能集团与Cd 发生了螯合,将部分Cd“固定”到了细胞壁上;核糖体组分Cd 质量分数高,则可能是此组分汇集了细胞内所有可溶性组分,包括可能对有毒物质进行隔离的液泡等[23]。
4 结论
1) 当土壤有效Cd 质量分数为17.4 mg/kg 时,Cd 会对亚麻出苗产生促进作用,高于此量则可能会抑制亚麻出苗。
2) 添加Cd 处理,使土壤有效Cd 质量分数为51.50 mg/kg 时,会严重抑制亚麻的生长和生物量积累,形态学上表现为降低株高、茎粗及叶片数等。
3) 亚麻根、叶、茎中Cd 的质量分数依次降低,而在亚细胞水平上细胞壁和核糖体的Cd 质量分数显著高于细胞核与叶绿体、线粒体的。

