miRNA-148a-3p的生物信息学分析及其在小鼠不同组织中的表达水平检测
刘芳君,蓝吴涛,马悦悦,李鹏飞,张 磊,朱芷葳*
(1.山西农业大学生命科学学院,太谷 030801; 2.忻州师范学院,忻州 034000)
miRNA是一种内源性的、大约22个核苷酸的非编码RNA,可以与其靶标的3′非翻译区上的位点结合,实现翻译抑制[1-2]。自从1993年首次发现miRNA以来,人们一直在积极研究miRNA在病理和生理条件下的关键作用[3]。最新证据表明,miRNA在肿瘤的发生、发展和临床治疗中发挥着重要作用。大约50%的miRNA位于肿瘤相关的脆弱部位或基因组区域,这表明它们在癌症中具有潜在的关键作用[4]。miRNA直接或间接的与癌基因和抑癌基因相互作用并调节其表达,表明miRNAs可以作为一种新的肿瘤诊断和预后的生物标志物。在一系列生物学过程中,miR-148a家族同许多miRNA家族一样具有共同的功能,包括细胞发育和分化[5]。目前,miR-148a的研究主要集中在病理生理条件下,如胆管癌、食道癌、卵巢癌和结肠癌[6-9]。miR-148a调控胃癌发生发展的作用及其在胃癌细胞中的具体机制已经确定[10-11]。miR-148a也能调节黑色素瘤的形成和进展[12]。因此miR-148a在肿瘤领域的研究是十分有前景的。miR-148a-3p是miR-148家族的一员,已有研究结果显示,其在多种肿瘤组织和细胞系中表达失调。在骨肉瘤组织和细胞系中miR-148a-3p表达较低,而过表达miR-148a-3p可以通过抑制PIK3CA继而抑制MG-63和U2OS细胞的增殖、迁移和侵袭,并降低骨肉瘤细胞在裸鼠体内的致瘤性[13]。Wang等[14]研究发现,miR-148a-3p在上皮性卵巢癌中表达降低,而过表达miR-148a-3p可抑制上皮性卵巢癌SKOV3细胞的侵袭和增殖能力。
本研究通过分析miR-148a-3p在不同组织中的表达水平,预测miR-148a-3p靶基因的功能和参与的通路,并构建基因互作网络,为进一步阐明miR-148a在癌症中的功能提供一定的理论依据。
1 材料与方法
1.1 试验材料
试验小鼠为6周龄C57BL/6 J小鼠,体重(24±2)g,按照山西农业大学动物试验伦理委员会的要求,对小鼠进行饲养。采用脊椎脱臼法处死小鼠后,分别收集3只小鼠的胃、肺、脾、皮肤、肝、心和肾7个组织,置于液氮研磨,每组3个重复,进行3次平行试验。
1.2 仪器与试剂
TRIzol购自赛默飞世尔科技有限公司;miRcute miRNA First-Strand cDNA合成试剂盒购自天根科技(北京)有限公司;TB Green Advantage qPCR PreMix购自宝日医生物技术(北京)有限公司。
1.3 小鼠组织总RNA提取和反转录
将不同组织置于研钵中,加入液氮研磨。使用TRIzol法提取组织总RNA,Nanodrop2000C检测总RNA的质量和纯度。
根据miRcute miRNA First-Strand cDNA合成试剂盒步骤进行总miRNA的反转录。第一步,将1 μg RNA、0.2 μL大肠杆菌聚(A)聚合酶(5 U·μL-1)、 1 μL 10×聚合酶缓冲液和2 μL 5×rATP液加入离心管中,加ddH2O补足至10 μL后37 ℃孵育60 min。第二步,将2 μL第一步的溶液、2 μL 10×引物、2 μL 10×RT缓冲液、1 μL dNTPs、1 μL RNasin(40 U·μL-1)和0.5 μL Quant Rtase混合,加入11.5 μL的无核糖核酸酶的ddH2O于37 ℃下孵育60 min。
1.4 小鼠不同组织中miR-148a-3p表达的检测
为了确定miR-148a-3p在小鼠胃、肺、脾、皮肤、肝、心和肾组织中的表达情况,用miR-148a-3p的通用引物和序列特异性正向引物5′-CATTGCACTTGTCTCGGTCTGA-3′进行qRT-PCR。U6正、反向引物序列分别为5′-TTGTGGAAAGGACGAAACAC-3′和5′-GGCCATGCTAATCTTCTG-3′。反应体系包括1 μL cDNA、0.4 μL反向引物和0.4 μL序列特异性正向引物,5 μL TB Green Advantage qPCR PreMix和3.2 μL的ddH2O,按照TaKaRa荧光定量试剂盒说明书设置条件。
1.5 miR-148a-3p转录因子结合位点(TFBS)的预测
在Ensembl数据库中搜索miR-148a-3p的前体,确定其上游约10 kb的片段。利用Promoter Scan和TRANSFAC数据库对miR-148a-3p的TFBS进行预测。
1.6 miR-148a-3p的保守性和靶基因预测
在miBase中检索并分析不同物种的miR-148a-3p序列,包括猕猴、大猩猩、人、牛、黑猩猩、褐家鼠、小鼠、山羊和家犬。为了保证数据的准确,本研究利用TargetScan、miRanda 和PicTar 3个软件对miR-148a-3p的靶基因进行预测。3个软件预测结果的交集作为最后的结果。
1.7 miR-148a-3p 靶基因的GO和KEGG富集分析
为了分析miR-148a-3p靶基因的作用,利用DAVID 在线数据库对mRNA进行GO和KEGG分析。对靶基因参与的生物学过程、细胞成分、分子功能和信号通路进行富集分类。P<0.05被认为有统计学意义。
1.8 TF-miRNA-mRNA互作网络构建
利用Cytoscape3.2.0软件,根据预测的靶向结合关系,将转录因子、靶基因和miR-148a-3p的结合作用绘制成功能关系网络图。
1.9 数据分析
荧光定量数据采用2-△△CT法计算基因的表达情况。利用Graphpad Prism进行差异性统计分析。其中认为P<0.05表现为差异显著。
2 结 果
2.1 小鼠不同组织中miR-148a-3p的表达
qRT-PCR结果表明,miR-148a-3p在肾、心、肝、皮肤、脾、胃、肺等组织中均有表达。miR-148a-3p的丰度与U6 snRNA的丰度进行了归一化。其中,miR-148a-3p在脾中的表达水平最高(P<0.001),肝次之(P<0.001),在皮肤、胃、心、肾、肺中的表达水平逐渐降低(图1)。
2.2 miR-148a-3的TFBS预测
通过Promoter Scan Version和TRANSFAC两个在线数据库对miR-148a-3p前体上游的TFBS进行预测,在启动子区域检测到多个基因可以作用于miR-148a-3p前体,例如DNA聚合酶β结合蛋白(BATA-pol)、CAMP反应元件结合蛋白(CREB)、E1A调节的转录因子(E4F1)核因子S(NF-S)、激活增强子结合蛋白2α(AP-2)和转录因子IID(TFIID)等。
2.3 miR-148a-3p的保守性分析
通过比较猕猴、大猩猩、人、牛、泛穴居人、褐家鼠、小鼠、山羊、家犬共9个物种的miR-148a-3p成熟体序列,发现miR-148a-3p高度保守(表1),成熟miRNAs具有相似的序列和相同的种子区(CAGUGCA)。
2.4 miR-148a-3p靶基因预测
将TargetScan、PicTar和miRanda预测出的miR-148a-3p的靶基因取交集,共得到25个交集靶基因(图2)。再结合miRwalk数据库中已证实的23个基因和已证实发表的15个基因,共得到63个miR-148a-3p的靶基因,用于GO富集和KEGG通路富集分析(表2)。
2.5 miR-148a-3p靶基因的GO富集分析
GO富集分析表明,miR-148a-3p的靶基因集中在离子转运、膜电位调节、心发育、细胞对胆固醇的应答和对有机物的应答等多种生物学过程中。主要的分子功能是乙酰胆碱激活的阳离子选择通道活性、乙酰胆碱结合活性和乙酰胆碱受体活性,且这些靶基因主要在细胞质和质膜上发挥作用(图3)。

***. P<0.001图1 miR-148a-3p在不同组织中的表达情况Fig.1 The miR-148a-3p expression in different tissues

表1 miR-148a在不同物种中的序列
2.6 miR-148a-3p靶基因的KEGG通路富集分析
KEGG途径富集分析提供了miR-148a-3p靶基因所参与的信号转导通路。结果表明,miR-148a-3p靶基因主要富集在TGF-β、肥厚性心肌病和黏附连接等信号通路中(图4)。
2.7 TF-miRNA-mRNA互作网络
转录因子ATF、CREB、NF-S、bata-pol和E4F1与miR-148a-3p及其靶基因形成了一个复杂的网络。涉及70个点和70条边,包含5个转录因子和63个mRNAs。从网络图中可以直观地看出miR-148a-3p通过调控靶基因(FMRP、Nrp1、BRCA1、p27等)参与了肥厚性心肌病途径、黏附连接通路和内质网加工等许多信号转导途径(图5)。
3 讨 论
miRNA家族是基因表达调控网络的重要组成部分,参与调节细胞代谢、细胞迁移和血管生成的许多重要信号通路[15]。目前,有关 miR-148a-3p的研究主要中在其抗增殖潜能[16-19]以及诱导细胞周期停滞[20]、分化[21]、凋亡[22]等重大生命进程方面。

A.3个数据库的韦恩图;B. 3个数据库分别对应的基因数统计图;C. 韦恩图中3个部分:不相交的,两两相交的和三个相交的基因数量A.Venn diagram of 3 databases; B. The statistics of the number of genes corresponding to the 3 databases; C. Three parts in the Venn diagram: genes number of disjoint, pairwise intersecting and three intersecting图2 预测的miR-148a-3p靶基因的三重维恩图及直方图Fig.2 Ternary Venn diagram and the histogram of miR-148a-3p predicted target genes

表2 miR-148a-3p靶基因的统计
Liu和Sun等[23]研究发现,miR-148a-3p可以通过破坏p300依赖的Nrf2通路激活来阻止成骨细胞分化和骨重塑。Wu等[24]研究发现,miR-148a-3p可以上调AGO1的表达,继而参与调节转化生长因子-β (TGF-β)途径促进卵巢癌进展。大肠癌中肿瘤细胞表面主要组织相容性复合体I类(MHC-I)的低表达是肿瘤逃避T细胞识别的机制之一,而抑制miR-148a-3p的表达可以恢复MHC-I的水平,并显著增强CD8+T细胞介导的免疫攻击作用[25]。这些研究都证明了miR-148a-3p与mRNA互作网络在肿瘤中可以参与不同的信号通路,发挥不同的生理作用。本试验分析还发现,miR-148a-3p可以参与蛋白呈递、黏附连接通路和蛋白泛素化等通路,这些都是维持细胞正常生长的基础通路。
此外,已有研究表明 miR-148a-3p在人体各种组织中表达,如心、肝、胎盘和睾丸,在正常生理条件下miR-148a-3p在造血系统中也有表达[26-27],这与本研究结果相似。本试验qRT-PCR结果表明,miR-148a-3p在小鼠的肝、心、皮肤、肾、胃、脾、肺组织中均有表达,而在脾中的表达要明显高于其他组织。众所周知,脾是血循环中重要的过滤器,能清除血液中的异物、病菌以及衰老死亡的细胞[28]。脾中的免疫细胞可以产生免疫球蛋白、补体等免疫物质,发挥免疫作用,有助于对抗某些引起肺炎和脑膜炎的细菌[29]。机体发生肿瘤的主要原因为免疫系统监控失调,而脾作为人体免疫系统的重要组成部分,无疑与肿瘤的发生密切相关[30]。因此,维持miR-148a-3p在脾中的稳定表达,对于维持机体免疫系统保持恒定水平具有重要意义。推测,miR-148a-3p可能是参与脾正常功能维持的重要调节因子,深入研究miR-148a-3p在脾中的作用对治疗人类疾病具有重要意义。

图3 miR-148a-3p靶基因GO分析Fig.3 GO enrichment analysis of miR-148a-3p predicted target genes

图4 miR-148a-3p靶基因KEGG通路分析Fig.4 The KEGG pathway analysis of miR-148a-3p target genes
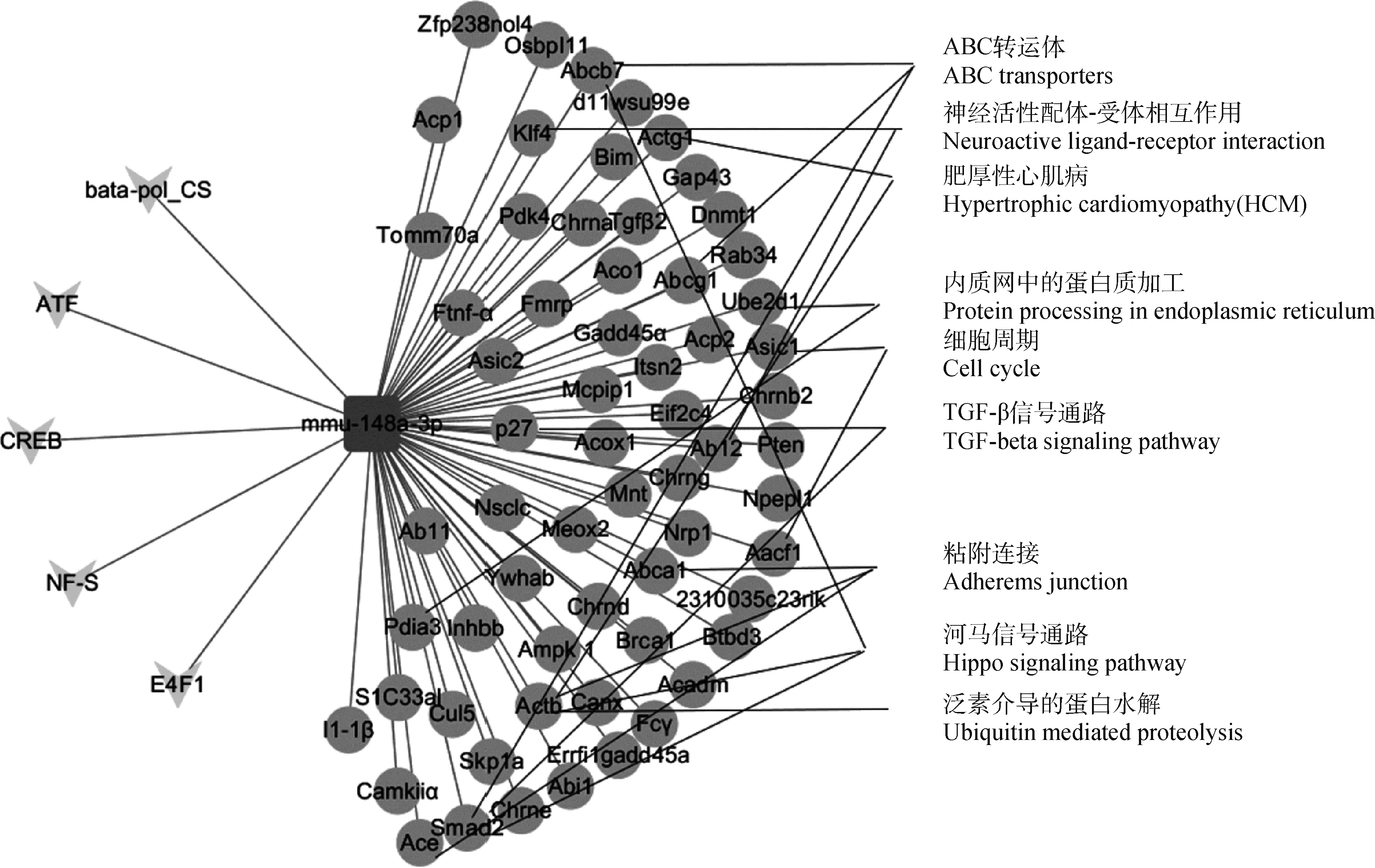
图5 TF-miRNA-mRNA互作网络图Fig.5 TF-miRNA-mRNA interacting pathway network
转录因子、miR-148a-3p和靶基因的互作形成了一个全面的调控网络,控制着机体正常的生命活动,任何一环的失调都可能导致疾病,甚至癌症的发生。其中P27是一种抑癌基因,为细胞周期素依赖性蛋白激酶抑制因子[31-33]。研究表明,晚期胃癌患者miR-148a-3p的表达偏高,其下游靶基因P27严重失调,这可能是胃癌细胞恶化的一个重要因素[34]。miR-148a-3p还可以与Smad2的3′UTR结合并抑制其活性,激活转化生长因子TGF-β/SMAD2途径,抑制细胞迁移、侵袭、生长和存活[35]。PTEN作为抑癌基因,可通过去磷酸化参与细胞调控[36-40]。在黑色素瘤中,miR-148a-3p可以靶向抑癌基因PTEN,负向调控PTEN的表达,从而促进黑色素瘤细胞的生长和迁移,并抑制其凋亡[41]。DNA损伤诱导蛋白GADD45A下调是胶质瘤预后差的一个主要原因,miR-148a-3p可以通过下调GADD45A促进胶质瘤细胞侵袭和肿瘤发生。本试验预测的互作网络中涉及5个转录因子和63个mRNAs,这些mRNA参与了细胞周期、信号转导、蛋白转运等一系列进程,部分互作已被证实,但还有许多预测结合的mRNA未被试验证实。
4 结 论
本研究显示,miR-148a-3p在小鼠脾组织中高表达且受E4F1、ATF、NF-S等多种转录因子的调控,并调控Smad2、GADD45A、P27、PTEN等靶基因。这些靶基因通过多种生物学途径影响细胞的增殖、分化和代谢,调节和维持生物体的相对稳定状态。推测miR-148a-3p在维持细胞正常生长的基础通路和癌症的发生中发挥重要作用。

