子宫内膜异位症患者血清中PAPP-A,IGF-I水平及PAPP-A基因rs7020782 A/C位点多态性与临床分期相关性研究
曾辉苑,张 燕,刘国栋,林 丽,刘爱胜,梁秀文(深圳市龙华区人民医院 .妇产科;.检验科,广东深圳 518109)
子宫内膜异位症(endometriosis,EMs)是子宫内膜和/或宫体肌层以外的其他部位种植子宫内膜组织而导致的一种疾病,可引起妇女月经异常、痛经、盆腔痛、异位结节及不孕,为临床妇科常见病和多发病,30~40 岁妇女多见[1],EMs 病因和发病机制十分复杂,至今尚未完全明确,多数认为是由免疫、遗传、激素及环境等因素共同作用所致的一种慢性炎性疾病[2-3]。妊娠相关血浆蛋白-A(pregnancy associated plasma protein-A,PAPP-A)是一种与胰岛素样生长因子(insulin-like growth factor-I,IGF)相关的金属鳌合蛋白酶,能增强IGF 生物活性,且其基因启动子区多个位点呈多态性,易影响其水平表达或导致其结构异常[4-5]。有研究表明,PAPP-A水平与EMs 发病有关[6],但与PAPP-A基因多态性突变是否有关目前未见报道。为此,本研究对深圳市龙华区EMs 和非EMs 妇女PAPP-A,IGF-I水平及PAPP-A基因rs7020782 A/C位点SNP 进行了对比分析,旨在探讨EMs 发病机制,现报道如下。
1 材料与方法
1.1 研究对象 选择2019年5月~2021年3月深圳市龙华区人民医院妇科门诊和住院部EMs确诊者176 例为EMs 组,年龄23~42 岁,平均31.06±8.95 岁。据美国生殖医学协会子宫内膜异位症分期(R-AFS)标准将EMs 组分为Ⅰ期37 例,Ⅱ期54 例,Ⅲ期49 例及Ⅳ期36 例。所有患者及家属知情,并签定知情同意书,同时本研究已经医院伦理委员会批准同意。纳入标准:①符合2015年《子宫内膜异位症的诊治指南》中的诊断标准[7];②病理确诊为EMs 者;③年龄≥20 岁;④首次确诊者;⑤患者及家属知情,并签定知情同意书者;⑥医院伦理委员批准同意者;⑦积极、自愿参与和配合者;⑧6 个月内未用过激素类药物和/或免疫抑制剂。排除标准:①肝、肾功能严重不全者;②意识功能障碍者;③伴有各种妇科肿瘤者;④妊娠及哺乳期者;⑤凝血异常及血液病者;⑥严重免疫疾病者;⑦患有代谢性疾病者;⑧不主动配合者。同时选取120 例育龄非EMs 患者为对照组,年龄22~43 岁,平均年龄30.12±8.61 岁。两组年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 仪器与试剂 AE275 酶免分析仪购于深圳爱康公司;PAPP-A 和IGF-I 酶联免疫试剂盒由上海江莱生物科技有限公司提拱;DNA 提取试剂购于深圳亚能公司;ABI7500 PCR 扩增仪购于美国ABI公司。
1.3 方法
1.3.1 PAPP-A 和IGF-I水平测定:采用酶联免疫吸附(enzyme-linked immunosorbent assay,ELSIA)法检测血清中PAPP-A 和IGF-I水平,严格按照试剂及仪器说明书操作。
1.3.2 DNA 提取:采用DNA 提取试剂提取基因组DNA,并对提取DNA 的浓度和纯度进行检测,然后将A260nm/A280nm比值在1.7~1.9 范围内的DNA 样本于-20℃冰箱内保存备用。
1.3.3 PAPP-A基因rs7020782 A/C位点SNP 分析:PAPP-A基因rs7020782 A/C位点SNP 分析采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)法,具体操作:①引物设计:上游引物5’-CCC TCGTTTCTTTCC TCC-3’,下游引物5’-ACCCAGTA AGCCTTCCCT-3’,上述引物由华大基因科技公司合成。②反应体系:总体积为50.0μl,其中10×缓冲液、dNTPs(10 mmol/L)及MgCl2(25mmol/L)分别为5.0,4.0 及3.0μl,上、下游引物(20μmol/L)各1.0μl,0.1μg/μl 的DNA 模板1.0μl,1U/μl 的Taq DNA聚合酶0.25μl,最后双蒸水加至50.0μl。③扩增:94℃预变性5min,然后以94℃变性60 s →62℃退火48 s →72℃延伸48 s,36 次循环后→72℃延伸5min。④酶切:取聚合酶链反应(polymerase chain reaction,PCR)扩增产物10μl,用2.5U 限制性内切酶MOW I 酶切,反应总体积为20μl,其中PCR产物10μl,MOW I 内切酶0.5μl,缓冲液2.0μl和去离子水7.5μl,于60℃温育酶切1h。⑤电泳:用30g/L 琼脂糖凝胶对酶切产物进行电泳,电泳40min,然后采用凝胶图像分析系统对其基因型进行分析。
1.4 统计学分析 运用SPSS22.0 统计软件。以均数±标准差(±s)表示计量资料,两组和多组间差异比较分别采用t检验和F检验;以百分率(%)表示计数资料,组间比较采用χ2检验;遗传平衡采用 Hardy-Weinberg 检验法;采用Spearman 进行相关性分析。P<0.05 为差异有统计学意义。
2 结果
2.1 两组PAPP-A 和IGF-I水平比较 EMs 组血清中PAPP-A 和IGF-I水平(16.38±5.29mIU/L 和145.47±18.02ng/ml)明显高于对照组(7.42±2.83 mIU/L 和81.34±12.61ng/ml),差异均有统计学意义(t=7.018 5,5.624 1,P=0.031 4,0.036 2)。
2.2 不同临床分期EMs 患者PAPP-A 和IGF-I水平比较 见表1。PAPP-A 和IGF-I水平随EMs 临床分期增加而升高,不同临床分期之间差异有统计学意义(P<0.05)。
表1 不同临床分期EMs 患者PAPP-A 和IGF-I水平比较(±s)
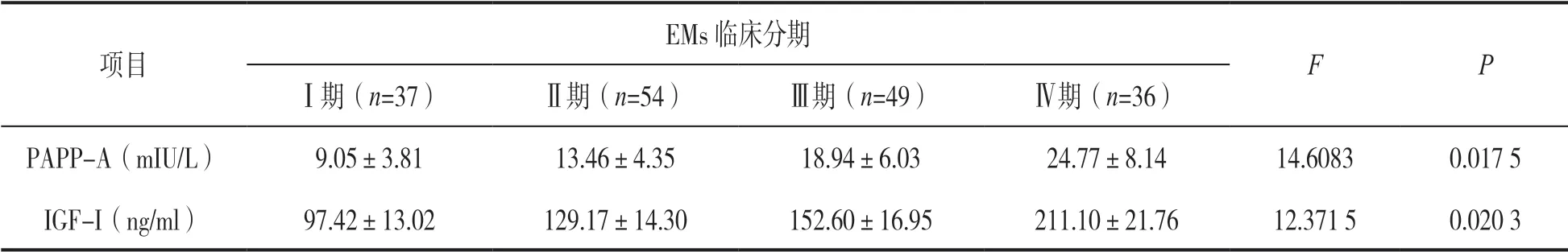
表1 不同临床分期EMs 患者PAPP-A 和IGF-I水平比较(±s)
项目EMs 临床分期F PⅠ期(n=37)Ⅱ期(n=54)Ⅲ期(n=49)Ⅳ期(n=36)PAPP-A(mIU/L)9.05±3.8113.46±4.3518.94±6.0324.77±8.1414.6083 0.017 5 IGF-I(ng/ml)97.42±13.02129.17±14.30152.60±16.95211.10±21.7612.371 50.020 3
2.3 相关性分析 EMs 患者PAPP-A 和IGF-I水平明显升高,且与临床分期有关。经Spearson 相关性分析,PAPP-A 与IGF-I水平呈正相关(r=0.790 2,P=0.026 1),同时PAPP-A 和IGF-I水平与临床分期呈正相关(r=0.612 7,0.735 8;P=0.029 5,0.027 8)。
2.4 Hardy-Weinberg 遗传平衡检验结果 EMs 组和对照组PAPP-A基因rs7020782 A/C位点SNP 均出现AA,AC 和CC 三种基因型。经Hardy-Weinberg遗传平衡检验,两组差异无统计学意义(χ2=1.320 7,
P=0.071 2),表明抽样具有代表性。
2.5 两组PAPP-A基因rs7020782 A/C位点SNP 比较 见表2。EMs 组PAPP-A基因rs702078 2 A/C位点CC基因型和C 等位基因频率分别为68.75%和78.41%,高于对照组的46.67%和55.83%,差异有统计学意义(P<0.05),且CC基因型和C 等位基因患EMs 的相对风险增加(OR=3.095,95%CI:1.982~6.873 和OR=2.607,95%CI:1.821~4.759)。
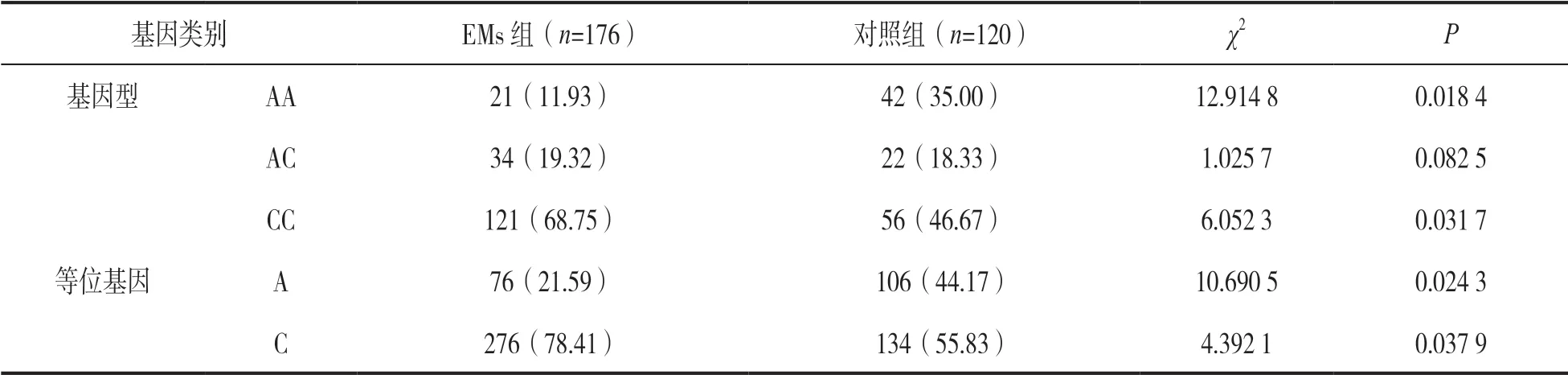
表2 EMs 组和对照组PAPP-A基因rs7020782 A/C位点SNP 比较[n(%)]
2.6 不同基因型EMs 患者PAPP-A水平比较 携带CC基因型EMs 患者PAPP-A水平为18.48±7.13mIU/L,明显高于AC 和AA基因型的12.03±3.86mIU/L 和11.42±3.51mIU/L,差异有统计学意义(t=6.841 2,7.061 4;P=0.029 3,0.025 4),但AC 和AA基因型差异无统计学意义(t=0.852 4,P=0.092 1)。
2.7 电泳结果 见图1。于30g/L 琼脂糖凝胶上加入PCR 扩增酶切产物进行电泳,40min 后两组标本PAPP-A基因rs702078 2 A/C位点SNP 于86bp,134bp 和160bp 处均可见AA,AC 及CC 3条电泳带。
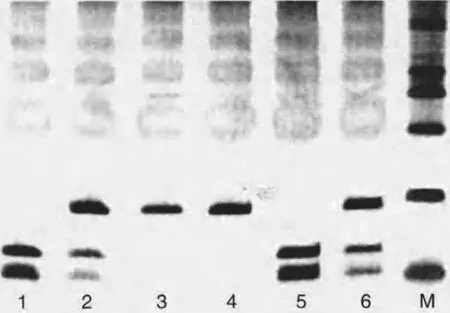
图1 PAPP-A基因rs7020782 A/C位点SNP 电泳图
2.8 测序结果 见图2。抽取部分PAPP-A基因rs702078 2 A/C位点SNPs PCR 扩增产物进行基因测序,样本测序结果与PAPP-A基因序列相符合。
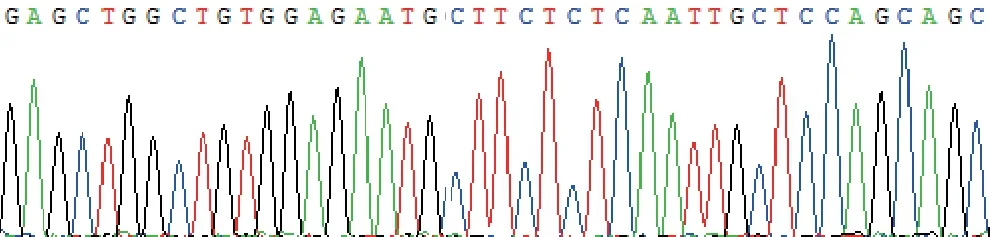
图2 PAPP-A基因rs702078 2 A/C位点PCR 扩增产物基因测序图
3 讨论
EMs 是妇科常见和多发的一种雌激素依赖性良性疾病,但其病变部位分布广、形态各异,且具有转移、扩散、种植、侵袭及复发等多种恶性特性,是导致女性不孕的常见影响因素之一,其发病率约为10%~15%,占女性不孕的30%~50%,且呈逐年上升趋势[8-10]。但EMs 发病机制十分复杂,且早期症状不明显,甚至无症状,给早期诊断带来一定困难,易发生漏诊,使EMs 患者错过治疗良机[11]。因此,探索EMs 患者有关指标含量及其基因SNP,对EMs 早期诊断、治疗及发病机制的研究具有极为重要的临床意义。
IGF 是由两种低分子多肽(IGF-I 和IGF-II)、两类特异性受体及六种结合蛋白组成的一类多功能细胞增殖调控因子,通过其与特异性靶细胞表面受体结合促进细胞分化、增殖及个体生长发育。其中IGF-I 是一种单链碱性蛋白,可通过增强卵泡刺激素(FSH)和黄体生成激素(LH)对卵泡颗粒细胞和卵泡膜细胞的作用促进雌激素的生成和释放,从而促进子宫内膜细胞生长[12-13]。而PAPP-A 属于胰岛素样生长因子结合蛋白-4(insulin-like growth factor binding protein-4,IGFBP-4)蛋白酶,能水解IGFBP-4,而IGFBP-4 可抑制IGF 的活性,从而推测PAPP-A水平可能通过增强IGF 活性而在EMs发病中发挥作用[14]。本研究结果显示,EMs 患者血清中PAPP-A,IGF-I水平明显升高,与临床分期有关,且PAPP-A 与IGF-I水平呈正相关,这表明EMs 发生和发展与PAPP-A 和IGF-I水平变化有密切关系,同时也表明PAPP-A 在EMs 发病中作用可能与其对IGF水平和活性的调节而促进异位子宫内膜细胞的增殖、分化,为异位子宫内膜细胞的进一步黏附、侵袭创造有利条件等有关。
近年研究发现,EMs 发病具有家族聚集性或遗传倾向,且双胎发病情况相似,提示该病可能是一种受多个基因多个位点控制的多基因遗传性疾病,其发病与多种基因多个位点突变有关[15-18]。PAPP-A 是一种与IGF 相关的金属鳌合蛋白酶,其基因启动子区多个位点呈多态性,与多种疾病的发生有关[5,19]。本研究结果显示,深圳市龙华区EMs患者PAPP-A基因rs702078 2 A/C位点CC基因型和C 等位基因频率与对照组比较明显升高,且携带CC基因型和C 等位基因患者EMs 的相对风险增加,这表明PAPP-A基因rs7020782 A/C位点多态性可能与EMs 发病有一定关系,其中CC基因型可能是该区EMs 发病的易感基因。同时结果还显示,PAPP-A水平在CC基因型EMs 患者血清中比其它基因型明显升高,这说明PAPP-A 在EMs 发病中的作用可能是通过其基因rs7020782 A/C位点多态性影响其水平表达或导致其结构异常,影响IGF 活性,从而参与EMs 发病,但具体作用机制有待进一步深入研究分析。
综上所述,EMs 患者PAPP-A 和IGF-I水平明显升高,与临床分期有关,可能与EMs 发生发展有密切关系。同时PAPP-A基因rs7020782 A/C位点呈多态性,其中CC基因型PAPP-A水平及患EMs的相对风险明显增加,可能与该地区EMs 发病存在一定相关性。因此,加强PAPP-A,IGF-I水平及PAPP-A基因SNP 分析,对EMs 早期诊疗和发病机制研究具有一定的应用价值。

