利用微卫星标记分析湖羊群体遗传多样性
李丹阳,吴彩凤,孙玲伟,张树山,张德福,戴建军*
(1 上海市农业科学院畜牧兽医研究所,上海市农业遗传育种重点实验室动物遗传工程研究室,上海 201106;2上海海洋大学水产与生命学院,上海 201306)
湖羊是我国南方地区特有的国家级畜禽资源保护绵羊品种,主要分布于太湖流域[1],羔皮呈波浪形、繁殖率高、生长速度快、环境适应性强、耐粗饲、屠宰率高、肉质鲜嫩且耐舍饲。幼湖羊皮具有独特的羔皮特质,被誉为中国的“软宝石”[2]。目前,湖羊已迅速推广至我国大部分养羊主产区。
目前,我国的养羊产区以使用地方品种居多,但绝大部分品种存在保护体制缺乏,种群混杂等问题,导致其优良基因丢失,优势品种资源减少;另一方面,无计划盲目地引种,致使其种群分化严重,纯度下降,外貌特征不明显。合理利用和资源保护对湖羊可持续发展具有重要的意义。本研究利用微卫星标记技术,对上海地区湖羊进行遗传多样性评估,旨在为本地区湖羊种质资源保护与利用提供理论支持。
1 材料与方法
1.1 实验动物
湖羊来自上海永辉羊业有限公司。随机抽取31 个无亲缘关系个体,含21 只母羊,10 只公羊。用2%EDTA 抗凝管收集颈静脉血,按照DNA 提取试剂盒(天根生化科技有限公司,北京)的操作方法提取全基因组DNA。
1.2 方法
1.2.1 微卫星位点的引物设计
使用联合国粮农组织(FAO)及国际遗传学会(ISAG)所推荐和中华人民共和国农业行业标准(NY∕T 1673—2008)所规定的微卫星位点,共31 个,合成荧光标记微卫星引物(表1)。
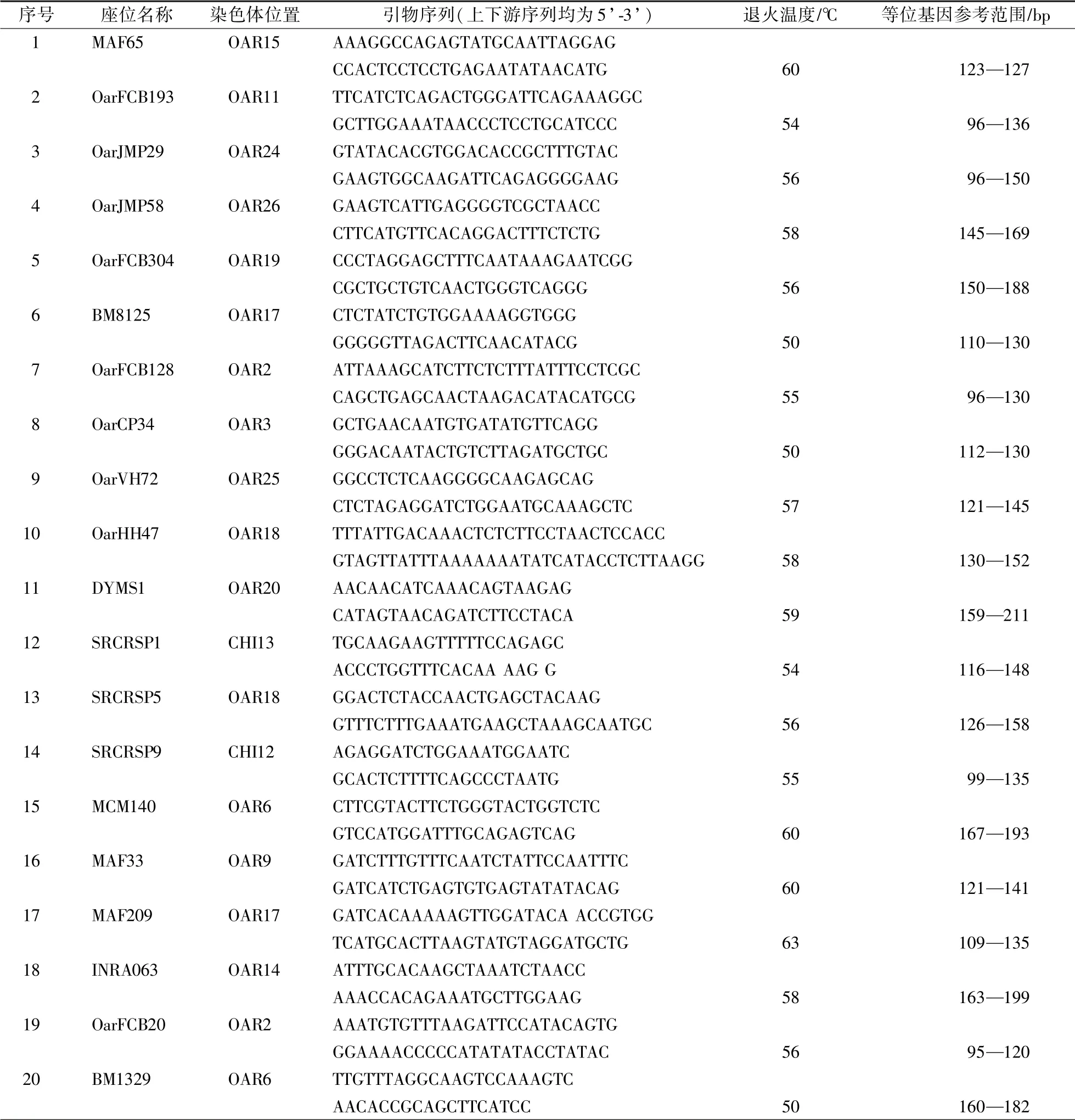
表1 绵羊遗传多样性研究的微卫星DNA 标记Table 1 Microsatellite DNA markers specific for genetic diversity studies in sheep(FAO)

(续表1)
1.2.2 PCR 扩增
PCR 扩增反应体系为:DNA 100 ng,10 × Buffer 缓冲液1.5 μL,MgCl2(25 mmol∕L)1.0 μL,dNTPs(25 mmol∕L)0.15 μL,Taq E(5 U∕μL)0.2 μL,引物(2 pmol∕μL)1 μL∕条,ddH2O 9.15 μL。PCR 扩增反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。
1.2.3 毛细管电泳
将PCR 产物稀释10 倍,加入ROX500 内标0.25 μL、超纯去离子甲酰胺12.5 μL,混匀。95 ℃5 min、冰浴3 min 后,置于ABI3730 测序仪样本架上进行毛细管电泳检测。
1.3 数据分析
利用Popgene3.4 进行数据分析,包括观测杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)、等位基因数目(Number of alleles,Na)、有效等位基因数(Effective number of alleles,Ne)、Shannon 指数(I)、Hard-Weinberg 平衡(HWE)等指标。通过PIC-Cale 软件分析多态信息含量(PIC)、近交系数(Population inbreeding estimate,Fis)。使用Bottleneck 软件进行群体瓶颈效应分析。
2 结果与分析
2.1 不同微卫星位点的等位基因数目
由图1 可知,湖羊群体31 个位点共发现210 个等位基因,其中P26(MAF70)位点上最多,计15 个,P27(BM1824)和P31(ILSTS5)最少,仅3 个。平均每个位点6.774 个,有15 个位点等位基因数目在均值以上。

图1 湖羊群体31 个位点的等位基因数目Fig.1 Statistics of alleles at 31 loci in Hu sheep population
2.2 湖羊群体的遗传多样性
从表2 可知,湖羊群体Ho 和He 均值分别为0.692和0.685,Ho >He,但16 个位点的Ho <He。Shannon 指数I 均值为1.416,仅有5 个位点I <1。PIC 均值为0.634,为高度多态,5 个位点小于0.5。近交系数Fis 为-0.020。31 个位点中有8 个位点偏离HWE,均值为0.468,显著高于0.05。在Ewens-Watterson 测试中所有位点的F 值都在95%的置信区间内(图2)。

图2 湖羊群体埃文斯-沃特森检测Fig.2 Ewens-Watterson test for neutrality in Hu sheep population

表2 湖羊群体31 个微卫星位点遗传多样性分析Table 2 Genetic diversity analysis of 31 microsatellite loci in Hu sheep population
湖羊群体公羊Ho 为0.694,He 为0.643,I 值>1(I= 1.190),PIC >0.5(PIC = 0.564);母羊Ho 为0.676,He 为0.693, I 为1.403, PIC >0.5 (PIC=0.636),表明该群体遗传多样性丰富,变异程度高。
2.3 湖羊群体瓶颈效应检测
在湖羊群体中,通过三种差异算法(即符号秩检验、标准化差异检验和Wilcoxon 符号秩检验)计算杂合度过量的显著数量。如表3 所示,在湖羊群体中,无限等位基因模型(IAM)下杂合度过剩的观察值和期望值比较相似,在逐步突变模型(SMM)下显著低于预期,双侧检验T 值也较低。湖羊群体等位基因频率数据的模态位移检验显示低频等位基因比例较高,等位基因频率呈L 形分布,显示群体处于突变漂移平衡状态(图3)。

表3 湖羊群体中不同突变模型下杂合度过剩水平分析Table 3 Level of heterozygosity excess calculated under different mutation models in the Hu sheep populations

图3 湖羊群体的等位基因频率分布(模式位移图)Fig.3 Allele frequency distribution(mode shift graphs) of the Hu sheep populations
3 结论与讨论
本研究中,湖羊群体31 个微卫星位点共有等位基因数210 个,平均每个位点6.774 个,与四川绵羊[3]群体相似;低于云南地方绵羊的16 个[4]、藏绵羊的9.75 个[5]。
种群若长期近交,将导致纯合性增加,最终导致遗传漂变或出现瓶颈效应,不受控制的近交还可能导致近交衰退现象,造成等位基因的丢失和遗传漂变[6]。本研究中,绝大多数位点的PIC 值在0.5—0.7,Shannon 指数I >1,只有5 个位点的PIC <0.5、I <1,根据Botstein[7]等提出的标准,认为该湖羊群体在大部分位点上具有丰富的遗传多样性和较高的变异程度。杂合度均值Ho >He,部分位点Ho <He,说明该群体中近交程度较轻。仲涛等[8]研究发现,苏州湖羊群体期望杂合度为0.743,本研究中,期望杂合度He为0.685,Ewens-Watterson 测试显示所有位点都在置信区间内,表明杂合度的降低不是选择的结果,而可能与群体较小,群体内出现小部分的非随机交配有关。Fis 为负值也表明群体杂合度较高,近交程度轻。
一般而言,一个群体平均杂合度大于0.5,则认为该群体遗传多样性丰富,变异程度高,湖羊群体公羊的Ho 为0.694,He 为0.643,母羊Ho 为0.676,He 为0.693;低于小尾寒羊(Ho=0.855 9)[9],但高于黑裘皮羊(Ho=0.483 9)[10]及苏州湖羊(Ho=0.376 0)[11]。这可能与所选位点不同,致使检测出的等位基因数目不同有关。PIC 可以反映基因的丰富度,本研究中,母羊和公羊的PIC 都大于0.5,表明群体遗传基础多样性丰富,基因丰富度高。I 值也是反映遗传多样性指标之一,I >1 表明该群体遗传多样性丰富[12],本研究中,公羊、母羊I 值均大于1。综上,湖羊群体具有丰富的遗传多样性和较高的变异程度,为后续的种质资源保存、品种选育和杂交利用奠定了基础。
处于平衡的群体,杂合度过剩和不足的概率相近。若发生瓶颈效应,群体数量下降,杂合度就会过剩[13-14]。在湖羊群体中,SMM 下杂合度基因座数量较少,T2 值较低,为负值,种群中杂合度过剩的基因座数量明显低于预期,表明这些种群中不会出现瓶颈效应。此外,模式位移图中低频等位基因的比例较高,呈L 形分布,表明湖羊群体处于平衡状态。HWE 检测也表明群体基本处于平衡状态,仅个别位点出现偏离平衡的情况。

