小鱼际法对骨骼肌钝性损伤家兔生长分化因子8与F-肌动蛋白的影响
陈海南 卢园 杨舟 孙梦龙 王兰兰 薛惠天 彭亮
1 材料与方法
1.1 实验动物
18只3月龄的新西兰大耳白兔,雌雄各半,体质量范围为252.41~320.67克,由湖南中医药大学基础研究所实验动物中心提供[动物许可证号:SYXK(湘)2015-0008]。动物饲养环境温度恒定在20~25℃,湿度保持50%~70%。
1.2 试剂与仪器
蛋白磷酸酶抑制剂(北京普利莱),蛋白酶抑制剂(北京金泰宏达),标准电泳装置(北京六一),ZTC-II按摩手法测试仪(上海腾荫教学仪器有限公司),石蜡切片机(浙江金华),TGF-β1、IL-6试剂盒(武汉华美,批号:C0358190399、G19035853),电热恒温培养箱(北京永光明),全自动酶标洗板机与分析仪(深圳汇松科技)。
1.3 动物分组与造模

根据文献[10]中的改进方法,实验前适应性喂养7天后,使用自制重锤击打家兔右后肢以建立股四头肌损伤模型。模型具体制备过程:将兔腹部朝上固定于实验台,选取右后肢的股四头肌肌腹中部为圆心,画一直径1 cm的圆圈标记击打处,并覆盖一层纱布防止击打过程中造成表皮损伤。专人使用特制重锤(质量850 g,用于击打的锤面为光滑木质圆柱,直径1.5 cm)从40 cm高处沿光滑不锈钢管以自由落体方式下落击打标记的受击处,连续击打6次。测算求得每次击打的动能为3.33 J,冲量为2.38 Ns,击打面积约为1.77 cm2。击打过程中有专人以手固定兔腿部,防止因家兔挣扎移动导致击打部位偏移或造成其他外伤。造模成功标准为肉眼观察受击处有明显的淤血肿胀,且无明显皮肤损伤与骨折,以手轻触时家兔有明显的逃避反射。满足上述条件认定造模成功,将造模成功兔放回笼中正常饲养。
1.4 小鱼际法治疗

1.5 指标检测
1.5.1 取材 造模后第8天,采用耳缘静脉注射空气处死动物,保证取材过程中的无菌环境后暴露分离股四头肌,切取损伤最为严重的骨骼肌组织用于后续检测。
1.5.2 骨骼肌组织形态学观察 切取适量受损最严重部位的骨骼肌组织,进行常规固定、脱水、石蜡包埋、切片,随后进行苏木精—伊红(hematoxylin-eosin,HE)染色,染色后以中性树胶封片,置于显微镜下进行组织形态学观察。
1.5.3 Western Blot法检测骨骼肌组织GDF-8与F-肌动蛋白的表达 剪取0.03 g受损最严重部位的骨骼肌组织,用冰预冷PBS洗组织,剪碎后放入生物样品均质仪,并向其中加入400 μL RIPA裂解液,反复研磨直至肉眼无法观测到组织块,冰上裂解10分钟后,置于已经预冷的离心机上,在4℃下以12 000 r/min离心15分钟,提取上清液转移至1.5 mL离心管中,后经过制胶、蛋白上样、电泳、转膜、封闭、抗体孵育、显色曝光,检测骨骼肌中GDF-8和F-肌动蛋白表达量,以GAPDH作为内参蛋白,重复3次。
1.5.4 ELISA法检测骨骼肌组织TGF-β1与IL-6的表达 剪取适量受损最严重部位的骨骼肌组织,用1×PBS洗去血污并置于组织研磨器中制成组织匀浆,-20℃保存一晚后经2次冻融处理破坏细胞膜,后将组织匀浆置于2~8℃以5 000 g转速离心5分钟,提取上清液。试剂盒于低温取出后置于室温至少30分钟,并通过离心、稀释、溶解、吹打混匀等步骤配置。在反应终止后5分钟内用酶标仪在450 nm波长依序测量各孔的光密度(OD值)。
1.6 统计学处理

2 结果
2.1 小鱼际法对骨骼肌损伤家兔骨骼肌组织病理学的影响
骨骼肌组织HE染色结果可见,空白组肌细胞分布紧密,无明显间隙;模型组大量肌细胞破损变形,细胞间隙相比空白组显著增大,细胞间大量肌纤维、瘢痕形成;治疗组细胞间隙相比于模型组更小,细胞间纤维组织较少,细胞形态更接近健康肌细胞。见图1。
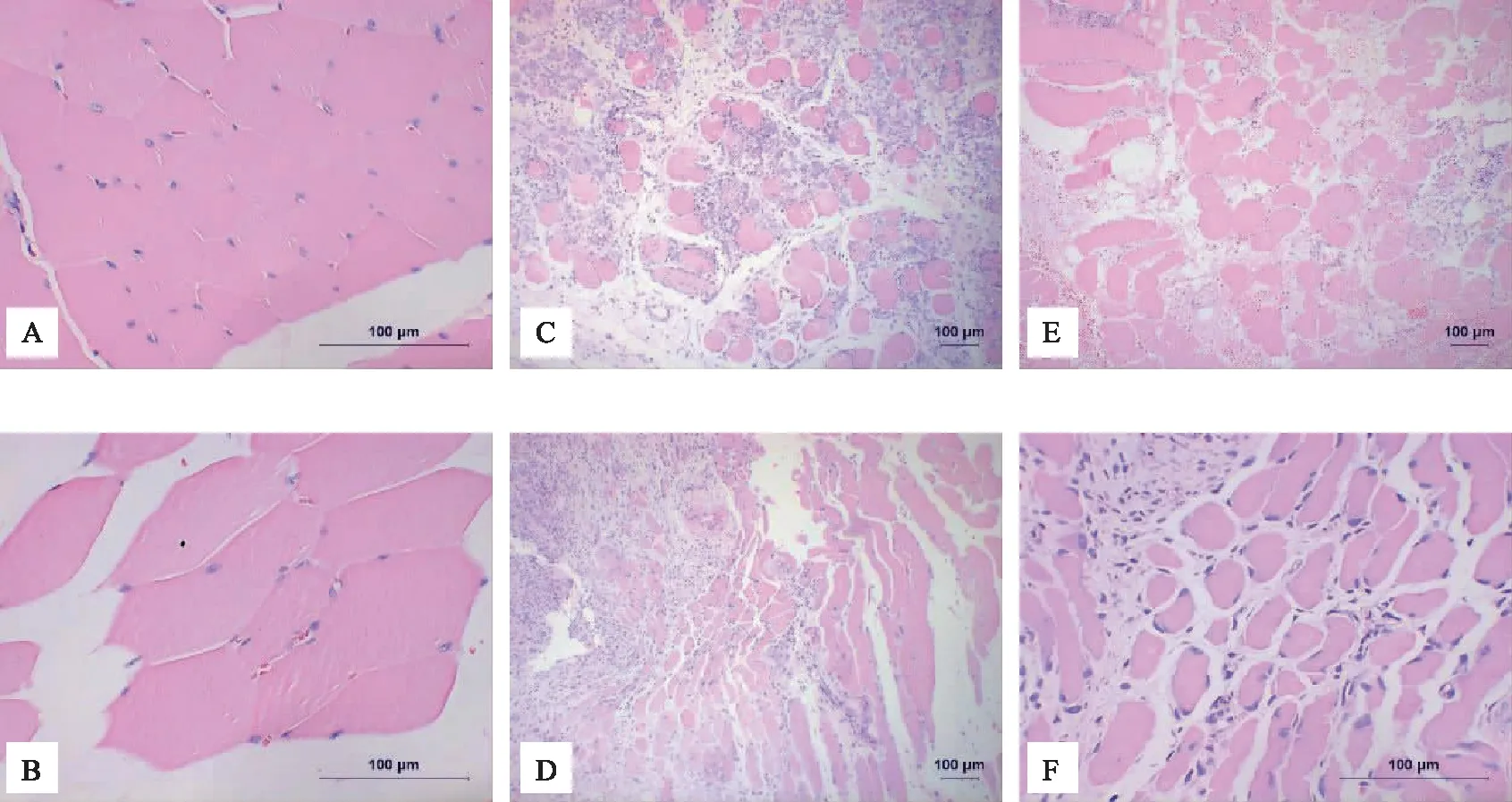
注:A、B 空白组;C、D 模型组;E、F 治疗组。
2.2 小鱼际法对骨骼肌损伤家兔骨骼肌组织GDF-8、F-肌动蛋白表达的影响
与空白组相比,模型组与治疗组GDF-8表达量都出现显著上升,同时治疗组GDF-8表达水平显著低于模型组。与空白组相比,模型组与治疗组F-肌动蛋白表达量都出现显著上升,同时治疗组F-肌动蛋白表达水平显著低于模型组。上述差异均有统计学意义(P<0.05)。见图2、表1。
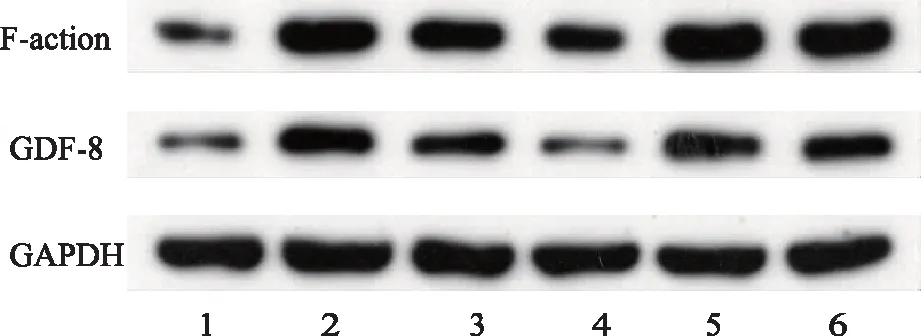
注:1、4 空白组;2、5 模型组;3、6治疗组。

表1 小鱼际法对骨骼肌损伤家兔骨骼肌组织GDF-8、F-肌动蛋白表达的影响
2.3 小鱼际法对骨骼肌损伤家兔骨骼肌组织TGF-β1、IL-6表达的影响
模型组TGF-β1表达量相比于空白组有明显上升,治疗组TGF-β1表达量相比于模型组又有进一步提升。模型组、治疗组IL-6的表达量相比于空白组均出现明显上升,但治疗组相比于模型组则出现了明显的下降。上述差异均有统计学意义(P<0.05)。见表2。

表2 小鱼际法对骨骼肌损伤家兔骨骼肌组织TGF-β1、IL-6表达的影响
3 讨论

生理学实验观察证明,当骨骼肌严重损伤时,需要先通过中性粒细胞与巨噬细胞引发的炎症反应清除坏死组织,而后周边正常肌肉组织开始分裂增生以修复损坏肌肉[12]。正常肌肉组织的增生依赖于肌膜的完整性与附着于其上肌核的存活,而当损伤过于严重时,过多坏死组织会使得机体不得不依赖长时间的炎症反应来清理患处。这会损伤周边组织,造成肌肉组织的增生能力下降。此时结缔组织修复会占据主导,损伤部位会被填充大量纤维化结缔组织,从而形成瘢痕,造成肌肉弹性与收缩能力下降。因此加快正常肌肉组织的再生速度,减缓肌肉纤维化与损伤后的炎症反应是保障损伤后肌肉运动功能恢复的关键[13-14]。
GDF-8是一种能够抑制肌肉生长的蛋白质,最早由遗传学家McPherron和Se-Jin Lee于1997年发现[15]。研究证实这一物质能有效抑制肌肉的生长与肌肉量,而缺乏GDF-8的动物个体,在保证营养的前提下即使不经过锻炼,肌肉生长速度与肌肉量也显著高于同类正常个体。F-肌动蛋白则在早期已被证明是一种参与肌肉组织修复与肌肉运动功能的重要蛋白质。在肌肉损伤恢复过程中,众多研究表明TGF-β1是抑制炎症反应的一种重要生理因子[16-18],而IL-6则是一种重要的促炎因子,在外伤、手术等情况时其表达水平往往会急剧升高,引发严重的炎症反应[19]。目前从GDF-8与F-肌动蛋白这两项指标探讨推拿治疗骨骼肌损伤与抑制炎症反应的内在机理研究较少,故而揭示推拿治疗骨骼肌损伤、抑制炎症反应与GDF-8和F-肌动蛋白这两项指标之间的关系,可以为推拿治疗骨骼肌损伤提供多角度的生理学依据,也可以为后续的临床改良与深入实验研究提供新思路与方向。


