Venetoclax 联合化疗治疗复发/难治性急性髓系白血病的临床研究
陈晓奉,王蒙,李忠玉,李佳佳
本研究要点:
复发/难治性急性髓系白血病预后差,治愈率极低,化疗方案的选择非常有限,目前强化化疗方案药物剂量高,患者易出现严重骨髓抑制、感染、出血等毒副作用,非强化化疗方案缓解率低,生存时间短。本研究采用的Venetoclax(VEN)+阿扎胞苷(Aza)+HAAG〔高三尖杉酯碱(HHT)、阿糖胞苷(Ara-C)、阿克拉霉素(Acla)、粒细胞刺激因子(G-CSF)〕方案显示了良好的临床疗效,或许是复发/难治性急性髓系白血病患者一种有前途的治疗方案。
本研究为单中心研究,样本量相对较少,需要扩大样本量进一步观察以得出更客观的数据。急性髓系白血病(acute myeloid leukemia,AML)是一组具有高度异质性的血液系统肿瘤,约70%的成人AML 患者在首次诱导化疗后会达到完全缓解(CR),但大约50%的年轻患者以及80%以上的老年患者会复发,并且大多数患者会死于疾病复发及相关并发症,目前复发/难治性AML 的治疗选择非常有限[1-2]。Venetoclax(VEN)是一种抗凋亡蛋白B 细胞淋巴瘤2(BCL-2)抑制剂,研究表明VEN 对复发/难治性AML 患者具有单药临床活性和可耐受的安全性[3]。此外,2018 年11 月美国食品药品管理局批准VEN 联合去甲基化药物(HMA)如阿扎胞苷(Aza)、地西他滨或低剂量阿糖胞苷(LDAC)应用于初诊AML 或不适合进行强化治疗的AML 患者[4]。然而,其在复发/难治性AML 患者中应用的研究有限。本研究收集并评估了10 例采用VEN+Aza+HAAG〔高三尖杉酯碱(HHT)、阿糖胞苷(Ara-C)、阿克拉霉素(Acla)、粒细胞刺激因子(G-CSF)〕方案治疗复发/难治性AML 患者的临床资料,以期对临床治疗提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2016 年7 月至2021 年6月就诊于蚌埠医学院第一附属医院血液科复发/难治性AML 患者10 例。该10 例患者初诊后均经过规范化治疗且至少发生过1 次疾病进展,均经过骨髓细胞形态学、染色体核型、白细胞免疫分型及分子生物学检查(MICM)分型确诊。
1.2 纳入标准 初次就诊用标准的诱导缓解方案治疗2 个疗程未达到部分缓解(PR)者;首次治疗缓解后6个月内复发者;首次治疗缓解后6 个月后复发,但用原诱导缓解方案再次治疗失败者;多次复发者;髓外白血病细胞持续存在者。
1.3 排除标准 初次就诊常规化疗获得CR 者;初次确诊为AML 即行VEN 联合化疗者;合并严重心、肺、肾等器官功能不全者。
1.4 治疗方案 VEN+Aza+HAAG 方案,具体为VEN 第1 天剂量为100 mg,第2 天剂量为200 mg,第3 天剂量为400 mg 并维持至第14 天为1 个周期;同时联合Aza 75 mg/m2,第1~7 天,皮下注射;HAAG(HHT 1 mg,第3~9 天;Acla 10 mg/m2,第3~6 天,皮下注射;Ara-C 10 mg/m2, 第3~9 天, 皮 下 注 射;G-CSF 300 μg,第1 天,皮下注射),若应用上述化疗方案后患者达到CR/形态学完全缓解而血细胞计数未完全恢复(CRi)则继续应用该治疗方案,反之则调整治疗方案。
1.5 观察指标 收集患者临床特征,包括性别、年龄、诊断、染色体、基因突变、预后情况。
化疗前后监测血常规检查结果〔白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)〕、骨髓原始细胞百分比,并记录化疗后骨髓抑制等级、脱发、感染、出血、恶心、腹泻、肝功能等毒副作用。
化疗结束后第15天完善骨髓穿刺检查以判定疗效,记录患者CR 持续时间及血常规恢复情况。
与化疗相关的毒副作用定义为从首次给药到停药后30 d 发生的毒副作用,标准依据美国国家癌症研究所(National Cancer Institute,NCI)常见毒性分级标准5.0版[5],包括VEN+Aza+HAAG 方案化疗前已经发生的血细胞减少。
1.6 疗效评估 根据第3版《血液病诊断及疗效标准》[6]评估患者化疗效果,分为CR、CRi、PR、未缓解(NR)及复发。总生存期(OS)定义为使用VEN+Aza+HAAG方案化疗之日起至死亡之日或末次随访的时间。通过门诊复诊病例、住院以及电话回访的形式进行资料统计,计算总缓解率(ORR),ORR=(CR+CRi+PR)/总例数×100%。随访截止时间为2021-07-25。
1.7 统计学方法 采用SPSS 23.0 统计学软件对各观察指标进行描述性分析。符合正态分布的计量资料以(±s)表示,不符合正态分布的计量资料以M(QR)表示。
2 结果
2.1 临床特征 10 例复发/难治性AML 患者中男7 例、女3 例,平均年龄(47.9±11.3)岁;FAB 分型:M24 例、M56 例。病例5 和病例9 伴t(8;21)(q22;q22)染色体核型异常,病例4 和病例8 染色体为复杂核型。伴有基因突变的患者8 例,其中伴WT1 基因(+)的患者4 例。根据《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017 年版)》[7]预后危险度分级:预后良好3 例、预后中等2 例、预后不良5 例。10 例复发/难治AML 患者临床资料见表1。
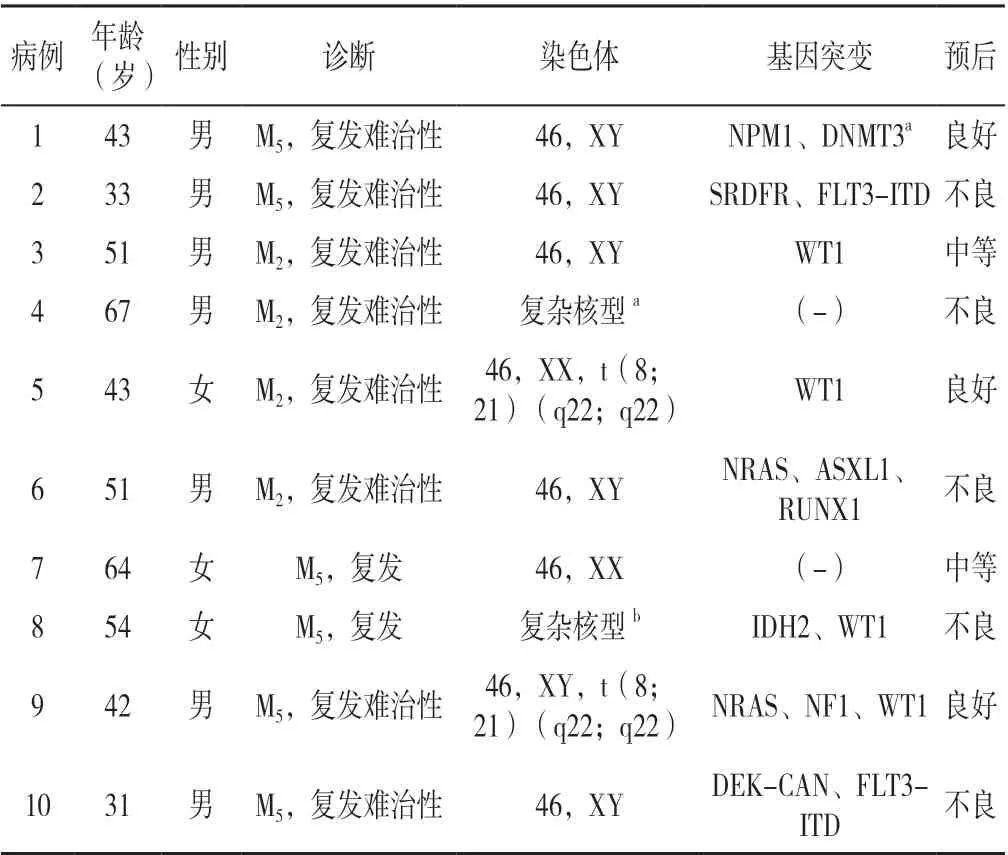
表1 10 例复发/难治性AML 患者临床资料Table 1 General clinical characteristics of 10 adult cases of relapsed/refractory acute myeloid leukemia
2.2 化疗前后外周血及骨髓细胞学检查 10 例复发/难治性AML 患者VEN+Aza+HAAG 方案治疗前中位WBC为4.10×109/L(1.29×109/L,16.76×109/L),中位Hb为87.5(62.5,98.5)g/L, 中 位PLT 为66.00×109/L(30.75×109/L,132.25×109/L),中位骨髓涂片白血病细胞计数百分比为63.50%(43.75%,70.00%)。经过标准VEN+Aza+HAAG 方案化疗,完善患者血常规、骨髓穿刺等检查后中位WBC 为3.28×109/L(2.60×109/L,4.45×109/L),中位Hb 为107.00(99.00,111.75)g/L, 中 位PLT 为78.0×109/L(66.5×109/L,109.5×109/L),中位骨髓涂片白血病细胞计数百分比为5.5%(1.25%,13.75%)。复发/难治性AML 患者化疗前后血常规及骨髓细胞学检查结果详见表2。

表2 10 例复发/难治性AML 患者化疗前后血常规及骨髓细胞学检查Table 2 Cytological examination of peripheral white blood cell count,hemoglobin content,and platelet count,and bone marrow of 10 patients with refractory /relapsed acute myeloid leukemia before and after chemotherapy
2.3 疗效及生存分析 10 例复发/难治性AML 患者在VEN+Aza+HAAG 方案联合化疗前中位化疗次数为5 次,有2 例患者获得PR,1 例患者NR,其余7 例获得CR,且CR/PR 中位最长持续时间为4 个月,每位患者至少发生≥1 次疾病复发;经过标准剂量VEN+Aza+HAAG 方案联合化疗后5 例为CR,3 例为PR,2 例为NR,ORR 为80%,中位OS 为6.5(3.0,8.5)个月。10 例复发/难治性AML 患者的化疗方案及生存情况详见表3。
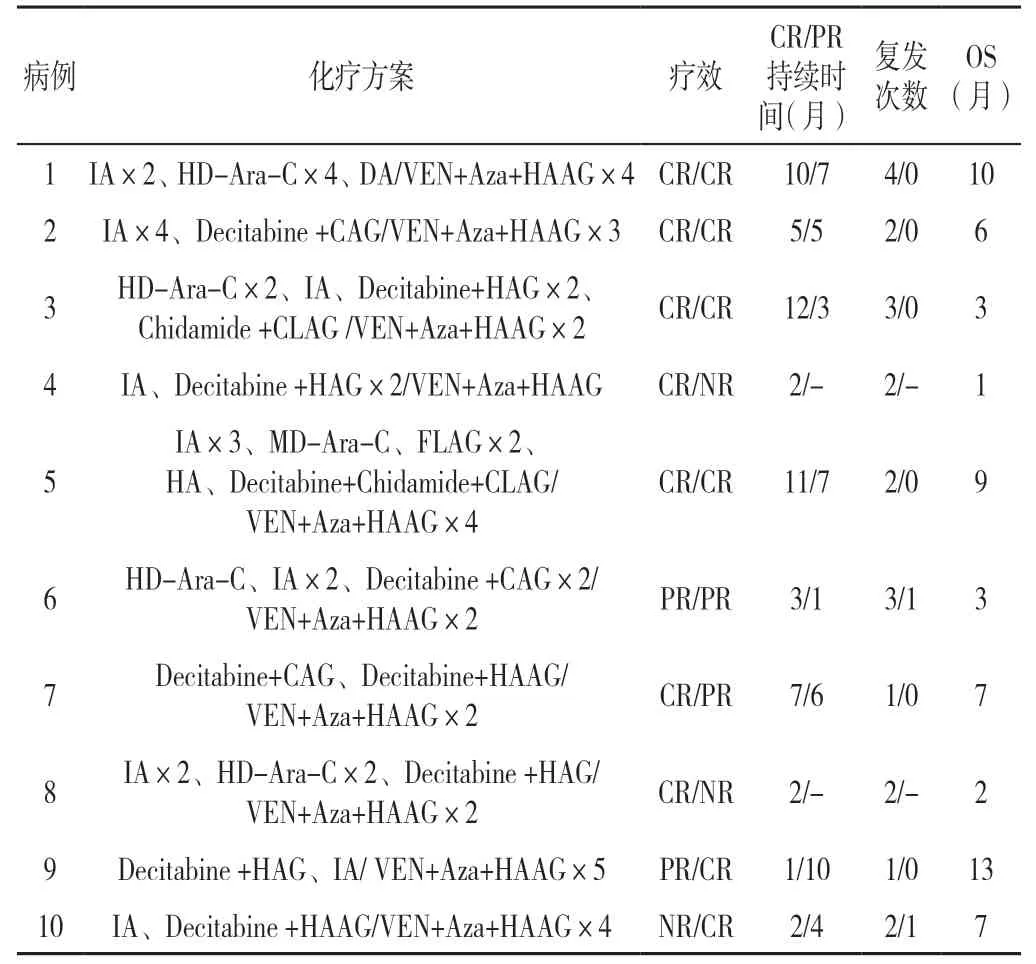
表3 10 例复发/难治性AML 患者的化疗方案及生存情况Table 3 Chemotherapy regimens and survival of 10 patients with relapsed/refractory acute myeloid leukemia
2.4 毒副作用 10 例复发/难治性AML 患者中4 例发生3 级骨髓抑制,6 例发生4 级骨髓抑制,包括中性粒细胞减少6 例、WBC 减少8 例、贫血4 例、PLT 减少8 例。10 例患者均发生了不同程度的感染,其中病例4 在治疗期间出现粒细胞缺乏,肺部严重细菌和真菌的混合性感染,经美罗培南、莫西沙星、伏立康唑联合治疗后感染控制尚可,其余患者均出现1~2 级感染,经抗感染等治疗后好转;病例2 在治疗期间出现严重的鼻衄,经去甲肾上腺素棉球填塞、膨胀海绵填塞等处理后好转,现患者就诊我院继续治疗中,并且出现1~2 级胃肠道症状(恶心、腹泻),经兰索拉唑抑酸护胃、蒙脱石散止泻等治疗后好转;病例3 和病例4 在治疗期间出现轻度肝功能不全,经还原型谷胱甘肽等保肝治疗后恢复正常。10 例复发/难治性AML 患者化疗期间的毒副作用详见表4。
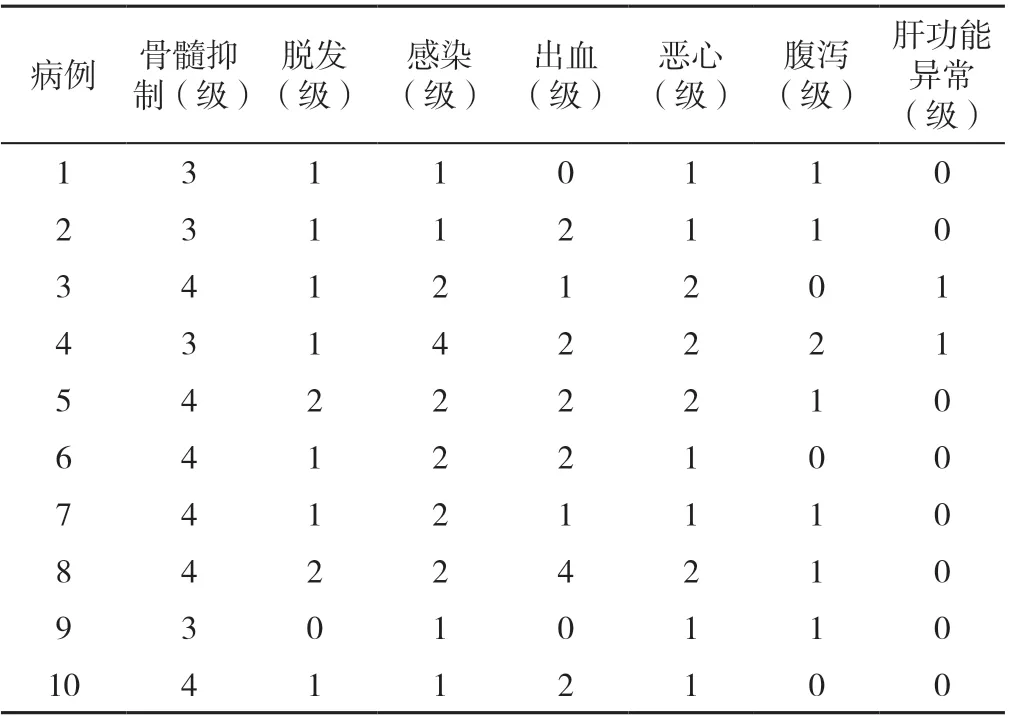
表4 10 例复发/难治性AML 患者化疗期间的毒副作用Table 4 Toxic and side effects during chemotherapy in 10 patients with relapsed/refractory acute myeloid leukemia
2.5 化疗后血常规恢复时间 10 例复发/难治性AML患者在化疗后均出现3~4 级骨髓抑制,WBC 中位恢复时间是21.00(19.25,22.00)d,中性粒细胞中位恢复时间是26.00(21.25,30.25)d,Hb 中位恢复时间是21.00(17.00,33.25)d,PLT 中位恢复时间是25.00(20.50,35.75)d;其中,病例3 和病例4 在化疗结束后2 个月内Hb 仍<110 g/L,病例2 和病例3 PLT 在化疗结束后2 个月内仍低于100×109/L。治疗期间,当患者PLT<20×109/L 时给予机采血小板、预防出血等对症支持治疗;Hb<70 g/L 时输注悬浮红细胞纠正贫血。10例复发/难治性AML 患者的化疗后血常规恢复时间详见表5。

表5 10 例复发/难治性AML 患者化疗后血常规恢复时间(d)Table 5 Peripheral blood recovery time after chemotherapy in 10 patients with relapsed/refractory acute myeloid leukemia
3 讨论
成人AML 和其他髓样恶性肿瘤患者的预后较差,复发/难治性AML 患者的预后更是不容乐观,中位生存期仅有4~6 个月,且长期生存率和治愈率<10%[8-10],目前主要方向是使用非交叉耐药或加大化疗药物剂量的化疗方案[11-12],常见的包括FLAG(氟达拉滨、Ara-c、G-CSF) 方 案、CLAG 方 案( 克 拉 屈滨、Ara-c、G-CSF) 等, 其 中FLAG 方 案ORR 为50%~60%,CLAG 方案CR 为57.9%,ORR 为77.2%;但是此类方案所需剂量高,患者易出现严重的骨髓抑制,易合并感染或出血,因此不适用于老年患者或不适应强化疗的患者,且此类方案不能克服AML 高危细胞遗传学方面的不良因素,患者综合收益较少,此外,对于不适合强化挽救化疗的患者常规选择HMA,如Aza、地西他滨或LDAC 等非强化方案,然而,在一项来自12 个中心的655 例患者的有效性研究中[13],该类化疗方案CR 率仅为11%,ORR 为 16.3%,可见这些方案均不是理想的治疗方法。VEN 是一种高选择性的口服BCL-2 生物抑制剂,已知AML 细胞,尤其是白血病干细胞,依赖BCL-2 生存,VEN 的抑制作用可诱导内源性凋亡途径导致AML 细胞快速凋亡,并根除静止期的白血病干细胞,在多种血液系统恶性肿瘤中具有活性[8]。VEN 作为治疗复发/难治性AML 患者的单一药物,已经显示出一定的临床活性,然而肿瘤细胞对该药易产生耐药性,因此克服耐药性显得尤为重要[14]。Aza 可能会降低MCL-1 的水平,而MCL-1是一种在AML 发病机制中至关重要的抗凋亡蛋白,并且可能是VEN 产生耐药性的重要原因之一。VEN 联合Aza 是最常见的组合方式[15],这种组合方式可以协同诱导细胞凋亡,协同激活AML 细胞中的线粒体凋亡,降低MCL-1 水平,从而降低对VEN 的耐药性。此外,有研究表明HMA(如地西他滨、Aza 等)联合HAAG方案在复发/难治性AML 的治疗中显示出更长的OS,并且阿扎胞苷似乎拥有更低的毒副作用发生率[16-17],这为VEN+Aza+HAAG 化疗方案提供了理论基础。本研究结果显示VEN+Aza+HAAG 方案CR 率为50%,ORR为80%,中位OS 为6.5 个月,说明此化疗方案有着良好的临床疗效。本研究病例较少,且大部分为年轻患者,这可能对结果产生了一定影响。哪种化疗方案更加适合复发/难治性AML 患者,后期可进行大样本的研究,以得出更客观的数据。
此外,有证据表明携带IDH、NPM1、RUNX1 基因突变的患者可获得超过90%的应答率,而具有TP53基因突变的患者的应答率仅为33%[18-19]。本研究具有不良细胞遗传学的病例6(RUNX1 基因突变)经过VEN+Aza+HAAG 方案化疗后疗效评估为CR,与上述观点相符合,这为VEN 联合基因靶向治疗提供了依据,而伴有复杂核型染色体的病例8(IDH2 基因突变)疗效不佳,基因突变对患者的应答率影响如何,未来仍需要更多的临床资料进行验证。
总之,复发/难治性AML 的治疗是一项仍未攻克的艰巨任务,本研究采用的VEN+Aza+HAAG 方案在复发/难治性AML 治疗方面显示出较为突出的作用,为临床治疗提供了一定参考。此外,考虑到异基因造血干细胞移植是治疗复发/难治性AML 的唯一方法,VEN+Aza+HAAG 化疗方案可以使一部分有反应的患者获得接受造血干细胞移植的机会,并为其他患者提供更长的OS,且毒副作用相对较低。但上述特点能否作为影响患者预后的独立因素,仍需扩大样本量进行研究,以期为复发/难治性AML 患者选出合理的个性化治疗方案。
作者贡献:陈晓奉、王蒙、李忠玉、李佳佳共同进行研究设计与实施;陈晓奉、王蒙负责数据收集与统计分析;陈晓奉、李佳佳负责撰写、修订论文,并对文章负责;李佳佳负责文章的质量控制及审校、监督管理。
本文无利益冲突。

