双重PCR技术鉴定番茄Sw-5和Ty-2基因
王 涛张子君张逸鸣王晓峰邹庆道
(辽宁省农业科学院蔬菜研究所,辽宁 沈阳 110161)
番茄斑萎病毒(TSWV)是一种极具破坏性的农作物病毒病原,严重威胁我国番茄生产。番茄感染TSWV后茎和叶片出现发育不良,叶片呈青铜色、卷曲、出现坏死斑点和条纹,产量也随之大幅度减少甚至绝收。TSWV的传播媒介主要是西花蓟马,带毒的成年蓟马感染一棵健康的植株只需30 min[1~2]。培育抗病番茄新品种是预防TSWV最直接有效的方法,研究者在栽培番茄和野生番茄中均发现有TSWV的抗源。迄今为止,已报道的抗病基因有8个,包括Sw1a,Sw1b,sw2,sw3,sw4,Sw-5,Sw-6和Sw-7[3~4],其中只有在秘鲁番茄中发现的Sw-5基因广泛应用在番茄育种中。Sw-5对TSWV的各种小种均表现较好的抗性,并且对番茄斑萎病毒属的其他病毒也具有抵抗作用。携带Sw-5的植株可有效地限制TSWV的扩散,仅在局部位置出现轻微过敏性症状。研究者利用RFLP分子标记将Sw-5定位在第9染色体临近端粒区域的长臂上,位于标记CT71和CT220之间[5]。随后Spassova等利用图位克隆法克隆了该基因[6]。Dianese等利用Sw-5序列的一个InDel突变,开发出一个共显性CAPS标记,该标记的扩增子包含了Sw-5b启动子的一段保守序列[7]。
番茄黄化曲叶病毒(TYLCV)同样是一种危害严重的番茄病毒,在世界上最重要的植物病毒中排名第三。TYLCV由粉虱传播引起,自传入我国南方地区以来,发展迅猛,目前已在多个省份大面积爆,市场上不抗TYLCV的番茄品种几乎难以推广应用。目前已报道的抗TYLCV基因有5个,包括Ty-1、Ty-2、Ty-3、Ty-4和Ty-5,育种实践中利用的抗性基因主要是前3个,部分高抗番茄品种甚至同时携带Ty-1、Ty-2和Ty-3三个抗性基因。Verlaan等克隆了Ty-1基因,同时发现该基因与Ty-3是等位基因[8]。Yang等利用图位克隆法将Ty-2定位在11号染色体上的UP8 (51.344 Mb)和M1 (51.645 Mb)标记之间[9]。Garcia等开发出一个与Ty-2紧密连锁的共显性SCAR标记T0302[10]。
利用分子标记辅助选择是快速准确筛选抗病育种材料最有效的方法,本研究获得了Sw-5和Ty-2的连锁分子标记,通过体系优化,建立同时检测番茄Sw-5和Ty-2基因的双重PCR技术,为聚合以上两个基因提供了技术支持。
1 材料与方法
1.1 材料
本研究所用番茄试材共27份,均来自辽宁省农业科学院蔬菜研究所番茄课题组。其中1、3和4号为纯合抗TSWV(Sw-5/Sw-5)材料,5、6、7、9和10号为杂合抗TSWV(Sw-5/Sw-5)材料,2和8号为不含Sw-5的感病材料。1号和6号为纯合抗TYLCV(Ty-2/Ty-2)材料,3、5、8、9和10号为杂合抗TYLCV(Ty-2/ty-2)材料,2、4和7号为不含Ty-2的感病材料。11-27号为抗性未知的待检测番茄材料。
1.2 引物
与Sw-5和Ty-2基因紧密连锁的SCAR标记分别参照Dianese等和Garcia等的设计(表1),引物均由生工生物工程(上海)股份有限公司合成[7,10]。

表1 所用引物的序列信息Table 1 The sequences of primers used in this research
1.3 单引物PCR扩增
在番茄植株幼苗期,采集新鲜叶片,采用CTAB法提取DNA,将DNA浓度稀释至5 ng/μl备用。用于PCR反应的所有药品均购自生工生物工程(上海)股份有限公司。单引物扩增的 PCR反应体系为 20 μl,包含DNA模板5 μl,上下游引物各1 μl(10 μmol/L),10×buffer 2 μl,dNTP0.5 μl(10 mmol/L),Taq酶(Sw-5)2U/(Ty-2)1U,ddH2O补足20 μl。PCR扩增在德国耶拿PCR仪上进行,反应程序分为3步,第一步:94 ℃预变性 5 min;第二步:94 ℃变性30 s,相应退火温度复性45 s,72 ℃延伸30 s,35个循环;第三步:72 ℃延伸10 min。PCR产物加入6×Loading buffer,然后在电泳仪上进行电泳检测。琼脂糖凝胶的浓度为3%,goodview染色,固定电压120 V,电泳时间为20 min,然后将琼脂糖凝胶取出,在BIO-RAD Gel Doc XR+凝胶成像系统下进行拍照。
1.4 双重PCR扩增
双重PCR反应体系为20 μl。通过体系优化和反应程序调整,最终确定双重 PCR体系为:模板DNA 5 μl,两对上下 游 引物 各0.75 μl (10 μmol/L) ,dNTP 0.5 μl (10 mmol/L),10×Buffer 2 μl,Taq酶2U,ddH20补充至20 μl。多重PCR反应程序为94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火45 s,72 ℃延伸1 min,循环次数为40个,72 ℃再延伸10 min。
2 结果与分析
2.1 Sw-5基因连锁标记的PCR扩增
利用Sw-5的共显性SCAR标记对10份番茄材料进行PCR扩增,1、3和4号纯合抗TSWV材料扩增出574 bp特异条带,5、6、7、9和10号杂合抗TSWV材料扩增出574 bp和464 bp两条特异条带,2和8号不含Sw-5感病材料扩增出464 bp特异条带(图1A)。
2.2 Ty-2基因连锁标记的PCR扩增
利用Ty-2的连锁标记T0302对上述10份材料进行PCR扩增,1和6号纯合抗TYLCV材料扩增出900 bp特异条带,3、5、8、9和10号杂合抗TYLCV材料扩增出800 bp和900 bp 2条特异条带,2、4和7号不含Ty-2的感病材料扩增出800bp特异条带(图1B)。
2.3 同时扩增Sw-5和Ty-2基因的双重PCR体系的建立
将两对特异引物在同一个PCR反应体系中扩增后,同时含有纯合Sw-5和Ty-2基因的抗病材料(1号)扩增出574 bp和900 bp特异条带;含有纯合Sw-5和杂合Ty-2基因的抗病材料(3号)扩增出了574 bp、800 bp和900 bp 3条带;含有纯合Sw-5而不含Ty-2基因的材料(4号)扩增出了574 bp和800 bp特异条带;含有杂合Sw-5和纯合Ty-2基因的抗病材料(6号)扩增出464 bp、574 bp和900 bp 3条带;同时含有杂合Sw-5和Ty-2基因的抗病材料(5、9和10号)扩增出4条带;含有杂合Sw-5而不含Ty-2基因的材料(7号)扩增出了464 bp、574 bp和800 bp 3条带;不含Sw-5而含有杂合Ty-2基因的材料(8号)扩增出464 bp、800 bp和900 bp 3条带;两个抗病基因均不含的感病材料(2号)扩增出464 bp和800 bp特异条带(图1C)。双重PCR扩增出的条带清晰,长度差异明显,极为容易辨识,并且与单引物PCR检测结果完全吻合,因此该双重PCR体系可以同时鉴定Sw-5和Ty-2基因。

图1 连锁标记的PCR扩增产物Figure 1 The PCR products amplified by linked markers
2.4 利用双重PCR技术筛选抗病番茄材料
利用上述建立的双重PCR技术对17份抗性未知的待检测番茄材料进行鉴定(图2)。结果显示:11号材料扩增出574 bp和800 bp条带,为纯合抗TSWV材料;12、18、22、24、25和26号扩增出4条带,为杂合抗TSWV和TYLCV材料;13和21号扩增出464 bp、800 bp和900 bp 3条带,为杂合抗TYLCV材料;14和27号扩增出464 bp和800 bp 2条带,不含Sw-5和Ty-2基因;15、17和19扩增出464 bp、574 bp和900 bp 3条带,为杂合抗TSWV,纯合抗TYLCV材料;16和20扩增出464 bp、574 bp和800 bp 3条带,为杂合抗TSWV材料;23号扩增出574 bp、800 bp和900 bp 3条带,为纯合抗TSWV,杂合抗TYLCV材料。
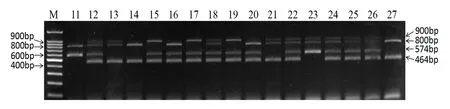
图2 17份番茄材料的双重PCR扩增结果Figure 2 The double PCR result of 17 tomato lines
3 结论与讨论
番茄是病害较多的一种蔬菜作物,种植户对番茄品种的抗病性要求也越来越高,优良的番茄品种要抗6种以上主流病害,筛选抗病材料一直都是番茄育种的重要内容。目前,分子标记辅助选择已经是很常规的育种手段,利用连锁标记对抗病基因进行鉴定,同时进行基因聚合育种是培育多抗、高抗番茄新品种最有效的方法。对番茄育种试材进行抗病性鉴定往往涉及多个抗性基因,常规PCR检测已不能满足目前的育种需求,因此研究者建立了可以同时鉴定数个目标基因的多重PCR技术。例如,利用多重PCR鉴定Ty-1、Ty-3和Mi基因[11],Ty-3a和Tm-2a基因[12],Sw-5和Ty-3a基因等[13],然而未见有关Sw-5和Ty-2基因的多重PCR报道。本研究选择的两对引物是目前鉴定Sw-5和Ty-2基因应用最广泛的连锁SCAR标记,无需酶切,实验操作简单,共显性的标记特性可区分杂合抗病材料。在研究中我们发现Sw-5的连锁标记对PCR反应体系要求较高,起初的PCR扩增条带较为模糊,且无法使用更为快捷的Taq PCR Mix溶液进行扩增。我们经过对扩增体系的优化,相应提高了Taq酶含量,实验结果十分理想,条带清晰明亮。而Ty-2基因的T0302引物的PCR扩增较为顺利,无论是常规PCR药品还是Taq PCR Mix均可扩增出理想的条带。因此,本研究在摸索双重PCR体系时,相应调整了引物浓度、Taq酶含量、退火温度和PCR反应循环次数,最终结果较为理想,无杂带干扰,每一种基因型均可轻易识别。根据Dianese等报道,Sw-5的连锁标记可扩展出574 bp、510 bp和464 bp 3种带型,本试验只扩增出两种,510 bp带型并未出现,其原因可能是本研究试材有限,未能覆盖该标记的所有等位基因[7]。
随着分子生物技术的发展,分子标记辅助育种的效率也大幅度提高,研究者将已开发的连锁标记转化为KASP标记,借助高通量的分子检测平台,可在短时间完成大量试材的基因型鉴定工作,目前国内已建立了一些高通量分子检测平台,对外承接分子检测业务。这种高通量的检测方法不可能覆盖所有目标基因,常规的PCR检测方法也是分子育种必备的一种技术。本研究建立的双重PCR技术,操作简单,稳定可靠,极大地提高了Sw-5和Ty-2基因的鉴定效率。

