君子兰胚抢救及叶片再生体系建立研究
吴海红李 丹赵兴华
(辽宁省农业科学院花卉研究所,辽宁 沈阳 110161)
君子兰(Cliviaminiata),别名剑叶石蒜、大叶石蒜,是石蒜科君子兰属多年生草本观赏盆花,原产于南非南部,它的原种从发现到现在只有200年左右的历史[1]。君子兰在世界各地广为栽培,是全球最重要的盆栽花卉之一,因其宽厚光亮的叶、艳丽的花簇和鲜红或橙黄的果实而深受人们的喜爱[2]。20世纪初经日本和德国两个途径传入我国,经我国君子兰爱好者的多年培育,20世纪80年代成为我国较为名贵的盆栽花卉之一。花大色艳、花期长,叶片也具有较高的观赏价值,一季观花、二季观果、四季观叶。
国内君子兰繁殖都是民间各自进行,现有品种仍然是一家一户的手工作坊式繁殖。辽宁鞍山君子兰产业占地达240 hm2,年产1.6亿株,年收入4.2亿元,总产量占全国君子兰份额50% 以上,位列全国第一。但由于君子兰基因型高度杂合,现有的繁殖方法播种和分株繁殖法,繁殖速度慢、后代性状分离严重,种苗性状不一致,不利于规模化生产[3]。在市场竞争日趋激烈情况下,供给侧改革对生产方提出了更高的要求,必须从源头创新,改变君子兰原有的繁育技术体系,采用组织培养方法进行快繁是最行之有效的技术手段。方法是选用君子兰未完全成熟的种子,此时胚乳的木质化程度低,便于剥离幼胚,对胚进行人工抢救培养,利用胚抢救获得的君子兰无菌试管苗的叶片开展试验研究[4]。君子兰试管苗的叶片相比较于成品株叶片组织幼嫩,细胞活性强,材料本身无菌。本试验在辽宁省农业科学院花卉研究所组培实验室中进行。
1 材料与方法
1.1 试验材料和途径
选择君子兰未完全成熟的果实,剥离种胚,以胚抢救方法获得的试管苗叶片为外植体,通过外植体叶片→诱导愈伤组织(或者不定芽)→不定芽诱导→叶片诱导→生根培养的途径开展研究。
1.2 试验方法
1.2.1 外植体材料的选择选择优良的君子兰当年授粉未完全成熟果实,分别选取授粉后60 d、90 d、120 d和150 d的果实。
1.2.2 外植体材料的无菌处理及接种方法1:在超净工作台上将果实先用75%医用酒精浸泡1 min,然后用0.1%的升汞溶液浸泡处理1、3、5 min,最后用无菌水冲洗3~5次,无菌滤纸吸干表面水分备用。
方法2:在超净工作台上将果实先用75%医用酒精浸泡1 min,然后在接种盘内剥离果皮,将种子浸入75%医用酒精,杀菌3 min,然后用无菌水冲洗3~5次,无菌滤纸吸干表面水分备用。
方法3:在超净工作台上先用75%医用酒精对果实浸泡1 min,然后将果实在酒精灯火焰上迅速的燎烧1遍,放入接种盘备用。
将处理完的君子兰果实或种子在接种盘内剥离果皮,分离胚珠,对种胚进行接种(图1~3)。

图1 果实
1.2.3 君子兰不同发育时期胚诱导胚性愈伤组织将授粉后60 d、90 d、120 d和150 d的君子兰果实表面杀菌处理后,在接种盘内剥离果皮,剥出种子,去除胚乳,将不同发育时期的种胚接种到胚诱导培养基中。
1.2.4 君子兰胚性愈伤组织诱导和丛生芽诱导培养基激素组合基本培养基选择Ms,搭配不同激素浓度组合,同时添加蔗糖30 g/L,琼脂粉5 g/L,pH 5.8。各组培养基试验均采用正交实验设计,各因素水平设计16个处理,每个处理接种10个外植体材料。
观察外植体的生长发育变化,统计各个阶段诱导率,从而确定最适合的培养基。
1.2.5 君子兰叶片诱导培养基设计利用君子兰试管苗的幼嫩叶片作为外植体,将叶片横切为叶尖、叶间和叶基3部分,分别接种到叶片诱导培养基,培养基不同激素处理设计9个组合,观察其诱导情况。
1.3 培养条件
置于光照培养室培养,培养温度(25±2)℃,光照时间12 h/d,光照强度2 000~2 500 lux。

图2 种胚

图3 种胚接种
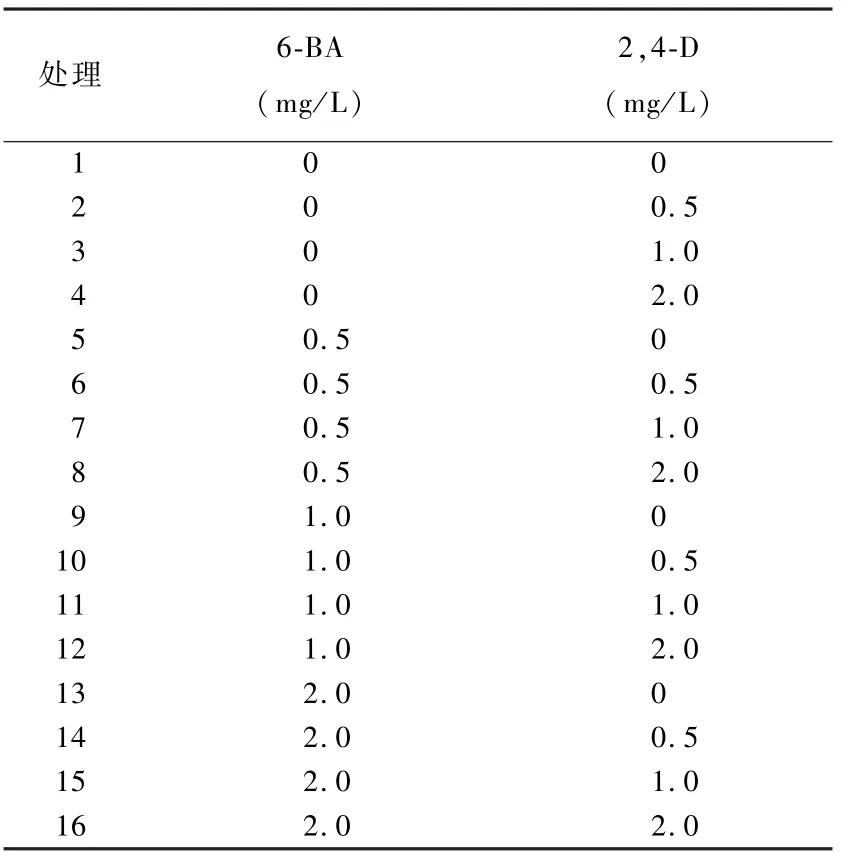
表1 诱导胚性愈伤组织不同浓度6-BA和2,4-D组合
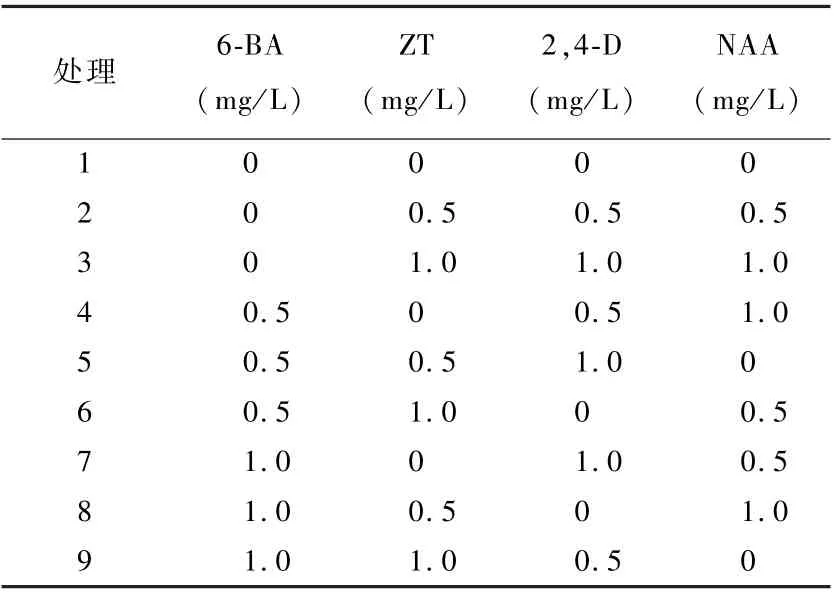
表2 君子兰叶片诱导培养基不同激素处理组合
2 试验结果
2.1 不同表面消毒方法
君子兰果实的3种表面杀菌法都实现完全无污染。
方法1是传统的灭菌方法,升汞处理1、3、5 min效果相同,所以最佳灭菌时间选择1~3 min即可;对于果皮有破损暴露空气中的种子必须采取此方法。方法2是相对简单和环保的灭菌方法,效果不一定最佳,但对于君子兰果实75%酒精浸泡3 min完全可以。方法3是最环保的灭菌方法,对材料存在一定的风险,对君子兰果实可行。
2.2 不同发育时期胚对诱导胚性愈伤组织的影响
授粉后60d有的无胚,有的胚只有1mm,胚乳水状、透明,愈伤组织诱导成功率仅有10%;授粉后90 d的胚有3 mm,胚乳果冻状、透明,愈伤组织诱导成功率30%;授粉后120 d的胚有5 mm,胚乳固态、半透明,愈伤组织诱导成功率60%(图4)。授粉后150 d以上的胚大小如种子直径,胚乳乳白色、不透明,愈伤组织诱导成功率80%以上(图5)。

图4 不同发育时期胚(分别为授粉后60 d、90 d和120 d的胚)

图5 胚性愈伤组织诱导芽
2.3 不同激素组合对胚性愈伤组织诱导的影响
由试验可知,6-BA和2,4-D对君子兰胚培养都有作用,2,4-D的作用要强于6-BA,二者协同作用效果更好。如表3所示,随着2,4-D浓度的增加愈伤组织的诱导率增加,6-BA浓度的增加对愈伤组织的诱导没有递增趋势;6-BA与2,4-D共同作用效果更好。最佳组合为8、11、12、15和16号处理(表3)。

表3 不同浓度6-BA和2,4-D组合对胚性愈伤组织诱导的影响
2.4 君子兰试管苗叶片不同部位诱导效果
叶片不同部位对诱导成功的影响起决定性作用,试验表明:君子兰幼嫩叶片各个部位均能诱导出愈伤组织(图6),基部最易诱导出芽体(图7)。

图6 叶片诱导愈伤组织

图7 叶片诱导芽
2.5 不同激素组合对君子兰叶片诱导愈伤组织和不定芽的影响
由表4可知,9个不同处理除对照外都能诱导出不定芽,但总体诱导率不高;ZT和2,4-D组合对诱导影响比较大,当ZT为0时,随着BA和2,4-D浓度升高诱导率升高;由处理3可知,BA为0 mg/L时对诱导率没有影响;由处理4和处理7可知,当ZT为1 mg/L,随着2,4-D浓度的增加诱导率增加;由处理3、处理5、处理7可知,当2,4-D一定时,添加ZT和未添加ZT对叶片诱导愈伤组织和丛生芽率影响显著。

表4 不同浓度激素组合对君子兰叶片诱导的影响
3 结论
本试验可知君子兰外植体种胚最佳采摘时间为授粉后120~150 d;最佳叶片诱导部位为基部;君子兰芽苗获得途径一是通过胚性愈伤组织诱导,二是通过试管苗叶片基部诱导。最佳胚诱导培养基为MS+6-BA 1~2 mg/L + 2,4-D 1~2 mg/L,胚性愈伤组织平均诱导率达到 80%;最佳叶片诱导愈伤组织和不定芽培养基为 MS+2,4-D 1.0 mg/L + ZT 1.0 mg/L + NAA 1.0 mg/L。

