薯蓣粥对2型糖尿病大鼠肠道通透性的影响
洪雪珮,庞书勤,葛 莉,戴燕铃,林心君,李 霞,吴异兰,王冠明,张佳惠
(福建中医药大学护理学院,福建福州 350122)
2型糖尿病(Type 2 diabetes mellitus,T2DM)是一种慢性疾病,胰岛素抵抗(Insulin resistance,IR)是T2DM的发生、发展的关键问题[1-2]。伴随着检测技术的不断进步,诸多研究不断揭示T2DM的发生发展与肠道菌群密切相关:肠道是体内的储菌库,T2DM伴发肠道菌群紊乱,具体表现为有害菌增多,益生菌减少,这将引发肠黏膜炎性反应,破坏肠道屏障结构和功能,使肠道通透性增加,肠道内大量的有害菌、毒素经被破坏的肠道屏障进入全身各组织,大量激活全身促炎因子释放(如TNF-α、IL-6等),诱发或加重机体的炎症反应,这些被大量释放的促炎因子能够破坏胰岛β细胞、干扰胰岛素的信号传导,加重胰岛素抵抗[3-6]。国内外研究显示,益生菌及其发酵合成的短链脂肪酸(Short-chain fatty acids,SCFAs)具有降低肠道炎性反应、修复肠上皮屏障的作用,能够增加肠上皮细胞紧密连接蛋白的表达,修复受损的肠道屏障[7-8]。薯蓣粥出自张锡纯的著作《医学衷中参西录》,是一味经典的中医食疗方,课题组前期研究发现:薯蓣粥能够促进T2DM患者肠道内双歧杆菌生长,促进T2DM大鼠肠道内阿克曼氏菌、梭菌等益生菌的生长,改善肠道菌群紊乱、增加SCFAs含量[9-10],由此推测薯蓣粥在调节T2DM大鼠肠道菌群、增加SCFAs的基础上,可望减轻T2DM大鼠肠道炎症反应,增加肠上皮紧密连接蛋白的表达,降低肠道通透性,下调全身炎症反应,改善胰岛素抵抗、降低血糖。本研究建立T2DM大鼠模型,通过观察各组大鼠相关指标变化,探讨薯蓣粥对T2DM大鼠肠道通透性的影响,以期对薯蓣粥的再续性研究及推广应用提供科学依据。
1 材料与方法
1.1 材料与仪器
35只SPF级雄性Wistar大鼠(8周龄) 上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2012-0011,体重(180±10)g,在某大学动物中心清洁级动物房内饲养(伦理批号:2019-33);高脂饲料闽侯实验动物贸易有限公司(中国福州);生铁棍山药 福州市闽侯县上街致诚医药商店;二甲双胍片
格华止,0.85g/片,国药准字:H20023371;链脲佐菌素(STZ) Sigma公司;血糖试纸 福州贝尔曼生物科技有限公司;大鼠胰岛素(INS)、连蛋白酶联免疫分析试剂盒 酶联生物科技有限公司;大鼠白介素-6、肿瘤坏死因子-α、内毒素酶联免疫分析试剂盒南京建成生物科技有限公司;浓缩型正常山羊血清、荧光(DyLight 488)标记羊抗兔IgG、即用型SABCPOD(兔IgG)试剂盒、大鼠白介素-6抗体、肿瘤坏死因子-α抗体、内源性过氧化物酶阻断剂、EDTA抗原修复液(10×)、抗体稀释液、PBS漂洗液 武汉博士德生物科技有限公司。
Contour TS拜安康血糖仪 德国拜耳公司;ELX808型酶联免疫检测仪 美国BIO-TEK公司;BX51显微镜 日本奥林巴斯株式会社;TGL-16B型台式高速离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 灌胃溶液的制备 薯蓣粥:实验所需山药在指定商家购买,每日制作薯蓣粥。山药去皮后称重125 g,切片、入匀浆机,加水50 mL打成糊,250 mL凉水调入,中火加热至煮沸,维持30 s后再文火加热30 s,中火30 s-文火30 s连煮3次,过程中不中断地轻轻搅拌,最后成粥状,浓度为0.5 g/mL,冷却至37 ℃使用。根据体表面积计算方法[11]得出:每只大鼠的灌胃量是20 mL/kg·d。本实验用的T2DM大鼠体重为250~300 g,计算出灌胃剂量为5~6 mL。课题组前期实验发现,每只大鼠每次灌胃5 mL时大鼠不易死亡[10],因此每只大鼠每日灌胃5 mL薯蓣粥,其中的山药含量为5 mL/d×0.5 g/mL=2.5 g/d。二甲双胍水溶液:依据文献[11]换算得出,每只大鼠每日需100 mg/kg二甲双胍,根据大鼠体重计算出每日所需的二甲双胍药量,将所需二甲双胍药物研磨成粉,融入5 mL生理盐水,现配现用。
1.2.2 造模 将35只雄性Wistar大鼠称重、编号,使用随机数字表发随机分为空白组(8只),造模组(27只)。造模组以高脂饲料喂养6周,参照施红团队的高脂高糖饲料联合腹部小剂量注射1% STZ溶液法进行T2DM大鼠造模[12]。空白组大鼠以普通饲料喂养6周,造模日在腹腔注射等容积的柠檬酸钠缓冲液。造模72 h后经尾静脉采血测量空腹血糖(Fasting blood glucose,FBG),以FBG>11.1 mmol/L判断造模情况。本次27只大鼠进行造模,成功23只,成模率为85%。
1.2.3 分组与干预 本次造模共成模23只大鼠,使用随机数字表法进行分组如下:模型组8只,薯蓣粥组7只,二甲双胍组8只。干预方法:空白组和模型组每日以5 mL生理盐水灌胃,薯蓣粥组大鼠每日以5 mL薯蓣粥灌胃,二甲双胍组每日以5 mL二甲双胍溶液灌胃。所有大鼠在灌胃期间正常饮水,喂养普通饲料,共干预6周。
1.2.4 指标检测 干预期间每周检测空腹血糖,干预结束后,所有大鼠使用2%戊巴比妥钠腹腔麻醉注射,抽取腹主动脉血2 mL,取1 cm的结肠组织两份,将每份结肠组织份用4℃磷酸盐缓冲液冰上漂洗3遍,再用无菌滤纸吸干,放入15 mL 4%多聚甲醛溶液的EP管内固定,后进行石蜡包埋。选取指标及对应检测方法如下:
1.2.4.1 结肠组织病理学变化 用HE染色法观察结肠组织病理学变化。将石蜡组织块切片、烘烤30 min(60 ℃),放入二甲苯溶液中脱蜡,再将切片依次放入浓度呈梯度下降的酒精、蒸馏水中。切片经梯度下降的酒精-蒸馏水洗涤后,移入苏木精溶液中浸泡,然后在用蒸馏水中洗去残余的染色液。用1%的盐酸酒精分色30 s,随后在蒸馏水中放置约5 min洗净。将染色后的切片依次放入浓度呈梯度升高的酒精及二甲苯溶液中,取出后滴树胶、封片,待切片干燥后在电子显微镜下观测结肠组织的病理表现并拍照记录[13]。
1.2.4.2 结肠TNF-α、IL-6蛋白表达 使用免疫组织化学法监测结肠TNF-α、IL-6蛋白表达。将包埋好的蜡块送至福州沃森生物科技有限公司进行检查。结果观察方法[14]:a.在透射电镜下直接观察切片情况,TNF-α与IL-6均染色在细胞质,阳性染色为黄褐色,黄褐色面积越多、颜色越深说明该蛋白的表达越高;b.使用Image J软件计算样本的强染色、中度染色、弱染色、阴性染色的面积(%),使用组织化学评分(histochemistry score,H-Score)进行计算:HScore评分=1×弱染色面积(%)+2×中度染色(%)+3×强染色(%),评分越高说明该蛋白的表达量越高。
1.2.4.3 结肠组织Occludin、ZO-1蛋白表达 使用免疫荧光组织化学法监测结肠Occludin、ZO-1蛋白表达,将包埋好的蜡块送至福州沃森生物科技有限公司进行检查。结果观察方法[14]:a.在共聚焦显微镜下观察切片情况,Occludin与ZO-1的阳性染色为荧光绿色,荧光绿色面积越多、颜色越深,说明该蛋白的表达越高;b.使用Image J软件计算样本的平均荧光强度,荧光强度越高,说明该蛋白的表达量越高。
1.2.4.4 血清Zonulin、LPS、TNF-α、IL-6、FINS取血后立即使用冰冻离心机离心(12000 r/m),取上清液冰冻保存(-80 ℃),使用ELISA法监测上述指标,操作步骤严格按照ELISA试剂盒上的说明进行。根据FINS和FBG计算胰岛素抵抗指数(HOMAIR):胰岛素抵抗指数=(空腹血糖×空腹胰岛素)/22.5。
1.3 数据处理
采用SPSS20.0软件进行统计分析,计量资料符合正态分布时采用单因素方差分析,否则用秩和检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 大鼠一般情况
本研究共纳入8只空白组大鼠,23只T2DM大鼠,纳入的大鼠皆完成灌胃干预和样本采集,无大鼠死亡。成模的T2DM大鼠出现倦怠、活动少、多饮、多食、多尿、粪便变稀等情况,模型组大鼠的FBG极显著高于空白组(P<0.001),体重显著低于空白组(P<0.05),见表1。空白组大鼠精神状态好,活动多,反应灵活,毛发整洁,光泽度好;进食、饮水量均正常,一般情况明显优于T2DM大鼠。本实验中的T2DM大鼠空腹血糖明显升高,体重减轻,还伴有糖尿病典型的“三多一少”症状,说明本实验制造的T2DM大鼠模型符合T2DM的特点。
表1 造模后大鼠血糖、体重比较(±s)Table 1 Comparison of FBG and body weight of rats after modeling (±s)

表1 造模后大鼠血糖、体重比较(±s)Table 1 Comparison of FBG and body weight of rats after modeling (±s)
注:*:与空白组相比,P<0.05;#:与空白组相比,P<0.001。
?
2.2 各组大鼠肠道通透性改变
2.2.1 各组大鼠结肠组织HE染色情况 由图1可知,空白组大鼠的结肠黏膜组织未见明显异常损伤,肠绒毛排列整齐,连接完整;模型组大鼠可观察到肠绒毛断裂不全且间隔稀疏,同时伴有中性粒细胞渗出,说明T2DM大鼠结肠组织受损,可能存在炎症反应,与其他研究结果一致[13];本研究还发现,与模型组相比,薯蓣粥组、二甲双胍组大鼠的肠绒毛排列较为整齐,完整性较好,中性粒细胞渗出减少,说明薯蓣粥、二甲双胍均能在一定程度上缓解T2DM大鼠结肠组织的损伤情况。并且,薯蓣粥组、二甲双胍组的HE染色切片在肉眼观察下没有明显差异。HE监测只能提供结肠组织的大略受损情况,可进一步进行更详尽的检测以明确不同干预手段对T2DM大鼠肠道通透性的影响。

图1 各组大鼠结肠组织HE染色结果(100×)Fig.1 HE staining results of colon tissue of rats in each group (100×)
2.2.2 各组大鼠结肠TNF-α、IL-6的免疫组化结果分析 图2中,模型组与空白组相比,TNF-α、IL-6蛋白染色的阳性区域多,且颜色较深;薯蓣粥干预后能减少TNF-α、IL-6蛋白的阳性染色区域,降低阳性染色的深度,二甲双胍组与薯蓣粥组相比差异不明显。分析不同组大鼠的H-Score评分发现:与空白组相比,模型组大鼠的TNF-α、IL-6表达水平升高(P<0.01);与模型组相比,薯蓣粥组大鼠的TNF-α、IL-6表达水平降低(P<0.01),而薯蓣粥组、二甲双胍组之间没有显著差异(P>0.05),见表2。

图2 各组大鼠结肠组织TNF-α、IL-6免疫组化染色结果(100×)Fig.2 Immunohistochemical staining results of TNF-α, IL-6 in colon tissue of rats in each group (100×)
表2 各组大鼠结肠组织TNF-α、IL-6的H-Score得分比较(±s)Table 2 Comparison of H-score scores of TNF-α and IL-6 in colonic tissue of rats in each group (±s)
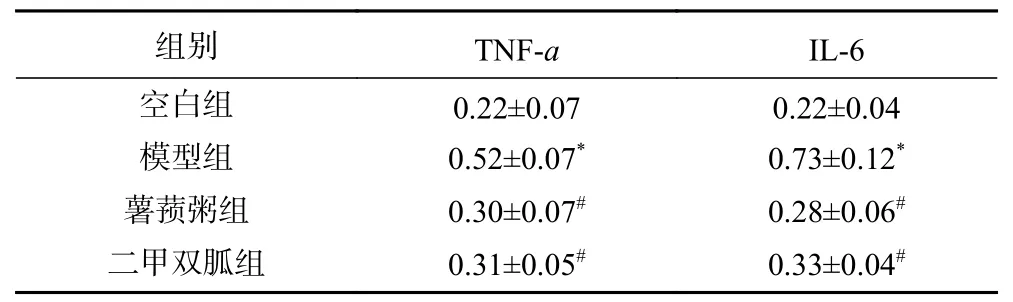
表2 各组大鼠结肠组织TNF-α、IL-6的H-Score得分比较(±s)Table 2 Comparison of H-score scores of TNF-α and IL-6 in colonic tissue of rats in each group (±s)
注:*:与空白组相比,模型组P<0.01;#:与模型组相比,样品组P<0.01;表3、表6同。
?
本研究发现:T2DM模型组大鼠的结肠TNF-α、IL-6蛋白含量明显升高,提示T2DM大鼠结肠组织促炎因子升高,存在炎症反应,与其他研究结果一致[15-16];高脂饮食诱导的T2DM大鼠出现肠道菌群失调,产生内毒素[15],低水平的内毒素虽然无法引起明显的肠道感染,但能够促进炎症因子(如TNF-α、IL-6、IL-1β等)分泌,造成T2DM大鼠肠道炎症水平升高[4,17];本研究中,薯蓣粥能显著降低T2DM大鼠结肠的TNF-α、IL-6蛋白表达(P<0.01),说明薯蓣粥能够有效下调T2DM大鼠肠道炎症反应。有研究指出,SCFAs是细菌的代谢产物,主要包括乙酸、丙酸、丁酸,丁酸能够下调高脂饲料喂养的载脂蛋白E基因敲除小鼠结肠组织中炎症因子IL-1β水平,说明丁酸能够下调肠道炎症反应[18]。课题组前期研究中已经证实薯蓣粥能够增加T2DM大鼠SCFAs的含量[10]。因此,推测薯蓣粥可能通过增加T2DM肠道内SCFAs的表达,下调结肠促炎因子表达,降低肠道炎症。
2.2.3 各组大鼠结肠ZO-1、Occludin免疫荧光组织化学法结果分析 ZO-1、Occludin定位于细胞膜,阳性物质染色均为荧光绿色,蓝色荧光为细胞核DAPI染色;Merge是DAPI染色与目标蛋白阳性染色的结合(ZO-1染色结果见图3;Occludin染色结果见图4)。图3、图4中可见:模型组大鼠的Occludin、ZO-1蛋白的荧光染色强度低于空白组,阳性染色面积少于空白组,且皆分布零星,存在多处断裂,连续性和完整性较差。与模型组相比,薯蓣粥组大鼠结肠的Occludin、ZO-1蛋白荧光染色强度更高,阳性染色面积更多,Occludin、ZO-1蛋白分布的连续性和完整性较模型组有所改善。利用Image J软件计算平均荧光强度并进行数据分析:模型组大鼠Occludin、ZO-1蛋白的平均荧光强度较空白组显著下降(P<0.01);薯蓣粥组、模型组大鼠Occludin、ZO-1蛋白的平均荧光强度均高于模型组(P<0.01),薯蓣粥组与二甲双胍组之间没有统计学差异(P>0.05),见表3。
表3 各组大鼠结肠ZO-1、Occludin平均荧光强度值比较(±s)Table 3 Comparison of the average fluorescence intensity of ZO-1 and Occludin in colon of rats in each group (±s)

表3 各组大鼠结肠ZO-1、Occludin平均荧光强度值比较(±s)Table 3 Comparison of the average fluorescence intensity of ZO-1 and Occludin in colon of rats in each group (±s)
?

图3 各组大鼠ZO-1蛋白比较(100×)Fig.3 Comparison of ZO-1 of rats in each group during intervention (100×)

图4 各组大鼠Occludin蛋白比较(100×)Fig.4 Comparison of Occludin of rats in each group during intervention (100×)
本研究发现,与空白组相比,模型组大鼠结肠组织ZO-1、Occludin蛋白表达均明显下降,提示T2DM大鼠肠组织受损,肠道紧密连接蛋白含量减少,肠道通透性增加,与其他研究结果一致[19];有研究认为,T2DM大鼠存在肠道炎症反应,将导致炎症因子(如TNF-α、IL-6、IL-1β等)分泌增多,这些炎症因子会破坏肠道紧密连接蛋白的表达和分布,增加肠道通透性[17],本研究中T2DM大鼠结肠组织的炎症水平升高,肠道紧密连接蛋白表达下降,可以佐证这一观点。本研究还发现,薯蓣粥能显著提高T2DM大鼠结肠组织Occludin、ZO-1蛋白表达(P<0.01),结合2.2.2可知:薯蓣粥能够有效下调T2DM大鼠肠道炎症反应,保护T2DM大鼠的肠道屏障,降低肠道通透性。研究表明[20]:山药多糖CYP-1能够抑制结肠炎小鼠结肠NF/κB炎症信号通路的激活,减轻肠道炎症,进而增加紧密连接蛋白的基因表达,表明山药中的有效成分能够通过降低肠道炎症反应,降低肠道通透性,与本研究结果相符;研究表明,肠上皮细胞通过接收肠道微生物或入侵病原体的信号,来调节肠黏膜屏障和免疫细胞,适应肠道环境变化,能够向肠上皮细胞传递信号的肠道微生物主要有细菌、和细菌的代谢产物[21]。SCFAs是细菌的代谢产物,主要包括乙酸、丙酸、丁酸,目前已被证实SCFAs在维持肠道屏障的完整性中发挥重要作用:丁酸能够下调高脂饲料喂养的载脂蛋白E基因敲除小鼠结肠组织中炎症因子IL-1β水平,增加紧密连接蛋白Occludin 、ZO-1的表达,说明丁酸能够调节肠道炎症反应,降低肠道通透性[18,22]。课题组前期研究中已经证实薯蓣粥能够增加T2DM大鼠SCFAs的含量[10]。因此,推测薯蓣粥可能通过增加SCFAs,下调结肠促炎因子表达,降低肠道炎症,保护肠道黏膜屏障,降低肠道通透性。
2.2.4 各组大鼠血清Zonulin、LPS、TNF-α、IL-6水平比较 与空白组相比,模型组大鼠血清Zonulin、LPS、TNF-α、IL-6含量均升高(P<0.05);与模型组相比,薯蓣粥组大鼠血清Zonulin、LPS、TNF-α、IL-6含量均下降(P<0.05),薯蓣粥组IL-6的含量低于二甲双胍组(P<0.05),见表4。当肠道通透性升高时,Zonulin经肠组织进入血液,血液中的Zonulin水平可在一定程度上反映肠道损伤情况[23-24]。LPS是炎症刺激物,在肠道通透性升高时,能够通过损伤的肠道进入循环系统,诱导全身促炎因子释放,引起血液中TNF-α、IL-1β、IL-6含量上升,诱发全身低度炎症反应[13]。本研究发现,与空白组相比,模型组大鼠的血清Zonulin、LPS、TNF-α、IL-6表达均升高(P<0.05),说明在伴随着肠道通透性增加,T2DM大鼠肠道中Zonulin、LPS被释放入血,引发机体产生全身低度炎症反应[24]。机体在健康情况下,肠道屏障可以阻挡致病因素进入血液循环和其他器官,是机体抵抗病原微生物、各种毒素的第一道防线,而紧密连接蛋白是肠黏膜结构的重要组成部分,一旦发生变异、减少,都会导致肠道的屏障功能被破坏,肠道通透性增加,各种毒素、细菌、病原体将会跨越屏障,进入体循环,引发相应的疾病反应[25]。
表4 各组大鼠血清Zonulin、LPS、TNF-α、IL-6比较(±s)Table 4 Comparison of serum Zonulin, LPS, TNF-α、IL-6 of rats in each group during intervention (±s)

表4 各组大鼠血清Zonulin、LPS、TNF-α、IL-6比较(±s)Table 4 Comparison of serum Zonulin, LPS, TNF-α、IL-6 of rats in each group during intervention (±s)
注:两两比较中,*:与空白组相比,P<0.05;#:与模型组相比,P<0.05。△:与薯蓣粥组相比,P<0.05。
?
本研究中发现,薯蓣粥能够下调T2DM大鼠血清Zonulin、LPS、TNF-α、IL-6的表水平,并且薯蓣粥降低T2DM大鼠血清IL-6表达水平的效果优于二甲双胍组(P<0.05),说明薯蓣粥能够降低T2DM大鼠的肠道通透性,缓解机体炎症水平。薯蓣粥对T2DM大鼠的抗炎作用可能与以下原因有关:a.山药中的有效成分具有缓解机体炎症水平的作用:薯蓣皂苷是山药的有效活性成分,它能够降低T2DM大鼠血清TNF-α、IL-6水平[26-27];b.薯蓣粥通过调节肠道微生物,发挥降低肠道通透性、缓解炎症反应的作用:薯蓣粥能够增加T2DM大鼠的SCFAs含量,上调肠道内AKK菌的相对丰度[10],SCFAs在多项研究中皆证明它具备调节肠道免疫功能,抑制炎症反应,从而降低肠道通透性,减低循环内毒素,缓解机体炎症反应[28-29];AKK菌能够改善高脂诱导的肥胖大鼠肠道屏障功能受损的情况,减轻代谢性内毒素血症,从而减轻由高脂饮食诱导的全身炎症反应[30]。
2.3 各组大鼠FINS、HOMA-IR比较
与空白组相比,模型组大鼠FINS、HOMA-IR升高(P<0.05);与模型组相比,薯蓣粥组的FINS、HOMA-IR降低(P<0.01);薯蓣粥组和二甲双胍组相比,没有统计学差异(P>0.05),见表5。

表5 各组大鼠FINS、HOMA-IR比较Table 5 5Comparison of FINS、HOMA-IR of rats in each group during intervention
本研究中,T2DM模型大鼠的FINS、HOMAIR水平显著升高(P<0.05),经薯蓣粥干预后,FINS、HOMA-IR显著下降(P<0.01),说明薯蓣粥能够有效降低T2DM大鼠的胰岛素分泌水平,缓解胰岛素抵抗。有研究表明,炎症因子能够参与胰岛素信号通路并干扰其信号传导,造成胰岛素抵抗[31-32]:TNF-α、IL-6都是促炎细胞因子,浓度升高时将加速破坏胰岛细胞,同时还会抑制胰岛素受体底物正常的酪氨酸磷酸化,减少胰岛素受体与胰岛素受体底物的结合阻碍胰岛素信号传导,导致胰岛素抵抗[32];本研究中,薯蓣粥可能通过以下渠道下调T2DM大鼠体内的炎症水平,缓解IR:a.增加益生菌:薯蓣粥在前期研究基础中被证实能够增加T2DM患者的肠道内双歧杆菌含量[9],有研究显示,双歧杆菌是益生菌,向T2DM患者补充双歧杆菌、乳杆菌能够下调患者血液中的LPS、TNF-α、IL-6的含量,降低胰岛素和胰岛素抵抗指数,缓解胰岛素抵抗[33];b.增加SCFAs:课题组前期研究已经发现薯蓣粥能够通过改善T2DM大鼠肠道菌群,增加SCFAs,进而降低IR水平[10]。
2.4 各组大鼠FBG水平比较
干预过程中,模型组大鼠空腹血糖始终高于11.1 mmol/L,与空白组相比有统计学意义(P<0.01)。干预的第4周、第5周和干预后,模型组大鼠的FBG明显低于薯蓣粥组和二甲双胍组,差异具有统计学意义(P<0.01);在干预期间直至干预结束,薯蓣粥组、二甲双胍组的FBG相比,没有统计学差异(P>0.05,见表6)。重复测量方差分析显示,各组大鼠FBG变化存在时间效应(F=2.818,P=0.022)、分组效应(F=41.269,P=0.000),即不同的干预方法和干预时间将影响T2DM大鼠的FBG。
表6 各组大鼠干预期间FBG比较(±s,mmol/L)Table 6 Comparison of FBG of rats in each group during intervention (±s, mmol/L)

表6 各组大鼠干预期间FBG比较(±s,mmol/L)Table 6 Comparison of FBG of rats in each group during intervention (±s, mmol/L)
?
本研究发现,T2DM模型大鼠FBG明显升高,经薯蓣粥干预后出现显著下降(P<0.01),薯蓣粥和二甲双胍的降糖效果没有显著差异(P>0.05);说明T2DM大鼠血糖升高,经薯蓣粥灌胃后得到明显改善。薯蓣粥仅由一味生怀山药构成,山药及其有效成分具有降糖作用:山药多糖能够改善高脂饮食配合STZ诱导的T2DM大鼠的糖脂代谢,降低血糖水平[34];薯蓣皂苷能减轻糖尿病肾病大鼠的肾损伤,减低血糖水平[35]。IR是T2DM的典型标志,机体对胰岛素的利用、清除能力下降将导致血糖升高,而持续的高胰岛素、高血糖水平会进一步加重IR,缓解IR水平将有助于降低血糖水平,改善T2DM疾病预后[36]。综上所述,可以得出:薯蓣粥能够通过调节T2DM大鼠SCFAs的含量,降低肠道炎症,维护肠道屏障功能,降低肠道通透性,进而减轻全身炎症反应,达到缓解IR,降低血糖的效果。
3 结论
本研究制造了T2DM大鼠模型,并进行为期6周的灌胃实验,最终发现:薯蓣粥能够下调T2DM大鼠结肠TNF-α、IL-6的表达水平,缓解肠道炎症水平,促进结肠紧密连接蛋白Occludin、ZO-1的表达水平提高,减轻肠道损伤,维护肠道屏障功能,降低肠道通透性,进而下调血清中Zonulin、LPS、TNF-α、IL-6的表达水平,降低血清空腹胰岛素含量、胰岛素抵抗指数、空腹血糖。即薯蓣粥能够通过减轻T2DM大鼠肠道炎症水平,促进肠道通透性下降,进而下调全身炎症水平,缓解胰岛素抵抗,改善血糖。

