虾青素调控ROS介导的自噬延长秀丽隐杆线虫寿命作用
付 敏,张旭光,杨 柳,张绪梅,刘 欢,
(1.天津医科大学公共卫生学院,天津 300070;2.汤臣倍健股份有限公司,广东广州 510663)
衰老是一种自然的、不可避免的生命过程,以细胞衰老为基础,机体各组织器官、生理功能随年龄增长发生不可逆的退行性改变[1]。伴随衰老进程,自由基不断积累对细胞和组织造成氧化损伤[2],这也被许多研究证明是衰老的主要因素之一[3]。活性氧(ROS)属于自由基的一种,有研究发现ROS在信号转导,基因调节和氧化还原调节等生理方面至关重要,完全将其清除是有害的,保持一种适度的低剂量水平可促进自噬的形成[4]。自噬是一种分解代谢过程,通过吞噬细胞内受损的细胞器,改善细胞微循环,从而发挥其抗衰老作用[5]。自噬活性会随着年龄的增长而逐渐减弱[6],自噬缺乏会导致细胞中突变蛋白和错误折叠蛋白的积累,这是神经退行性疾病和其他衰老相关疾病出现和发展的基础[5]。
虾青素(astaxanthin,AST)属于类胡萝卜素,是一种超级抗氧化剂和自由基清除剂,AST具有共扼双键和α-羟基酮,使其容易捕获并中和自由基,淬灭单线态氧,清除自由基,在许多生物体中扮演强抗氧化剂的角色[7-8]。目前,有关AST延缓衰老的研究备受关注,Yazaki等[9]和Liu等[10]发现,AST可通过调节线虫IIS信号通路相关基因和氧化还原酶系统,维持细胞内ROS的最佳平衡,从而达到延缓衰老的作用。AST在心脏、肾脏、肝脏和肺中均能调控自噬从而调控细胞损伤[11]。本团队前期的研究也发现AST通过上调IIS通路的daf-16和TOR通路的hlh-30激活自噬从而延长线虫寿命[12]。而适宜水平的ROS能够调控自噬[13],但在AST延长寿命的效应中ROS和自噬是否存在相互作用还需进一步的研究。
秀丽隐杆线虫(Caenorhabditis elegans)简称线虫,是一种多细胞真核生物,个体结构简单、寿命较短、遗传背景清楚、繁殖速度快且易培养,在基因及信号通路上和人类比较保守,与人类有60%~80%的基因相似,是研究衰老的经典模型生物[14]。因此,本研究选取了线虫作为研究对象探讨AST延缓衰老的作用及其分子机制,以期为AST作为抗衰老药物或保健品开发提供理论依据。
1 材料与方法
1.1 材料与仪器
野生型线虫Bristol N2(wild type,WT)、线虫DA2123、GFP::LGG-1(adIs2122)、大肠杆菌Escherichia coliOP50(E.coliOP50) 美国明尼苏达大学的线虫中心(Caenorhabditis Genetics Center,CGC);谷草转苷酶(AST) 北京索莱宝科技有限公司;二甲基亚砜(DMSO)、胡桃醌 美国Sigma公司;五氟尿嘧啶(FUDR) 天津市风船化学试剂科技有限公司;兔抗GFP多克隆抗体 美国Abcam;山羊抗鼠二抗中国博奥森生物技术有限公司。
生物培养箱 美国THERMO FISHER公司;SZX16体式显微镜 日本OLYMPUS公司;超净工作台(Esco Airstream) 新加坡ESCO公司;倒置荧光显微镜(IX81) 日本OLYMPUS公司;震荡培养箱 上海智诚分析仪器制造有限公司。
1.2 实验方法
1.2.1 秀丽隐杆线虫同期化 使用M9缓冲液将体内含有大量卵的成虫从NGM培养基上冲洗至离心管中。加入1 mL的M9缓冲液和1 mL的线虫裂解液(1 g NaOH,加入5 mL的NaClO2,95 mL超纯水),剧烈摇晃的同时在显微镜下实时观察,当看到虫体裂解而虫卵保存完好时停止振荡,1000 r/min离心2 min,除去上清,重复两次,即可得到虫卵。然后用M9缓冲液冲洗三次去除裂解液。虫卵在M9缓冲液中20 ℃恒温培养12 h。虫卵孵化以后,由于没有食物,幼虫发育将停滞在L1期。然后将幼虫加入NGM培养基中继续培养,待其长至L4期方可用于后续实验。
1.2.2 实验分组及干预方法 根据AST的浓度分为对照组(0 μmol/L)和AST干预组(120 μmol/L)。AST用DMSO溶液溶解配制成120 mmol/L的贮存液,细菌过滤器过滤除菌。将AST贮存液加入到含FuDR(终浓度为40 μmol/L,该浓度能够抑制线虫繁殖且不影响线虫生长发育和寿命[15])的NGM培养基中,使其终浓度为120 μmol/L。对照组只加入溶解相应浓度AST所需的等体积的DMSO,应确保所有NGM中DMSO的终浓度均要小于0.2%(v/v)[16]。为了防止E.coliOP50代谢AST改变其生物化学性质,本研究均使用高温灭活的E.coliOP50菌液涂至NGM表面,且E.coliOP50菌液中也需要使AST终浓度为0或120 μmol/L。
1.2.3 线虫寿命测定 转移50条同期化的L4期线虫到NGM培养基中,在20 °C恒温恒湿培养箱中培养,每2 d统计一次线虫的死亡、存活和剔除的数目(为了保证线虫食物充足,需要2 d更换一次NGM培养基)。线虫死亡判断标准:无移动及吞咽动作,轻触后仍无任何反应。剔除标准:逃离至平皿壁或盖上而干死;虫卵在体内孵化而成袋样虫;钻入琼脂中;生存期定义为:线虫从L4幼虫期(Age=0)至其被计数为死亡的时间,重复三次。
1.2.4 RNA提取和qRT-PCR 在AST干预WT线虫第6 d,用M9缓冲液收集约1000条线虫。采用Trizol法提取总RNA,UV吸光度(260/280比值)检查RNA纯度。随后采用SPARK script II RT Kit(思科捷,中国)将RNA逆转录为cDNA。qPCR检测相关基因的mRNA表达,用于qPCR的引物序列见表1。

表1 自噬相关基因mRNA表达测定用引物Table 1 Primers for the determination of autophagy-related gene mRNA expression
采用20 μL qPCR Master Mix(Promega)进行RT-PCR反应,每个样品3个重复。扩增反应在Roche公司的Lightcycler480 Ⅱ荧光定量PCR仪中完成。扩增条件为:95 ℃预变性5 min;95 ℃、10 s变性,60 ℃、30 s退火/延伸,共40个循环;溶解曲线:90 ℃5 s,60 ℃ 31 s。扩增结束后得到Ct值,采用Folds=2-ΔΔCt法计算相对基因表达量。
1.2.5 活性氧自由基ROS测定 ROS 测量根据Schiavi等[17]方法进行。在AST干预WT线虫第6 d,将线虫转移至装有1 ml DCFH-DA荧光探针(100 μmol/L,溶于M9溶液中)的EP管中,20 ℃孵育30 min。随后将线虫转移至滴加NaN3溶液的琼脂糖垫上,用倒置荧光显微镜拍摄荧光图片(激发波长485 nm,发射波长530 nm),用Image J软件测量荧光强度值。每组随机挑选30条线虫,重复3次。
1.2.6 Western Blot 在AST干预DA2123线虫的第6 d用M9缓冲液收集虫体(每组约1000条线虫)。加入裂解液后使用超声仪匀浆提取蛋白,通过BCA蛋白检测试剂盒(Beyotime)测定蛋白浓度。通过SDS-PAGE分离等量蛋白,并转移到PVDF膜,5% BSA室温封闭1 h。再加入GFP抗体(1:1000;Abcam)和β-actin抗体(1:1000;CST)4℃封闭过夜。TBST清洗后加相应二抗室温孵育1 h,TBST清洗后加化学发光显色底物试剂显色,并使用ChemiDocTM XRS+成像系统(Bio-Rad,Hercules,CA)进行观察,Image J 2.0软件进行定量分析。
1.2.7 胡桃醌氧化应激实验 AST干预WT线虫至第6 d,将不同组别培养基上的线虫转移到含终浓度为240 μmol/L胡桃醌的NGM培养基中,每组3板,每板50条。每天记录线虫的死亡情况,死亡判定标准同寿命测定实验相同,直至线虫全部死亡。实验重复3次。
1.3 数据处理
采用Kaplan-Meier生存分析绘制生存曲线,采用Log-rank分析进行显著性差异检验。两组间采用t检验进行统计学分析,三组或多组之间的比较采用单因素方差分析(ANOVA),采用SNK-q检验进行各组间的两两比较。平均寿命表示为Mean±SEM,其他数据表示为Mean±SD,P<0.05为差异有统计学意义。数据录入使用Excel,所有统计分析均采用SPSS 20.0软件,使用Prism 7绘图。
2 结果与分析
2.1 AST对WT线虫寿命的影响
AST干预后WT线虫的寿命变化结果见图1与表2。与对照组0 μmol/L AST相比,AST干预后线虫的生存曲线右移(图1),其平均寿命显著(P<0.05)延长(表2),表明AST干预能够延长WT线虫的寿命。
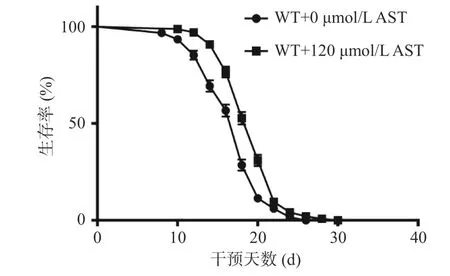
图1 AST干预对WT线虫寿命的影响Fig.1 Effect of AST intervention on lifespan of WT
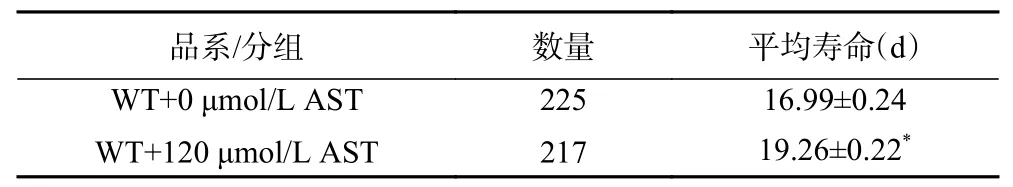
表2 各组线虫寿命的统计分析Table 2 Statistical analysis of nematode longevity in each group
2.2 AST对WT线虫抗氧化和自噬相关基因表达的影响
为了探讨AST延长线虫寿命的效应是否与抗氧化和上调自噬有关,在AST干预的第6 d采用qRT-PCR检测WT线虫抗氧化相关基因sod-3和ctl-1和自噬相关基因bec-1和lgg-1的mRNA表达水平。结果显示,与对照组相比,AST干预组sod-3 mRNA、ctl-1 mRNA、bec-1 mRNA和lgg-1 mRNA水平显著(P<0.05)升高(图2)。结果表明,AST可能通过上调sod-3和ctl-1的表达提高线虫的抗氧化能力,上调bec-1和lgg-1的表达提高线虫体内的自噬水平,从而达到延长寿命的作用。
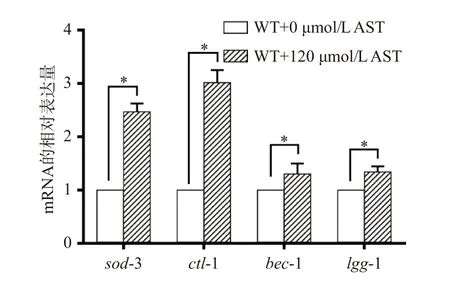
图2 AST对抗氧化和自噬相关基因表达量的影响Fig.2 Effects of AST on the expression levels of genes related to oxidation and autophagy
2.3 AST对WT线虫体内的ROS的影响
ROS具有强氧化性,过多的ROS堆积在细胞中会对DNA、脂质、蛋白质等造成损伤,是引起衰老的重要因素之一[18]。通过检测AST对ROS的影响从而进一步评估其抗衰老的效果。在AST干预的第6 d,荧光探针检测线虫体内的ROS水平。如图3所示,与对照组相比,AST干预组线虫体内的ROS荧光强度显著降低(P<0.05)。实验结果说明,AST通过清除线虫体内过多的ROS,改善氧化损伤状态,从而延长线虫寿命。
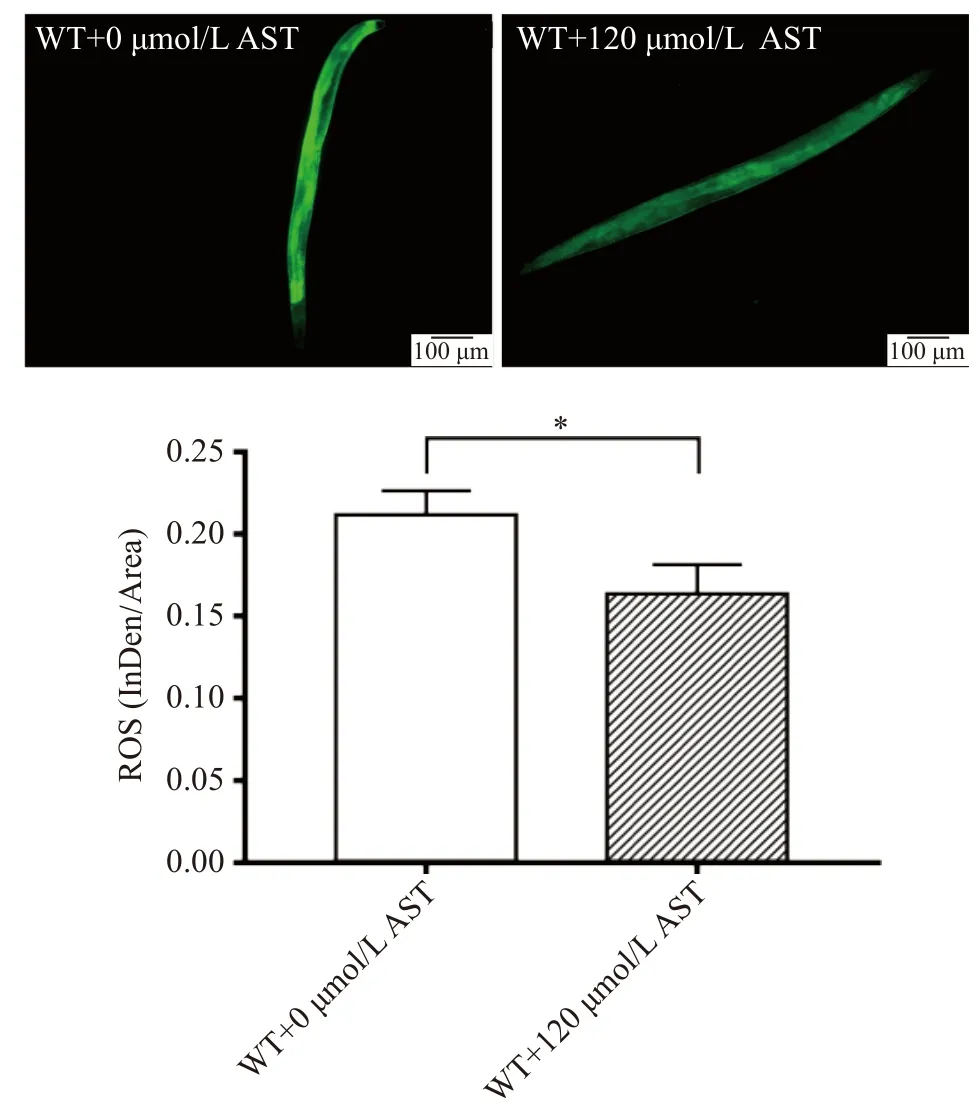
图3 AST对WT线虫体内ROS水平的影响Fig.3 Effects of AST on ROS levels in WT nematodes
2.4 AST对DA2123线虫自噬基因lgg-1的影响
AST在心脏、肾脏、肝脏和肺中均能调控自噬从而调控细胞损伤[11]。DA2123线虫品系的自噬基因lgg-1标记有绿色荧光蛋白GFP,通过检测GFP的表达量即可反映线虫的自噬水平。在AST干预的第6 d,通过Western Blot检测DA2123线虫品系中GFP::LGG-1荧光蛋白的表达量。结果如图4,与对照组相比,AST干预组GFP::LGG-1表达显著上升(P<0.05),该结果与PCR结果一致,验证了AST干预能够上调线虫的自噬水平。

图4 AST干预对DA2123线虫自噬蛋白表达的影响Fig.4 Effect of AST intervention on the expression of autophagy protein in nematode
2.5 氧化应激条件下AST对WT线虫自噬水平的影响
研究表明,氧化应激产生的ROS在适宜的水平时可激活自噬[2]。胡桃醌可以在机体内氧化形成半醌自由基,半醌自由基拥有极强的氧化能力,可以迅速将氧分子氧化为超阴离子自由基,再生为胡桃醌,如此往复循环,形成体内氧化应激环境,导致线虫体内ROS增加[19]。本研究采用胡桃醌诱导线虫的氧化应激状态。在干预的第6 d采用qRT-PCR检测WT线虫自噬相关基因bec-1和lgg-1的mRNA表达量。结果如图5所示,与WT+0 μmol/L AST干预组相比,WT+240 μmol/L胡桃醌+0 μmol/L AST干预组bec-1和lgg-1的mRNA表达量均显著降低(P<0.05),WT+240 μmol/L胡桃醌+120 μmol/L AST组bec-1和lgg-1的mRNA表达量均显著升高(P<0.05)。由该结果可以推测,胡桃醌导致线虫体内大量的ROS堆积,大量的ROS抑制线虫自噬。而AST干预能够缓解线虫氧化应激状态(图5),降低ROS水平,适宜水平的ROS激活了线虫自噬。

图5 ROS对自噬相关基因表达量的影响Fig.5 Effect of ROS on the expression of autophagy-related genes
2.6 氧化应激条件下AST对WT线虫线虫寿命的影响
本研究进一步探讨了在氧化应激环境下AST对线虫寿命的影响,结果显示(图6和表3),与WT+0 μmol/L AST组相比,加入240 μmol/L胡桃醌后WT线虫的寿命缩短,差异具有统计学意义(P<0.05),在氧化应激的条件下加入120 μmol/L AST后,线虫的寿命有所延长,差异具有统计学意义(P<0.05)。表明AST对胡桃醌导致的氧化损伤具有保护作用。

图6 氧化应激环境下AST对WT线虫寿命的影响Fig.6 Effect of AST on the lifespan of WT nematodes under oxidative stress

表3 各组线虫寿命的统计分析Table 3 Statistical analysis of nematode longevity in each group
3 讨论与结论
根据衰老的自由基理论,衰老的原因是由于细胞呼吸过程中产生过量的ROS堆积在细胞内,导致机体处于氧化应激状态[20]。目前关于AST的抗衰老作用多关注于其抗氧化作用[9-10,21-25],AST通过调节IIS信号通路相关基因维持细胞内ROS的最佳平衡,从而达到延缓衰老的作用。在本研究的结果也证实了表明AST通过上调抗氧化基因sod-3和ctl-1的表达水平,激活体内抗氧化酶,以抵御机体的氧化损伤。
本研究进一步探讨了ROS与自噬在AST抗衰老作用中的相互关系。ROS在信号转导、基因调节和氧化还原调节等生理方面至关重要,例如,氧化应激状态产生的ROS能够激活自噬[4,26]。反过来,自噬可能通过吞噬和降解氧化物质来减少氧化损伤响[26-27]。许多研究都表明了适当的增强自噬水平可以延缓衰老[28-30]。在线虫中与自噬相关的基因为lgg-1和bec-1。Lgg-1是酵母自噬相关基因8的同源基因(atg-8),在哺乳动物中的同源基因为LC3,位于自噬前体和自噬体的膜表面,参与自噬体的形成,是自噬的重要标志[31]。Bec-1是酵母自噬相关基因(atg-6)的同源基因,在哺乳动物中的同源基因为beclin-1,标志着自噬的开始[32]。结果2.5表明,采用240 μmol/L胡桃醌诱导线虫氧化应激时,自噬基因bec-1和lgg-1相对表达量显著减少(P<0.05),当加入具有强抗氧化作用的AST后,自噬基因bec-1和lgg-1相对表达量显著增加(P<0.05,图5)。因此,本研究推测强抗氧化剂AST能使线虫体内的ROS维持适宜的水平,进而诱导自噬水平上升,达到其延缓线虫衰老和延长寿命的作用。相反,上调的自噬通过吞噬和降解氧化物质来减少氧化损伤,清除细胞内堆积的ROS。但是本研究没有进一步探讨自噬水平的改变是否会影响ROS,后续有待进一步探讨AST抗衰老效应中ROS与自噬的相互作用。
本研究以秀丽隐杆线虫为模型,表明AST通过清除线虫体内过多的ROS堆积,上调其自噬水平,从而延长线虫的寿命,且AST可能通过调节线虫体内ROS水平进而调控自噬,研究为抗衰老保健品的开发奠定基础。

