参附注射液对脓毒症大鼠肺损伤的保护作用*
刘子璇 刘文丽 郝 浩 孔 立 傅一鑫 田新诚 李 肖 刘慧宇
(1.山东中医药大学,山东 济南 250355;2.山东中医药大学附属医院,山东 济南 250355)
目前,脓毒症发病率、病死率居高不下,临床救治十分困难,是当今重症医学所面临的难题[1]。脓毒症最新定义为宿主对感染引起失控反应导致危及生命的器官功能障碍综合征,具有30%~70%的病死率,严重威胁人类生命健康[2]。脓毒症休克因细菌细胞壁上的脂多糖(LPS)导致,根据流行病学调查,肺为脓毒症最早累及的器官,约半数脓毒症休克患者伴随急性肺损伤(ALI)或者急性呼吸窘迫综合征(ARDS)[3],其特征是肺部炎症、肺水肿、低顺应性和由于肺血管通透性增加引起的毛细血管渗漏。通常有呼吸窘迫、呼吸衰竭、低氧血症的表现,临床上通过机械通气纠正低氧血症、液体管理控制炎症以治疗ALI,但部分患者病情仍有进展。研究发现,参附注射液治疗脓毒症有较好疗效[4]。如何应用中西医结合方法治疗脓毒症相关肺损伤是目前我国医学研究重要课题之一。有学者称参附注射液可通过减少肺氧自由基产生,减轻脓毒症ALI[5]。我们先前的研究表明参附注射液可降低肺血管通透性,这可能与抑制细胞内皮的多糖包被降解有关,但分子机制还有待探究[6]。
经过先前预实验和参附注射液的动物研究表明10 mg/kg的参附注射液可抑制LPS诱导的肺部炎症及损伤[7]。本研究通过建立脓毒症大鼠模型,通过参附注射液对脓毒症大鼠的干预,研究对脓毒症大鼠肺损伤的保护作用,探索其对内毒素所致ALI的保护机制,为参附注射液治疗脓毒症的临床应用提供理论依据,并尝试寻找中西医结合治疗脓毒症的新途径。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级SD大鼠30只,6~7周龄,体质量200~250 g,雄性,由济南朋悦实验动物繁育有限公司提供,动物许可证号:SCXK(鲁)20170007。经检验检疫合格。动物房光照时间12 h,温度20~24℃,湿度60%。饲养地点为山东中医药大学附属医院实验中心,自由取食。实验动物的饲养及实验方案经山东中医药大学实验动物伦理委员会批准,实验操作和取材均遵循《关于善待实验动物的指导性意见》《实验动物管理条例》和《实验动物许可管理办法》规定进行。
1.2 试药与仪器 参附注射液,华润三九(雅安)药业有限公司,批号:国药准字Z5120664。脂多糖,美国Sigma公司,批号065M8209V。10%水合氯醛溶液,山东中医药大学附属医院实验中心提供;大鼠肿瘤坏死因子-α(TNF-α)ELISA kit、大鼠基质金属蛋白酶-1(MMP-1)ELISA kit、大鼠 syndecan-1 ELISA kit,USCN life公司;大鼠硫酸类肝素ELISA kit,武汉科晶科技有限公司;硫酸软骨素ELISA kit,武汉云克隆科技股份有限公司。BP310S电子天平,德国Sartorius公司;Cascadal超纯水系统,美国PALL公司;ST8型低速自动平衡离心机,美国Thermo Scientific公司;5424R型高速冷冻离心机,德国Eppendorf公司;XW-80A旋涡混合仪,海门其林贝尔仪器有限公司;KG19V21电冰箱,德国西门子公司;微量移液器,德国Thermo Scientific公司;-80℃超低温冰箱,日本SANYO公司;全波长酶标仪,德国Thermo Scientific公司;DK-8D型电热恒温水浴锅,上海比郎仪器有限公司;TP1020自动脱水机,德国LEICA公司;EG1150H石蜡包埋机,德国LEICA公司;RM2016轮旋式切片机,德国LEICA公司;PHY-Ⅲ全自动病理组织烘片仪,常州中威电子仪器有限公司;400-S-Ⅱ电热恒温干燥箱,上海跃进医疗仪器厂;全自动血气分析机,美国NOVA-K型。
1.3 造模与分组 30只健康SD大鼠按随机数字表法分为空白对照组、模型组、参附组3组,每组10只。采用单次小剂量输注脂多糖的方法建立脓毒症模型[8]。模型组、参附组分别尾静脉注射0.1% LPS溶液10 mL/kg(即10 mg/kg),空白对照组注射等体积0.9%氯化钠注射液。模型组和参附组注射LPS后逐渐出现行动迟缓、嗜睡、呼吸急促和颤抖。空白对照组与实验前无明显差别。建模后参附组立即尾静脉注射参附注射液10 mL/kg(根据临床用药剂量的5倍换算而得),空白对照组、模型组分别尾静脉注射0.9%氯化钠注射液10 mL/kg。造模后观察6 h,如有大鼠死亡则记录死亡时间,存活大鼠取标本进行检测。
1.4 标本采集与检测 各组大鼠均于造模6 h后腹腔注射10%水合氯醛溶液3 mL/kg,充分麻醉后固定大鼠,腹面向上,常规消毒胸、腹部皮肤,自阴囊上1cm至膈肌顶部,应用组织剪逐层剪开皮肤、腹壁肌肉层,应用无菌棉棒小心游离内脏组织,充分暴露腹主动脉,钳夹双侧髂总动脉分叉处,于该处近心端应用5号针头抽血至无法抽出并应用生化管暂存。1)经腹主动脉采血处死后,立即剪开大鼠膈肌、胸骨,充分暴露心肺,取左肺下叶、右肺下叶各1块,左下肺行肺组织病理检测,右下肺记录肺湿/干重比(W/D)。2)血气分析:腹主动脉取血0.5 mL,用于测定血气分析。记录pH、PaO2和乳酸(Lac)。3)肺组织病理检测:取左下肺用10%甲醛固定,常规脱水、石蜡包埋、制成4 μm厚的切片、HE染色,光镜下观察肺组织结构,每组随机观察3只大鼠的切片,每张切片随机选出5个高倍视野,采取双盲法进行肺损伤的轻重程度评分[9]。正常或极轻度损伤:0分;轻度损伤(<25%):1分;中度损伤(25%~50%):2分;重度损伤(50%~75%):3分;严重损伤(>75%):4分;将4项指标评分相加作为总分,分值越高,说明肺组织损伤越严重,见表1。4)血清TNF-α、MMP-1、Syndecan-1、硫酸乙酰肝素(HS)、硫酸软骨素(CS)检测:取各组大鼠腹主动脉血4 mL静置1 h待自然凝固后,3 000 r/min离心15 min,取上层血清,采用ELISA 法检测血清TNF-α、MMP-1、Syndecan-1、HS、CS水平。

表1 肺组织损伤评分表(分)
1.5 统计学处理 应用SPSS26.0统计软件。计量资料以()表示,符合方差齐性的计量资料,组间比较采用单因素方差分析;不符合方差齐性的计量资料,组间比较采用Kruskal-Wallis检验,等级资料组间比较用Kruskal-Wallis检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠pH、PaO2和Lac水平比较 见表2。模型组、参附组大鼠较空白对照组pH、PaO2显著降低、Lac显著升高(P<0.05或P<0.01),而参附组大鼠较模型组pH、PaO2有明显上升、Lac明显下降(P<0.05或P<0.01)。各组大鼠pH、PaO2水平为:空白对照组>参附组>模型组。Lac水平为:模型组>参附组>空白对照组。
表2 各组大鼠pH、PaO2和Lac水平比较(±s)
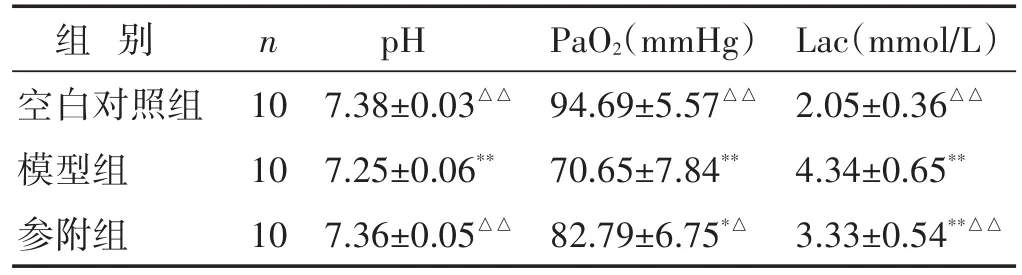
表2 各组大鼠pH、PaO2和Lac水平比较(±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。1 mmHg≈0.133 kPa。
组别空白对照组模型组参附组n 10 10 10 pH 7.38±0.03△△7.25±0.06**7.36±0.05△△PaO2(mmHg)94.69±5.57△△70.65±7.84**82.79±6.75*△Lac(mmol/L)2.05±0.36△△4.34±0.65**3.33±0.54**△△
2.2 各组大鼠肺组织湿干重比的比较 见表3。结果显示,模型组、参附组大鼠较空白对照组W/D显著升高(P<0.05或P<0.01),而参附组显著低于模型组(P<0.01)。各组大鼠肺组织湿干重比水平为:模型组>参附组>空白对照组。
2.3 各组大鼠肺组织病理学改变 空白对照组大鼠肺组织结构完整,肺泡腔清晰,支气管纤毛柱状上皮细胞结构完整,内有少量白细胞浸润,未见水肿、渗出,血管周围无水肿;模型组大鼠肺泡间隔增厚,肺泡破坏,肺泡壁水肿,肺泡内见渗出、充血,肺间质大量中性粒细胞浸润,气管纤毛柱状上皮倒伏、脱落,气管内炎性渗出,血管周围水肿、白细胞浸润,病理学评分显著升高(P<0.01);参附组大鼠肺组织病变性质与模型组相同,肺组织损伤程度较模型组减轻,肺泡结构相对完整,肺间质有轻度或中度水肿,炎性细胞浸润程度也较模型组明显改善,肺损伤程度评分显著降低(P<0.05),3组肺损伤程度评分结果比较见表3,差异有显著性(P<0.05或P<0.01)。
表3 各组大鼠肺组织湿干重比及肺操作损伤程度评分比较(±s)

表3 各组大鼠肺组织湿干重比及肺操作损伤程度评分比较(±s)
组 别n 肺W/D 肺损伤程度评分(分)空白对照组模型组参附组10 10 10 4.07±0.20△△5.15±0.19**4.55±0.13**△△0.90±0.74△△10.60±2.01**6.30±1.34*△
2.4 各组大鼠血清TNF-α、MMP-1、Syndecan-1、HS、CS水平比较 见表4。结果显示,与空白对照组相比,模型组、参附组大鼠TNF-α、MMP-1、Syndecan-1、HS、CS显著升高(P<0.05或P<0.01),而参附组显著低于模型组(P<0.05或P<0.01)。各组大鼠血清TNF-α、MMP-1、Syndecan-1、HS、CS 水平为:模型组>参附组>空白对照组。
表4 各组大鼠血清TNF-α、MMP-1、Syndecan-1、HS、CS水平比较(ng/mL,±s)
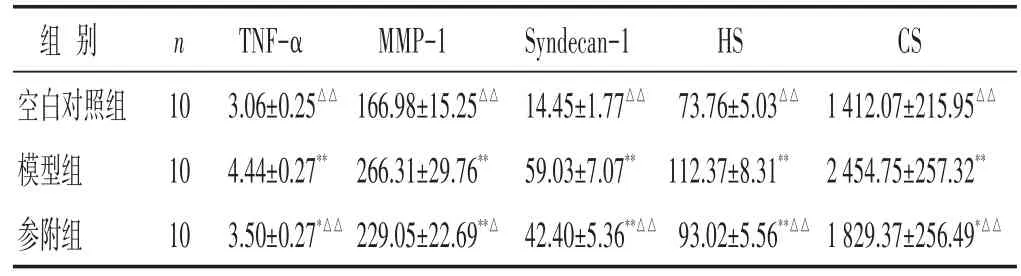
表4 各组大鼠血清TNF-α、MMP-1、Syndecan-1、HS、CS水平比较(ng/mL,±s)
组别空白对照组模型组参附组n 10 10 10 TNF-α 3.06±0.25△△4.44±0.27**3.50±0.27*△△MMP-1 166.98±15.25△△266.31±29.76**229.05±22.69**△Syndecan-1 14.45±1.77△△59.03±7.07**42.40±5.36**△△HS 73.76±5.03△△112.37±8.31**93.02±5.56**△△CS 1 412.07±215.95△△2 454.75±257.32**1 829.37±256.49*△△
3 讨论
脓毒症的发病机制很复杂[10],内皮细胞的活化和功能异常在脓毒症的发生和发展中起着重要作用,炎症反应和抗炎反应失控是其突出表现,高发病率、高死亡率及发病机制复杂是其主要特点,器官损伤可见于肺、肝、肾、心脏和肠中,治疗不及时可发展为ALI、ARDS和多器官功能障碍综合征(MODS)[11]。
脓毒症可归属于中医学伤寒、温病的范畴,《黄帝内经·素问》云“正气存内,邪不可干”“邪之所凑,其气必虚”,其病机为正虚毒损、络脉瘀滞[12]。“温邪上受,首先犯肺”,肺为娇脏,其位最高,正气虚弱,毒邪驱散无力,毒邪内侵使脏真受损;肺朝百脉,在脓毒症传变过程中,肺脏是易受毒邪侵袭之地,亦为毒邪积聚蕴生之所,内外毒邪互结,灼伤肺脏脉络及气阴,肺宣降功能受损,发而致喘。故脓毒症ALI为本虚标实证,其中阳气亏虚是其本,痰浊、水饮、瘀血为其标,核心治法为益气温阳[13]。参附注射液来自传统中医方剂参附汤,由红参、附子组成,主治元气大亏。红参为君药,可大补元气,益气回阳,补阳固脱,附子大辛大热,益火补阳,温通经脉,是为臣药。二药合用可增效减毒,有回阳救逆、益气固脱的作用。既往研究发现其具有抗缺血[14]、抗缺氧[14]、抗休克[15]、清除氧自由基、抗脂质过氧化[16]、减轻肺缺血/再灌注[17]、增强机体非特异性抵抗力、双向调节血压[18]、降低血清炎症因子水平、改善过度炎症反应[19]、减轻血管内皮损伤[20]等作用。一系列临床及实验研究表明参附注射液治疗脓毒症可提高临床治愈率和效率,改善预后和器官功能[21]。参附注射液干预ALI大鼠能够提高细胞免疫功能,改善机体防御机制,减少氧自由基,改善肺组织炎性浸润,减轻肺部出血、水肿及肺不张,并促进肺组织的修复[22]。
LPS可引起大鼠肺脏肿胀、出血、结构破坏、炎性细胞浸润,因此常用于建立脓毒症ALI模型。内皮细胞过度活化可导致血管通透性增加、内皮损伤、白细胞黏附增加、凝血功能障碍,并最终导致微循环功能障碍并促进脓毒症的进展。因此,一些研究人员认为脓毒症主要是微循环疾病[23]。在生理条件下,内皮细胞表面覆盖有多糖包被,可以维持正常的血管通透性。它可以防止白细胞黏附于内皮细胞,防止凝血机制过度活化,减少微血栓形成,并保持内腔畅通。多糖包被主要由糖胺聚糖侧链和核心蛋白组成,最重要的核心糖蛋白是syndecan-1,它对于维持多糖包被的正常结构和功能至关重要。MMP-1是基质金属蛋白酶(MMPs)家族的重要成员,能特异性剪切syndecan-1,从而导致多糖包被降解,进而引发微循环障碍。多项动物研究证明:脓毒症时循环中MMP-1水平显著升高[24-25]。syndecan-1、HS、CS在维持多糖包被结构、血管通透性、信号传导、炎症反应、微生物侵袭和凝血功能方面均发挥重要作用。TNF-α由活化的单核-巨噬细胞产生,参与炎症反应的发生,常用于评估炎症反应程度。
目前认为:多糖包被的破坏是导致脓毒症中毛细血管通透性增加的主要机制[26],而脓毒症局部或全身的炎症反应可以加速破坏多糖包被的结构与功能[27]。在脓毒症中,促炎细胞因子激活导致基质金属蛋白酶过量表达,使多糖包被被降解并且无法执行其正常功能,使血管通透性下降并加重水、蛋白及各种溶质的丢失,造成组织间隙水肿。Schmidt EP等[28]发现脓毒症小鼠通过TNF-α快速诱导肺微血管多糖包被降解,降解将多糖包被成分,例如syndecan-1、HS、CS、硫酸软骨素(HA)释放到血浆中,从而导致血管通透性增强,组织间隙水肿,弥散距离增大,影响肺内气体交换和组织供氧,并可导致肺水肿。
在本研究中,与空白对照组相比,LPS静脉注射可引起大鼠肺泡间隔水肿、肺泡结构破坏、肺出血、炎性细胞浸润、W/D比值增高,血清TNF-α、MMP-1、Syndecan-1、HS、CS水平下降等病理表现;临床表现也出现Lac上升、PaO2进行性下降。与模型组相比,参附组血清TNF-α、MMP-1、Syndecan-1、HS、CS水平下降,反映了参附注射液可减轻脓毒症诱导的炎症反应及内皮多糖包被降解,维持多糖包被的完整性。参附组PaO2升高,表明参附组换气功能得到改善,间接证明了参附组的肺血管通透性降低、肺内渗出减少。参附组的W/D比明显降低,表明参附注射液可改善肺水肿并降低肺毛细血管通透性。实验发现,模型组大鼠ALI病理学形态主要表现为肺泡间隔水肿、肺泡隔毛细血管明显淤血、大量中性粒细胞浸润;模型组大鼠给予参附注射液后,肺泡及肺部充血、水肿及炎症情况相对于模型组明显改善,ALI的病理改变显著减轻,说明参附注射液对脓毒症大鼠肺组织有保护作用,为参附注射液改善脓毒症所致肺损伤提供了依据。
综上所述,参附注射液对改善脓毒性肺损伤有一定作用。其机制可能是:1)通过降低炎症水平,抑制MMP-1的过量表达,减少内皮多糖包被的降解,从而降低肺毛细血管的通透性,改善氧合,保护肺组织并减轻肺部及全身的炎症反应;2)参附注射液通过调节免疫系统,增强机体免疫细胞的功能,抑制炎症反应,减轻器官损伤;3)参附注射液通过加强肝脏解毒代谢功能,而减轻LPS对肺组织的损伤;4)改善微循环,增强对组织对缺氧的耐受,促进氧的与应用。但是,该实验仍然存在几个问题:首先,大鼠脓毒症模型不能完全反映人类脓毒症;其次,本研究评估了参附注射液对脓毒症大鼠的短期效果,但未评估其长期效果。因此还需要进一步长期研究参附注射液对脓毒症肺损伤的保护作用;另外,参附注射液存在个体差异的过敏现象,临床使用应详细询问有无过敏史,并对高敏者做过敏试验。

