HER2阳性乳腺癌患者ER表达状态与高频超声及SWE特征的相关性研究
周宇微,刘景萍,公春丽,王 泱,刘 颖
唐山市人民医院超声科,河北 唐山 063000
乳腺癌是全球女性中发病率最高的癌症[1],逐年增高的确诊率严重威胁患者的身心健康及生命安全。乳腺癌有多种分子亚型,且预后不同,这导致患者生存率不再单单取决于肿瘤病理学分期,分子分型对临床诊疗和预后判断也起着重要的作用[2]。Arciero等[1]研究发现,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性、雌激素受体(estrogen receptor,ER)阴性较HER2阳性、ER阳性的乳腺癌患者更易发生远处转移。因此,本文旨在探讨利用高频超声、剪切波弹性成像(shear wave elastography,SWE)等影像学手段分析HER2阳性乳腺癌患者的影像学特征与ER表达状态的相关性。
1 资料和方法
1.1 一般资料
选择2019年3月—2020年12月在唐山市人民医院乳腺外科住院并经病理学检查证实的HER2阳性患者136例,患者均为女性。将ER阴性的77例患者定义为Ⅰ组,ER阳性的59例患者定义为Ⅱ组。临床表现均为乳房肿块,伴或不伴有疼痛。排除标准:① 未行病理学检查;② 既往有其他恶性肿瘤病史者;③ 既往有内分泌治疗、靶向治疗、放疗史的患者;④ 有乳腺假体或处于妊娠期、哺乳期的患者;⑤ 全身情况差,呼吸运动配合不良者。本研究经医院伦理委员会批准,患者均知情同意并签署知情同意书。
1.2 方法
1.2.1 高频超声检查
采用法国SuperSonic Imagine公司的Aixplorer超声诊断仪。患者取平卧位,通过二维灰阶模式确定病灶位置后,记录肿瘤形态、边界、肿瘤边缘、微钙化、血流分级、肿瘤最大径线,以及是否腋窝淋巴结转移。并通过彩色多普勒血流显像(color Doppler flow imaging,CDFI)检查肿瘤的血流分布特征。CDFI采用Adler半定量法[3],病灶内未探及血流信号为0级;肿瘤内探及1、2处直径小于1 mm的“星点状”血流信号为Ⅰ级;病灶内探及3、4处点状血流,或一贯穿其内的主血管,为Ⅱ级;病灶内探及4条或以上血管为Ⅲ级。同时记录肿瘤的血流阻力指数(resistant index,RI)。
1.2.2 实时SWE技术采集与分析
采用Aixplorer超声诊断仪,线阵探头频率为4~15 MHz。患者取平卧位,在二维超声获取最佳图像后,切换至SWE模式。继续保持探头垂直轻置于皮肤表面,取样框尽可能完全包含整个病灶,量程采用仪器默认的180 kPa。中心频率默认为标准模式,若因肿块内部彩色信号充盈不佳或病灶位置较深导致成像效果不佳,可将中心频率调至穿透模式,以获得最佳充盈状态的彩色信号,或者更换为更低频率的探头。嘱患者屏气以减少呼吸运动对图像的影响,手持探头至弹性图像稳定数秒后冻结,回放图像,取彩色信号充填最佳的图像进行分析。将其一感兴趣区的Q-Box置于病灶最硬的区域(若为不均质病灶,应置放于病灶内部,避开囊性变或钙化区域),将另一感兴趣区Q-Box放置于与病灶深度相近的正常乳腺组织上。分别记录杨氏模量的最大值(Emax)、平均值(Emean)、最小值(Emin),以及标准差(standard deviation,SD)。同一病灶由经过专门SWE病例培训医师至少重复测量3次,取平均值。同时记录乳腺肿物SWE彩色分布模式:硬环征、马蹄征、多彩病灶和中央缺失[4]。
1.2.3 免疫组织化学染色
所有病灶均经超声引导下空芯针穿刺活检。所有病理学标本行免疫组织化学染色。由2名具有8年以上工作经验的病理科医师进行阅片,意见不一致时,由上一级医师会诊,取多数意见后商议判定结果。所有操作均由本院病理科完成。
结果判定参考美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)/美国病理学家协会(College of American Pathologists,CAP)乳腺癌激素受体IHC检测指南[5-6],ER在细胞核上出现棕黄色染色为阳性细胞,阳性细胞数量不足10%为-,10%~25%为+,26%~50%为++,超过50%为+++。HER2在细胞膜或细胞质内呈现棕黄色颗粒为阳性。HER2为0或+判定为阴性,+++判定为阳性,若++则再行荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测确认阳性者入组。
1.3 统计学处理
采用SPSS 21.0软件进行统计学分析,α=0.05为组间比较的检验水准。计量资料以±s表示,分类资料以n(%)表示。符合正态分布计量资料两组间比较,采用独立样本t检验分析。计数资料组间比较,采用χ2检验或者Fisher精确概率检验。多因素相关性分析用二元logistic回归模型分析,自变量为单因素分析过有意义的因素,结果用校正后的优势比(odds ratio,OR)和与之相应的95% CI表示。用受试者工作特征(receiver operating characteristic,ROC)曲线确定指标诊断截点并进行指标评价。
2 结 果
2.1 一般资料及病理学检查结果
两组年龄、肿瘤最大径线、病理学类型、组织分级差异均无统计学意义(P>0.05),但两组腋下淋巴结转移情况明显不同,差异有统计学意义(P<0.05)。Ⅰ组较Ⅱ组更易出现腋窝淋巴结转移(表1~3)。

表1 两组间一般性资料比较 n(%)
2.2 高频超声图像特征
两组形态、边界、内部回声、微钙化、血流分级及边缘特点差异均无统计学意义(P>0.05)。以RI值是否≥0.7为诊断乳腺癌的界值[7],两组差异无统计学意义(P>0.05,表2)。

表2 两组常规超声表现比较 n(%)
2.3 SWE特征
2.3.1 SWE成像模式
Ⅰ组出现中央缺失征30例(39.0%),硬环征31例(40.3%),马蹄征10例(13.0%);多彩病灶6例(7.8%)。Ⅱ组出现中央缺失征26例(44.1%),硬环征25例(42.4%),马蹄征6例(10.2%);多彩病灶2例(3.4%)。两组之间差异均无统计学意义(P>0.05,表3)。
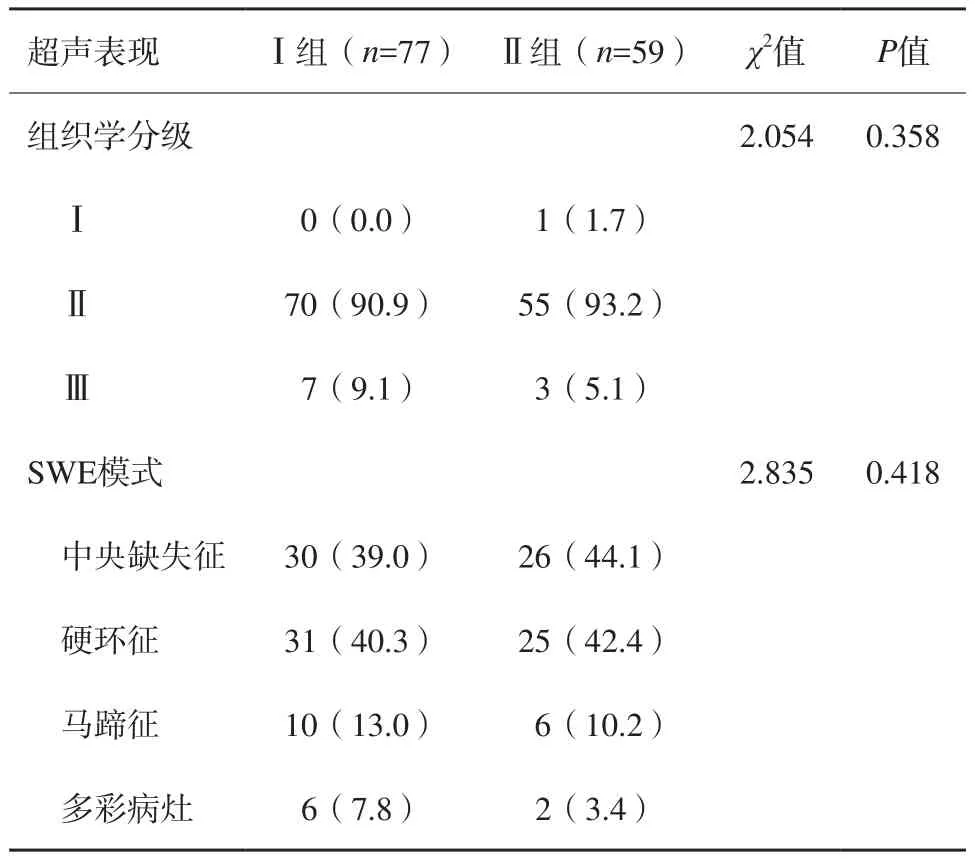
表3 两组超声表现SWE成像模式及病理分级比较 n(%)
2.3.2 杨氏模量参数
Ⅰ组Emax、Emin、Emean与Ⅱ组比较,差异有统计学意义(P<0.05),两组SD值差异无统计学意义(图1、2,表4)。
表4 两组杨氏模量值比较 ±s
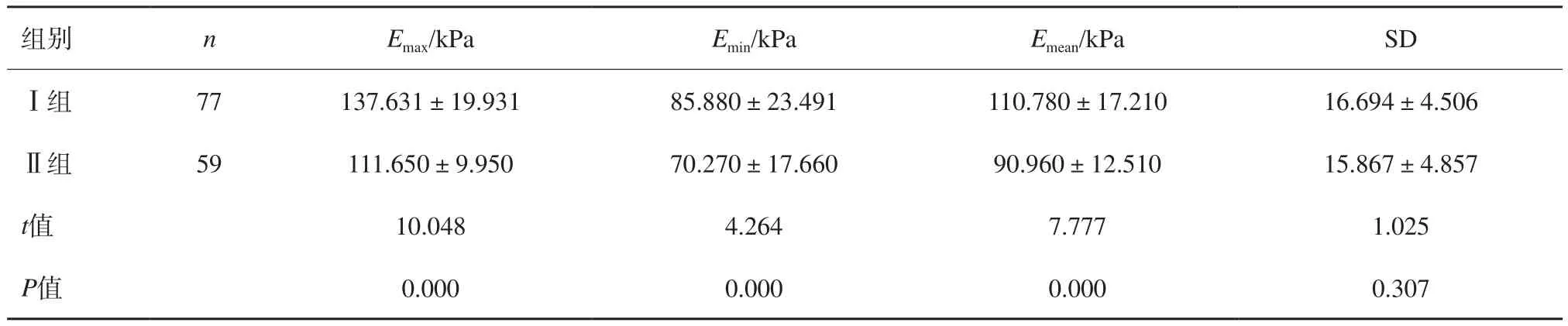
表4 两组杨氏模量值比较 ±s
组别 n Emax/kPa Emin/kPa Emean/kPa SDⅠ组 77 137.631±19.931 85.880±23.491 110.780±17.210 16.694±4.506Ⅱ组 59 111.650±9.950 70.270±17.660 90.960±12.510 15.867±4.857 t值 10.048 4.264 7.777 1.025 P值 0.000 0.000 0.000 0.307
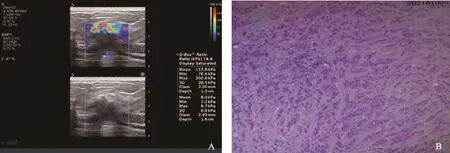
图1 典型病例1(患者,女性,37岁,ER阴性)乳腺肿物超声声像图及病理学表现
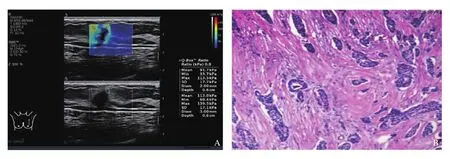
图2 典型病例2(患者,女性,58岁,ER阳性)乳腺肿物超声声像图及病理学表现
2.4 影响因素分析
为了进一步检验单因素有差异的4个观察指标与不同免疫组化类型的相关性,选择二元logistic回归模型,将ER是否阳性作为因变量,将Emax、Emin、Emean、有无淋巴结转移共4个指标作为自变量,建立二元logistic回归模型(表5)。
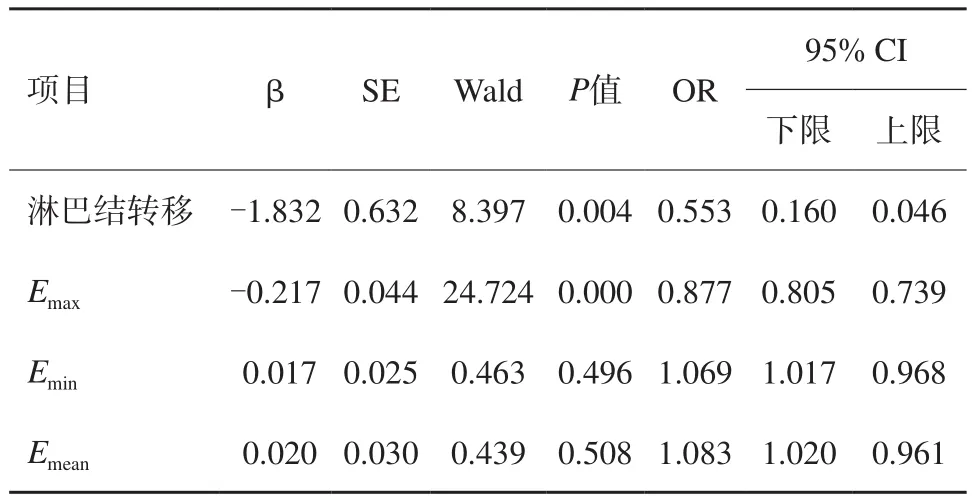
表5 136例不同免疫组化类型的logistic回归分析
二元logistic回归分析结果显示,淋巴结转移、Emax共两个指标与免疫组织化学Ⅱ组之间存在显著相关关系(P<0.05),而且是免疫组化结果的独立影响因素。伴淋巴结转移,Emax越大患者ER阴性概率较高(OR<1),且淋巴结转移患者ER阳性的概率是无淋巴结转移患者的0.553倍(OR=0.553),Emax每增加1个单位,患者为ER阳性的概率降低12.3%(OR=0.877)。而Emin、Emean共2个指标均不是免疫组化分型的独立影响因素(P>0.05)。为了进一步判定淋巴结转移、Emax共2个指标对于免疫组织化学结果的诊断价值,我们选择ROC曲线分析,其结果,淋巴结转移指标曲线下面积为0.602,标准误为0.049,P=0.042,95% CI 0.506~0.698,说明淋巴结转移指标诊断免疫组化分型效果欠佳,对应的诊断灵敏度为59.3%,特异度为61.0%。Emax指标曲线下面积0.910,标准误0.025,P=0.000,95% CI 0.861~0.959,说明Emax指标预测免疫分型较好,对应的诊断灵敏度为96.6%,特异度为79.2%,阈值为124.335 kPa(图3)。
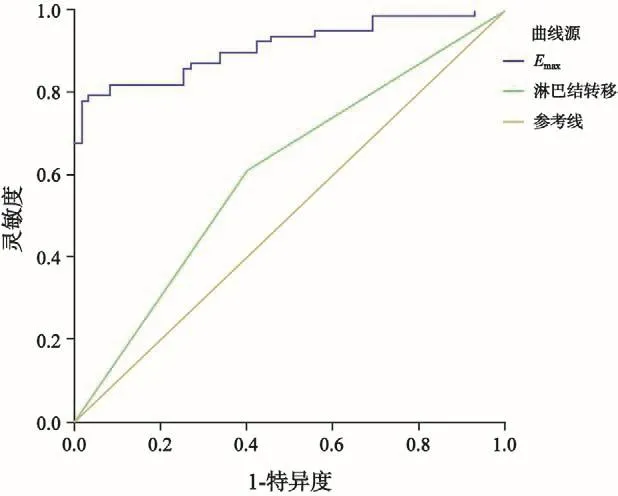
图3 2个入选因素诊断免疫组化分型的ROC曲线
3 讨 论
乳腺癌包括多种不同的分子分型。不同的分子分型,其治疗方案及预后也不尽相同。利用免疫组织化学代替传统基因分析代表着乳腺癌个体化精准治疗理念的重大变更。既往研究[8-9]已证明HER2是乳腺癌的主要致病基因,其高表达会导致乳腺肿瘤具备低分化、高增殖能力,更具侵袭性及转移性。ER的表达情况可以预判乳腺癌内分泌治疗的效果和患者预后。Parsons等[10]研究发现,ER阴性、HER2阳性患者较ER阳性、HER2阳性患者的总体生存率更低,因此,早识别HER2阳性乳腺癌患者的ER表达情况具有一定的临床意义。
乳腺癌内在的生物学行为所导致的病理形态学改变,是影像学不同表现的根本所在,因此,乳腺癌的蛋白分子表达与超声征象存在一定相关性[11-12]。常规超声采用实时扫描技术对乳腺病变进行检测,并评估其形态特征,如形状、回声、大小等,然而,该技术不能评估硬度,由于乳腺癌病变内部和周围存在促纤维组织增生反应,病灶通常比良性病灶质地更坚硬。而剪切波弹性成像使用“马赫锥”原理,无需施压,通过超高速成像技术探测横向剪切波,可以通过实时测量病灶的杨氏模量值定量评估组织的硬度,其组织硬度与杨氏模量值呈正相关,可极大地提高超声诊断的准确度和特异度[13]。
本研究结果还显示,ER阴性、HER2阳性组较ER阳性、HER2阳性组更容易发生腋窝淋巴结的转移,这与Arciero等[1]的研究结果一致。既往研究[14]已证实HER2过度表达与淋巴结转移发生率密切相关,HER2蛋白分子增强细胞有丝分裂,促进肿瘤增殖及分化,增强细胞运动能力,其高表达与乳腺癌进程及转移呈正相关。ER表达阴性者又具有减少非正常细胞凋亡的能力,故ER阴性、HER2阳性组呈“侵袭性”生长,肿瘤内部增生活跃,肿瘤新生血管生成过快,更易发生腋下及远处淋巴结转移。与Ⅰ组相比较,ER为阳性的乳腺癌细胞分化程度较高,恶性程度较低,对于内分泌药物的反应也更为敏感。
另外,在SWE图像特征分析过程中,本研究结果显示ER阴性、HER2阳性组的Emean、Emax均大于ER阳性、HER2阳性组,与裴蓓等[15]报道一致。造成结果差异原因可能为形成乳腺肿瘤的微环境中包含与有肿瘤相关的成纤维细胞,骨髓来源的基质细胞、巨噬细胞、淋巴细胞、NK细胞、以及可溶性因子和细胞外基质的协同作用[16]。而在影响肿瘤硬度的诸多因素中,成纤维细胞介导的细胞外基质硬度是尤为重要的因素,细胞外基质硬度与肿瘤的整体硬度存在正相关。ER阴性、HER2阳性组肿瘤呈浸润性生长,血供丰富,侵袭性强的乳腺癌往往具有更大硬度[17]。在本研究结果中,Emax、Emin、Emean、有无淋巴结转移同时入选logistic回归模型,说明杨氏模量值与淋巴结转移与否是鉴别乳腺癌免疫组化分型的重要指标,尤其是淋巴结转移率与Emax作为量化指标,能够准确、客观地鉴别乳腺肿瘤的免疫组化类型。ROC曲线显示,Emax作为剪切波技术参数,曲线下面积0.910,对应的诊断灵敏度为96.6%,预测免疫分型较好,与免疫分型有较好的拟合度。
综上所述,当HER2表达阳性时,高频超声与新技术SWE相结合,可以预测ER的不同表达状态,可提高超声科医生对乳腺恶性病变的整体诊断能力,为临床无创预测乳腺癌侵袭性及选择治疗方案提供指导依据。

