大鳞副泥鳅蛋白ACE抑制肽的分离纯化与鉴定
董婧琪 何泽贺 田桂芳 邵娟娟 吴小禾
(1. 河北农业大学理工学院,河北 沧州 061000;2. 河北农业大学食品科技学院,河北 保定 071000;3. 中山火炬职业技术学院,广东 中山 528436)
高血压是脑血管病的重要表现特征之一,也是治疗脑血管病的重要指标[1]。血管紧张素转化酶(ACE)因破坏肾素—血管紧张素系统与激肽释放酶—激肽系统之间的平衡而直接引起机体的高损伤[2],在血压的调控中起到重要作用[3]。降低ACE活性可以有效降低血压,但是现阶段的降压药物大多是合成类的ACE抑制剂,如卡托普利、阿克拉普利和依那普利等抑制剂。而使用合成类降压药后可能出现咳嗽、皮疹和头痛等不良反应,所以目前合成类降血压药物的使用受到限制[4]。此外,已证实从食物中获得的抗高血压肽对高血压病人具有降压效果,而且没有毒副作用[5]。
大鳞副泥鳅(Paramisgurnusdabryanus)为重要的淡水型鱼类之一[6],属高蛋白低脂肪食品。大鳞副泥鳅蛋白有多种生物活性,ACE抑制活性是其主要活性之一。目前ACE抑制肽的制取方法主要是酶法,而单一的酶类通常具有一定的局限性。何泽贺等[7]对于复合酶法提取泥鳅中ACE抑制肽进行了研究,但未进一步进行分离纯化与鉴定的研究。研究拟采用脯氨酸蛋白酶和碱性蛋白酶的复合酶酶解法制取大鳞副泥鳅制备ACE抑制肽,并对其进行进一步的分离纯化与鉴定,旨在为大鳞副泥鳅的ACE抑制肽开发利用提供参考。
1 材料与方法
1.1 材料与试剂
大鳞副泥鳅:单只重量约35~45 g,河北农业大学市场;
碱性蛋白酶:1万U/g,美国Sigma公司;
脯氨酸蛋白酶:25 U/g,夏盛(北京)生物科技开发有限公司;
血管紧张素转化酶:1 000 U/g,美国Sigma公司;
三羟甲基氨基甲烷(纯度≥99.8%)、三(羟甲基)甲基甘氨酸(纯度≥99.0%):分析纯,美国Sigma公司;
氢氧化钠(纯度≥96.0%)、盐酸(36.0%~38.0%)、氯化钠(纯度≥99.5%):分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
绞肉机:JYL-C020E型,九阳股份有限公司;
冷冻干燥机:Beta1-8 LD plus型,德国Marin Christ公司;
水浴恒温振荡器:SHA-B型,江苏正基仪器有限公司;
冷冻离心机:5418 R型,德国艾本德公司;
涡旋混匀仪:MIX1000型,广东佛衡仪器有限公司;
紫外可见分光光度计:UV752N型,上海元析仪器有限公司;
超滤:80EL005型,密理博(中国)有限公司;
恒流泵:HL-2型,上海青浦沪西仪器厂;
反向高效液相色谱仪:1260型,安捷伦科技有限公司;
质谱仪:Orbitrap Elite型,赛默飞世尔科技公司。
1.3 试验方法
1.3.1 大鳞副泥鳅蛋白酶解液的制备 大鳞副泥鳅清洗后,热烫约30 s去除黏液,经处理后得泥鳅肉糜,-20 ℃冷冻贮藏。将常温解冻的肉糜与磷酸缓冲溶液(pH 7.0,0.1 mol/L)制备成质量分数10%的匀浆[8],并使用均质机均质。然后用碱性蛋白酶(1 000 U/g)与脯氨酸蛋白酶(5 U/g)在40 ℃条件下[9],同步酶解大鳞副泥鳅蛋白3 h,沸水浴10 min,10 000 r/min离心20 min,取上清即得到大鳞副泥鳅的酶解物(PDH)。然后对PDH进行冻干(冷阱温度-55 ℃,抽气速率5 L/s)处理,在干燥器中贮藏备用。
1.3.2 超滤 将冻干的PDH溶解在蒸馏水中,并使用超滤进行分级分离,该系统的截留分子量膜范围为10,5,3,1 kDa。首先使用10 kDa超滤膜对PDH进行超滤,以生成截留液(PDH-Ⅰ)和渗透液。将10 kDa的渗透液在5 kDa的超滤膜上进一步分离,获得5 kDa截留液(PDH-Ⅱ)和渗余液。然后将5 kDa渗透液在3 kDa 超滤膜上分离得到截留液(PDH-Ⅲ)和渗透液,将3 kDa渗透液在1 kDa的超滤膜上分离,获得1 kDa的截留液(PDH-Ⅳ)和渗透液(PDH-Ⅴ)。分别收集所得的PDH-Ⅰ(>10 kDa)、PDH-Ⅱ(10~5 kDa)、PDH-Ⅲ(5~3 kDa)、PDH-Ⅳ(3~1 kDa)和PDH-Ⅴ(<1 kDa)组分并冻干,备用。
1.3.3 葡聚糖凝胶过滤层析 利用Sephadex G-15层析柱(1.6 cm×80 cm)对所获得的PDH-Ⅰ、PDH-Ⅱ、PDH-Ⅲ、PDH-Ⅳ和PDH-Ⅴ组分中ACE抑制活性最高的组分进行纯化。上样液质量浓度为30 mg/mL,以0.5 mL/min流量用蒸馏水洗脱,收集洗脱液(3 mL/管),并利用在280 nm处测量的吸光度进行监测。收集各级分,使用旋转蒸发仪对各级分进行浓缩,并冷冻干燥,备用。
1.3.4 制备型高效液相色谱分离纯化 使用安捷伦XSelect®petide CSHTMC18色谱柱(19 mm×150 mm)进行纯化。A相:体积分数0.1% TFA纯乙腈;B相:体积分数0.1% TFA水溶液。洗脱条件:A,0~10%,持续20 min,上样量800 μL,柱温30 ℃,流量17 mL/min,检测波长280 nm。多次上样并收集不同级分,进行浓缩处理,通过冷冻干燥后保存,并测定其ACE抑制活性。使用与上述相同的条件对活性最高的组分进行第二次RP-HPLC纯化。所得纯化的肽用于质谱分析。
1.3.5 ACE抑制肽一级结构的质谱测定 将1.3.4制得的样品利用Orbitrap Elite质谱仪(Thermo Scientific)进行检测,色谱柱为Thermo Scientific的C18散装材料填充柱(100 μm×2 cm)和C18分离毛细管柱(75 μm×15 cm)。将肽重悬于缓冲液A(体积分数0.1%甲酸的水溶液)中,装到预柱上,用分离柱分离,线性梯度为7%~35%缓冲液B(含有体积分数0.1%甲酸的乙腈),然后进行LC-MS/MS分析。离子化方式:ESI;电压2 200 V;以数据依赖模式进行采集,在FT模式下以120 000的分辨率进行全面MS扫描(m/z300~1 700),然后对15个最丰富的离子进行碰撞诱导解离(CID)MS/MS扫描。自动增益控制(AGC)目标对于Orbitrap扫描为1e6离子,对于MS/MS扫描为5e4离子。动态排除参数:隔离窗口,m/z2,重复计数1,重复持续时间25 s,排除时间25 s。
1.3.6 ACE抑制模式鉴定 分别将0.000,0.025,0.050,0.075 mg/mL 的ACE抑制肽添加到0.5,1.0,2.0 mg/mL的 FAPGG底物的反应混合物中与ACE反应,然后测定ACE的抑制活性。通过Lineweaver-Burk图研究抑制剂存在下的ACE抑制模式,Lineweaver-Burk图基于反应速率(1/V)和底物浓度(1/S)关系的倒数图。
1.3.7 肽得率的测定 按体积比1∶1将5%的三氯乙酸与蛋白酶水解液混匀,6 000 r/min离心10 min,采用考马斯亮蓝法,对上清液中可溶性蛋白含量进行测定,按式(1)计算短肽得率[10]。
(1)
式中:
NSI,TCA——三氯乙酸可溶性氮得率,%;
N1——在5% TCA中的可溶性蛋白质量,mg;
N2——PDH中的可溶性蛋白质量,mg。
1.3.8 ACE抑制率测定 向微孔板的微孔中分别加入10 μL的ACE溶液和10 μL蛋白水解液,再添加150 μL底物(1.0 mmol/L FAPGG与50 mmol/L的Tris-HCl混匀,NaCl浓度为0.3 mol/L),然后立刻将微孔板放入预热到37 ℃的酶标仪中,在340 nm下测定20次吸光值,每次间隔1 min。作为空白对照,以吸光值(A340 nm)为横坐标,时间为纵坐标作曲线,计算斜率,通常取10~20 min的斜率来计算。按式(2)计算ACE抑制率。
(2)
式中:
ACE,I——ACE抑制率,%;
ΔAI——添加抑制剂时的斜率;
ΔAB——空白对照的斜率。
IC50为抑制50% ACE活性时所需酶解样品的质量浓度。IC50定义为ACE抑制率达50%时的多肽质量浓度(mg/mL),用SPSS 13.0统计软件的概率单位法(probit)计算。
1.4 数据处理与分析
采用Means±SD表示试验数据,通过SPSS 13.0统计分析软件做方差分析(ANOVA),并进行Duncan的新的多范围测试,以确定其显著差异。
2 结果与分析
2.1 PDH的超滤分离
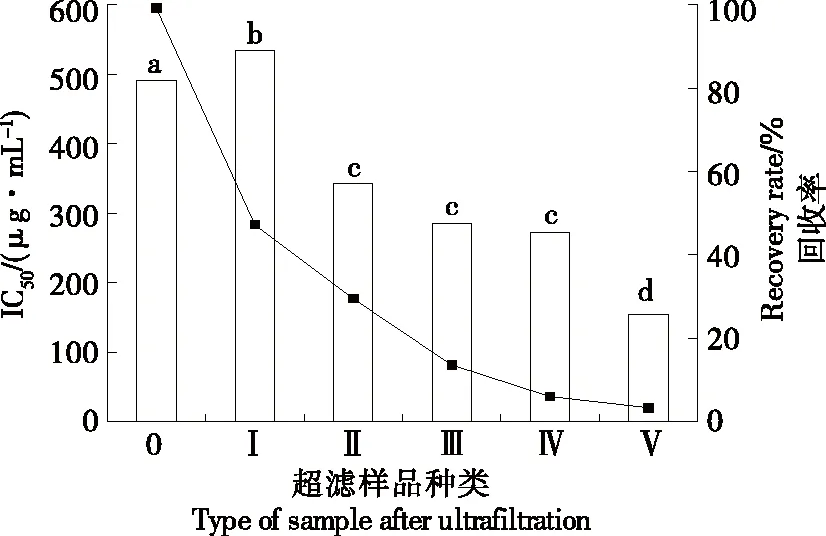
在40 ℃下,用碱性蛋白酶和脯氨酸蛋白酶同步酶解大鳞副泥鳅蛋白3 h后,所得酶解产物具有最高ACE抑制活性。大鳞副泥鳅蛋白酶解产物(PDH)IC50为(491.45±15.11) μg/mL。而IC50值越低,ACE抑制活性越高。
采用10,5,3,1 kDa的超滤膜对PDH进行分离,如图1所示,5种组分中,分子量<1 kDa的PDH-Ⅴ表现出最高的ACE抑制活性,IC50值为(154.70±7.35) μg/mL;而分子量>10 kDa的PDH-Ⅰ的活性最低,IC50值为(533.45±12.89) μg/mL,与Li等[11]研究结果相符合。分析目前国内外对于食源性ACE的研究,大部分ACE抑制肽的氨基酸个数低于10,分子量小,这是分子量<1 kDa的超滤膜分离所得的ACE抑制肽活性最高的原因之一。此外,还有可能由于酶解过程中引入大分子杂质,从而影响ACE抑制肽与ACE的结合,在使用较大分子量超滤膜时不能充分将其滤去,造成所得组分表现的ACE抑制活性有所降低。
小写字母不同表示差异显著(P<0.05)
由此可得,PDH的ACE抑制活性主要取决于其分子量,其ACE抑制活性随PDH分子量的降低而增加。而超滤是去除大分子、实现含有<1 kDa分子量肽分级及提高ACE抑制活性的有效手段。此外,肽得率随分子量的减小而减小,PDH-Ⅴ的肽得率为3.4%,所以大鳞副泥鳅蛋白并未酶解完全,仍然存在大部分大分子蛋白。因此,后续将继续对PDH-Ⅴ进行纯化。
2.2 凝胶过滤层析进行纯化
将冻干的 PDH-Ⅴ组分用蒸馏水溶解,使用 Sephadex G-15(1.6 cm×80 cm)上通过凝胶过滤层析进行纯化。凝胶过滤是一种可以分离具有不同分子尺寸的物质的方法,并且已被用于从低分子量物质中脱盐蛋白质溶液,分离蛋白质和其他胶体。由图2所知,纯化得到3个组分F1、F2和F3,这3个组分的IC50值分别为(148.45±7.83),(98.52±5.67),(172.87±9.78) μg/mL。
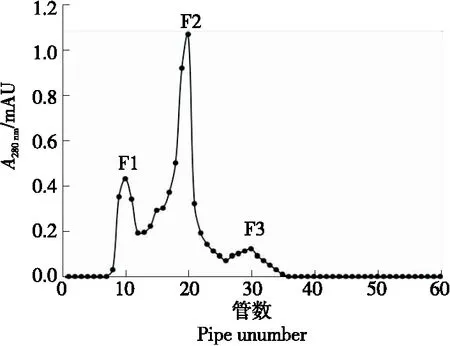
图2 样品Ⅴ的Sephadex G-15凝胶渗透色谱
通过研究测定表明F2具有最强的ACE抑制活性,与PDH相比,活性提高了4.99倍(表1)。收集F2合并冻干以待进一步纯化。
2.3 RP-HPLC分离纯化
将来自凝胶色谱的组分通过半制备型RP-HPLC进一步分离纯化。如图3(a)所示,收集到的5个组分中,保留时间为2.07 min的F2-2表现出最强的ACE抑制活性,其IC50值为(17.89±3.28) μg/mL。此外经色谱柱分离后所得的色谱图中出现一些小分子肽的混合物,根据石杰等[12]的研究进行分析可得,可能是由于在进行洗脱的过程中,F2中所含的亲水性盐类对分离造成影响,从而导致部分小分子肽的出现。
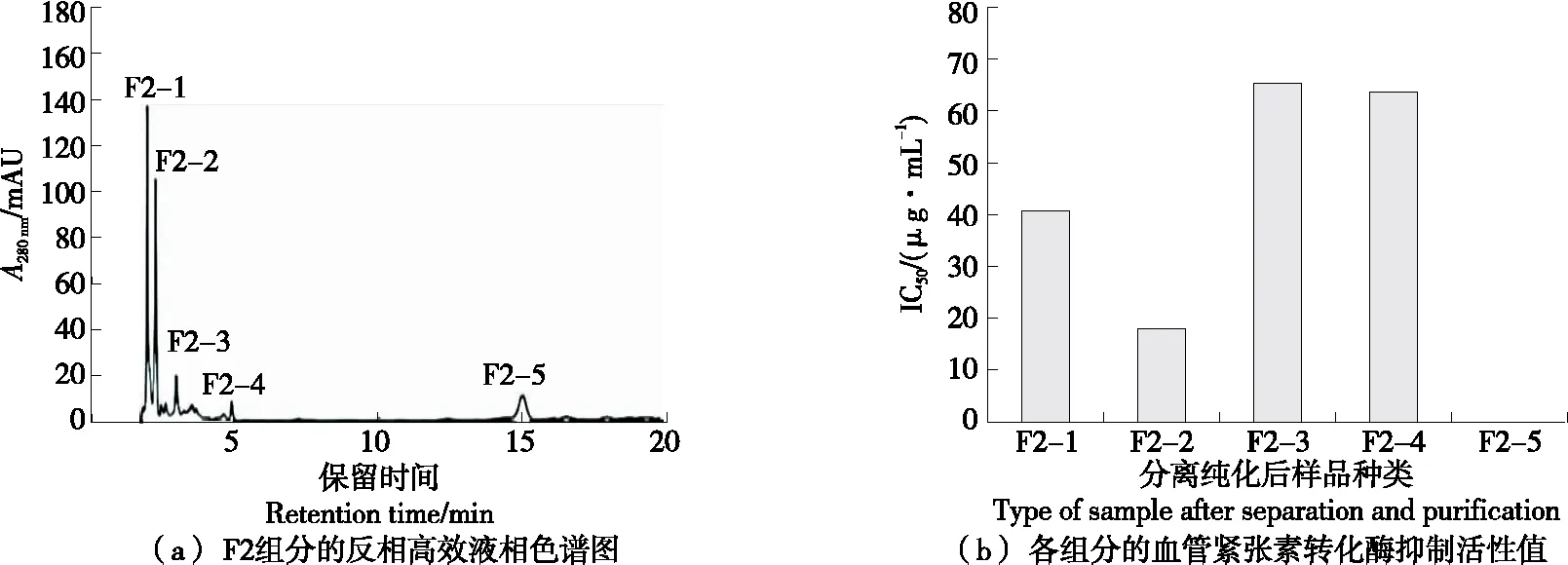
图3 F2组分的反相高效液相色谱图及各组分的血管紧张素转化酶抑制活性值
使用反相高效液相色谱仪进行二次分离以获得纯度更高的F2-2组分。由图4可知,组分F2-2呈现明显的单一峰,可得肽段较纯从而可以用于肽表征。但在特征峰后仍存在含量较低的肽段,为提高F2-2组分纯度通过重复注射在相同的保留时间收集F2-2级分并冻干。将级分重新溶解,用于HPLC-MS/MS分析与肽的一级结构的氨基酸序列测定。
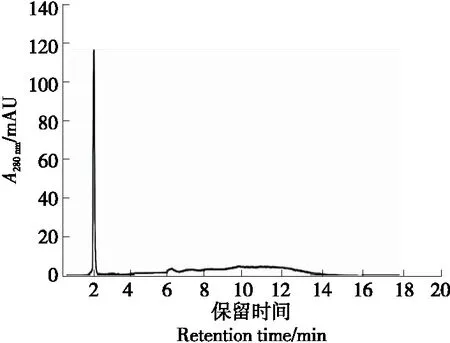
图4 F2-2组分的反相高效液相色谱图
2.4 ACE抑制肽的分离纯化
纯化获得组分的IC50值和纯化倍数见表1。使用超滤、Sephadex G-15过滤层析、RP-HPLC纯化程序从PDH纯化ACE抑制肽,纯化倍数达到27.47倍,得到的目的肽段IC50为(17.89±3.28) μg/mL。

表1 大鳞副泥鳅蛋白血管紧张素转化酶抑制肽的纯化†
2.5 采用质谱法测定ACE抑制肽的一级结构
利用质谱仪对组分F2-2进行一级质谱(MS)与二级质谱(MS/MS)交替处理,而各组分的结构利用分析软件预测。其过程为选择一级质谱所产生的肽段中的母离子(质子化分子),使其进入二级质谱,并使其发生碰撞诱导解离(CID)反应分解形成一定量的碎裂离子。由于各个肽段的质量数不同,而肽序列可利用其间存在的差值进行推定,并利用仪器中所含软件对肽序列进行解析。
如图5所示,丰度值最高的母离子为m/z345.208,即可得出该目标肽段的分子量为321.208 Da。再用m/z345.208 的母离子在二级质谱(MS/MS)中进行分析处理。由于氨基酸残基通过肽键连结形成肽与蛋白质,而沿肽骨架断裂所获得的是主要的碎裂峰组。在发生电离反应与飞行进程中,待测分子产生亚稳离子,由于相邻同组类型峰的质量存在差值,而肽的序列测定正是通过分析质量差,进而识别相应氨基酸残基。
图5 组分F2-2的质谱图
肽段在质谱分析中的碎裂具有一定规律,碎片离子主要分为两类:从N端开始以a、b、c表示,从C端开始以x、y、z表示,在肽链中与其他键相比,酞胺键较易断裂,因此 b和y系列离子具有相对较大的出现概率。母离子(345.208)进入二级质谱,在谱图中其相应碎片具有标注,利用肽的b离子和y离子互补的方法推断组分的序列为Glu-Gly-His,分子量为345.2 Da。从大鳞副泥鳅蛋白中分离所得ACE抑制肽的氨基酸序列中甘氨酸属于疏水性氨基酸,石杰等[12]研究表明疏水性氨基酸的存在促进ACE抑制肽的抑制活性。组氨酸属于正电荷氨基酸,Wu等[14]研究发现正电荷氨基酸可使ACE抑制肽表现出更强的抑制活性,由此可得此肽段具有较高的ACE抑制活性。
2.6 ACE抑制肽的抑制动力学研究
ACE抑制肽以竞争性、非竞争性和混合型方式抑制ACE的活性[15],其中多为竞争性抑制,而竞争性抑制剂一般与底物结构较为相似,竞争性抑制剂可与活性位点结合,阻断底物和酶之间的相互作用或改变酶的构象,从而使底物无法接近活性位点[16-18]。其中底物浓度、抑制剂浓度、底物以及抑制剂与酶的亲和能力是影响竞争性抑制的主要因素[19]。
图6 主成分质子数与电荷数比为345.208的串联质谱图
使用Lineweaver-Burk作图研究来自PDH肽的ACE抑制模式,测定了存在和不存在抑制剂的酶的动力学常数[20]。图7结果表明,Vmax不会随大鳞副泥鳅ACE抑制肽浓度的变化而发生明显差异,但Km(反应速度为1/2Vmax时底物浓度的数值)随肽浓度的增加而有所提高,表明这种肽是ACE的竞争性抑制剂,可以结合到肽的活性位点,导致底物无法与活性位点结合,从而起到抑制性作用。综上,PDH水解肽为竞争性抑制肽,具有显著的ACE抑制活性,作为功能性食品成分或天然降高血压剂具有良好的市场前景。
图7 大鳞副泥鳅血管紧张素转化酶抑制肽对血管紧张素转化酶的抑制Lineweaver-Burk模型
3 结论
研究采用超滤、凝胶过滤层析和半制备RP-HPLC多级分离技术构建了一种活性高、纯度高的大鳞副泥鳅蛋白ACE抑制肽的提取纯化方法。所得目标肽段的IC50值为(17.89±3.28) μg/mL,与大鳞副泥鳅的初始酶解物相比,ACE抑制活性显著提高,纯化倍数27.47,其氨基酸序列为Glu-Gly-His,分子量345.2 Da。ACE抑制动力学研究分析表明大鳞副泥鳅抑制肽对于底物ACE是一种竞争性抑制。由此可得,研究所得的大鳞副泥鳅蛋白ACE抑制肽具有明显的降压效果,且原料价格低廉,来源广泛,可作为良好的食源性ACE抑制肽来源。但大鳞副泥鳅蛋白ACE抑制肽的体外试验无法确定其在体内的降压效果,仍需进行进一步的动物性试验来验证。

