MiR-24对肺癌A549细胞增殖和迁移的影响
杜娟,严馨,邱丽,易静叶,阳甜
(西安交通大学第一附属医院呼吸与危重症医学科,陕西 西安 710061)
肺癌是世界范围内发病率和死亡率均较高的恶性肿瘤疾病[1],截止2013年我国的肺癌发生率和病死率均居恶性肿瘤首位,严重威胁人类的生命健康[2]。其中,非小细胞肺癌作为肺癌的常见亚型,约占所有病例的85%,传统的化疗药物虽然可有效延长患者的生存期,但治疗副作用较大,严重时还会危及患者生命[3-4]。微小核糖核酸24(micro ribonucleic acid 24,MiR-24等微小核糖核酸(micro ribonucleic acid,miRNA)作为机体内的癌基因或抑癌基因,可通过抑制细胞因子的表达调控细胞的凋亡和分化过程,进而影响宫颈癌、胆管癌等多种恶性肿瘤疾病的发生和进展[5-7]。异常表达的MiR-24在恶性肿瘤疾病的发生和发展过程中发挥出了“致癌”或“抑癌的作用”,甚至在恶性肿瘤疾病的放化疗治疗中也发挥出了一定的作用。然而,临床中针对其在肺癌细胞中的影响研究却相对较少,且其作用机制尚不明确。本研究分析MiR-24对肺癌A549细胞增殖和迁移的影响,并探讨其作用机制,期望为肺癌的靶向治疗提供新方向。
1 材料与方法
1.1 主要试剂
人肺癌A549细胞购于中国科学院细胞库;细胞培养基(美国Gibco公司),胎牛血清 [赛默飞世尔科技(中国)有限公司],台盼蓝染色检测试剂盒(上海碧云天),噻唑蓝 [3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT](上海碧云天),兔抗基质金属蛋白酶2(matrix metalloproteinases-2,MMP-2)(美国Abcam公司),兔抗基质金属蛋白酶9(matrix metalloproteinases-9,MMP-9)(美国Abcam公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(美国Abcam公司),TUNEL染色试剂盒(上海碧云天),青霉素/链霉素双抗(美国Gibco公司),MiR-24拟似物(CATGAGGGCAGAAACCGATGCAA)和MiR-24抑制物(GTTGCATCGGTTTCTGCCCTCATG)由广州锐博生物有限公司合成,二甲基亚砜(dimethyl sulfoxide,DMSO)(上海碧云天),辣根过氧化物酶标记山羊抗兔(上海碧云天)
1.2 方法
1.2.1 细胞培养及分组 将人肺癌细胞A549放入10%胎牛血清和1%青霉素/链霉素的双抗细胞培养基中,并将其放置于5% CO2、37 ℃的细胞培养箱(山东博科生物产业有限公司,QP-50)内培养,待细胞长满约90%时进行传代,培养后取对数生长的细胞用于实验。将加入MiR-24拟似物的细胞作为观察组,加入MiR-24抑制物的细胞作为抑制组,另设空白对照作为对照组。
1.2.2 MTT检测细胞增殖能力 将人肺癌A549细胞接种于1×104/孔的96孔板(赛默飞世尔科技有限公司)内,12 h后分别转染MiR-24拟似物和抑制物,分别作为观察组和抑制组,另设空白对照组,并在处理后分别于0、12、24和48 h各个不同时间段分别加入MTT,于37 ℃条件下孵育4 h,随后加入100 μL DMSO,震荡15 min后于490 nm处测量吸光值(optical density,OD),以反映细胞增殖活力。OD490值越高,细胞的活力越高。平行试验3次。
1.2.3 划痕实验检测细胞迁移能力 将处理后的人肺癌A549细胞接种于6孔板内,每孔3 mL,待细胞生长至90%融合后使用200 μL的吸头在孔板内垂直划痕,使用磷酸盐缓冲液(PBS)对清洗3次后,将A549细胞分为3组,分别加入无血清培养基(对照组)、MiR-24拟似物(观察组)和抑制物(抑制组)继续培养,每组设立2个复孔,培养时间均为24 h。分别于实验0 h和24 h于光学显微镜下观察划痕伤口的宽度并做好记录,计算创面的愈合率作为细胞迁移能力的判定依据。创面愈合率=(1-24 h创面宽度/0 h创面宽度)×100%[8]。
1.2.4 Transwell法检测细胞侵袭能力 将对数生长的人肺癌A549细胞接种于Transwell小室中,每孔密度为1×105,终体积为200 μL,将600 μL的无血清培养基加入至下室内,待12 h后更换培养基,将A549细胞分为3组,分别加入无血清培养基(对照组)、MiR-24拟似物(观察组)和抑制物(抑制组)继续培养,每组设立2个复孔。转染24 h后,使用棉签将上层细胞擦去,使用浓度为95%的乙醇溶液固定20 min后,使用4%的台盼蓝染色20 min,于200倍的显微镜下观察实验结果,每个小室随机抽取6个视野拍照并计算穿膜细胞个数。
1.2.5 Western blot检测相关蛋白的表达水平 细胞处理24 h后进行收集,裂解后再次收集细胞总蛋白,取等量的蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后将其转印至聚偏氟乙烯(poly(1,1-difluoroethylene),PVDF)膜上,使用含有5%脱脂奶粉的封闭液将其封闭60 min,随后加入兔抗MMP-2(1∶2 000)、兔抗MMP-9(1∶4 000)和鼠抗β-actin(1∶8 000),于4 ℃的条件下反应8 h,使用辣根过氧化物酶标记的羊抗兔二抗(1∶10 000)于室温条件下反应60 min,以GAPDH作为内参照,使用凝胶分析软件进行分析,观察内参泳道灰度及目的条带之间的比值作为蛋白相对表达水平。
1.2.6 实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)检测相关mRNA表达 利用qPCR法针对人肺癌A549细胞中的MMP-2和MMP-9 mRNA表达水平进行检测,采用TRizol法提取细胞总RNA后进行逆转录反应,反应条件为:37 ℃条件下反应15 min,98 ℃条件下反应5 min,反应结束后将cDNA稀释至5倍,放置于-20 ℃的条件下保存,随后使用检测试剂盒(天根生化科技有限公司)配置反应体系并在PCR仪(赛默飞世尔科技有限公司)上进行反应,反应条件为:95 ℃条件下15 min,95 ℃条件下10 s,62 ℃条件下10 s,共计反应40个循环后,使用仪器自带的程序分析溶解曲线。
1.3 统计学分析
2 结果
2.1 MiR-24对肺癌A549细胞增殖的影响
0 h时,观察组和抑制组的OD490值比较,差异无统计学意义(P>0.05);在12、24和48 h,观察组的OD490值低于对照组,差异具有统计学意义(P<0.05)。见表1。

表1 MiR-24对肺癌A549细胞增殖的影响
2.2 MiR-24对肺癌A549细胞迁移和侵袭的影响
单因素ANOVA分析结果显示,各组间的迁移细胞数、侵袭细胞数和愈合率比较,观察组<对照组<抑制组,且组间三项指标比较差异均有统计学意义(P<0.05)。见表2、图1和图2。
2.3 MiR-24对肺癌A549细胞相关蛋白表达的影响
单因素ANOVA分析结果显示,MMP-2和MMP-9蛋白表达水平比较,观察组<对照组<抑制组,组间两项指标比较差异均有统计学意义(P<0.05)。见表3和图3。
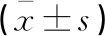
表2 MiR-24对肺癌A549细胞迁移和侵袭的影响

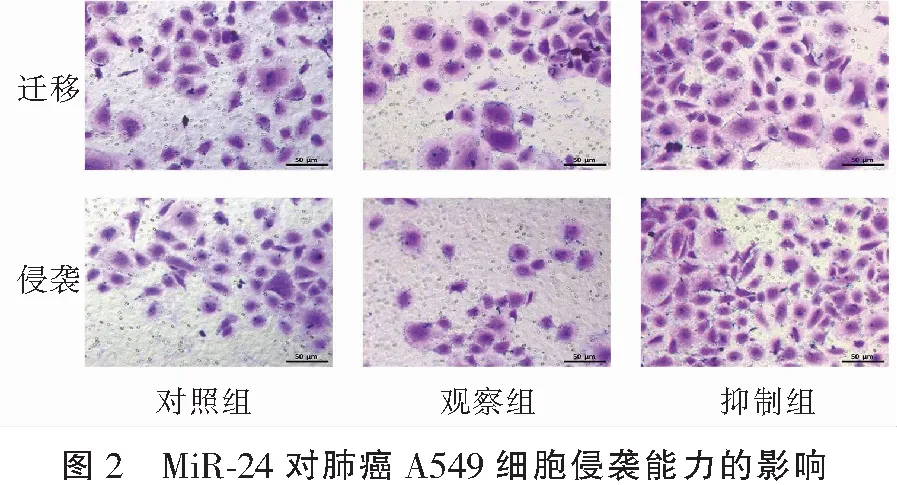
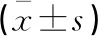
表3 MiR-24对肺癌A549细胞相关蛋白表达的影响

2.4 MiR-24对肺癌A549细胞相关mRNA表达的影响
单因素ANOVA分析结果显示,MMP-2和MMP-9 mRNA表达水平比较,观察组<对照组<抑制组,组间两项指标比较差异均有统计学意义(P<0.05)。见表4。
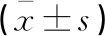
表4 MiR-24对肺癌A549细胞相关mRNA表达的影响
3 讨论
肺癌是目前导致癌症相关性死亡的常见病因,每年有180万的肺癌新发病例,且有160万人因肺癌死亡[9],而肺癌患者的5年生存率仅有4%~17%[10]。临床中,针对肺癌患者的治疗方式包括手术治疗、药物治疗和放射干预治疗等,随着近年来临床治疗水平的不断提升,各种治疗方式虽取得了一定的进步,但肺癌患者的远期生存率仍相对较低,因此迫切需要一种更加有效的治疗手段[11]。近年来,大量临床研究[12-15]发现miRNA广泛存在于人体的体液、组织以及血液当中,在肿瘤的发生、发展以及预后中至关重要,由于其可在血清中稳定存在,且具有一定的重复性,因此在临床中有较好的应用价值[12]。譬如,MiR-21、MiR-34和MiR-23等多种miRNA均在肺癌组织中存在明显的表达异常,对肺癌的发生和发展有重要作用[13-15]。
MiR-24在人体多种组织内广泛存在,可调控细胞的生长发育和增殖、凋亡,但其在不同细胞内对细胞的增殖和凋亡调控作用却并不相同[16-17]。本研究发现观察组在12 h、24 h和48 h的细胞增殖率低于抑制组(P<0.05),观察组的迁移细胞数、侵袭细胞数和愈合率均低于对照组和抑制组(P<0.05),且对照组低于抑制组(P<0.05),说明MiR-24过表达可有效抑制肺癌A549细胞的增殖、迁移和侵袭能力,与既往研究[18]结果相似。
MMP是一种内肽酶,可降解大部分的细胞外基质成分,具有促进肿瘤细胞突破组织屏障,侵袭邻近组织的能力[19]。MMP-2和MMP-9在许多肿瘤组织中均有所表达,不仅影响肿瘤细胞的组织屏障及其侵袭邻近组织的能力,且对肿瘤细胞的黏附能力也可以产生一定的作用[20]。本研究发现,MMP-2、MMP-9蛋白以及两者mRNA的表达比较,观察组>对照组>抑制组(P<0.05),提示MiR-24可能通过对MMP-2和MMP-9表达水平的调控,进而对肺癌A549细胞的增殖、迁移和侵袭能力产生抑制作用。
综上所述,MiR-24可有效抑制肺癌A549细胞的增殖、迁移和侵袭,且其作用机制与对MMP-2和MMP-9蛋白表达的下调有关。

