CD47表达与实性恶性肿瘤临床病理特征的Meta分析
蒋春樊 杨眉 邢辉 高运苓 余婷玉 陈洈伟
恶性肿瘤仍然是全世界死亡的主要原因,2018 年约有1 800 万例新发病例和960 万例死亡病例[1]。现在常见的治疗手段(包括手术,放疗、化疗和免疫治疗)无法治愈晚期恶性肿瘤,因此学者们正在研究其他治疗方法。癌细胞通常具有无限的复制潜力,对抑制生长的信号不敏感,抵抗细胞死亡,具有持续的血管生成、转移,避免免疫细胞检测的能力,同时其基因组的不稳定性易获得基因突变。随着分子生物学的发展越来越多的靶向治疗药物被开发出来,部分恶性肿瘤患者的无病生存期有了显著延长。发现新的抑制恶性肿瘤进展的分子靶点是当前医学界研究的热点。CD47 又称整合素相关蛋白[2],在乳腺癌[3]、输卵管癌[4]、胃癌[5]、肺癌[6]等多种癌细胞上中呈现过表达,参与细胞增殖,抑制凋亡和促进迁移等多种生物功能[7]。CD47 可以与其配体SIRP a结合抑制巨噬细胞的吞噬活性,造成所谓的“别吃我”现象,从而使癌细胞逃脱免疫系统的攻击。CD47 是多种恶性肿瘤的潜在预后因子。目前CD47 表达与恶性肿瘤的预后关系学术界尚无定论。因此,本研究探讨了CD47 在恶性实体肿瘤中的表达与患者的预后及临床参数的相关性,目的是为恶性实体肿瘤的分子靶向治疗提供深入研究的依据。
1 研究方法
1.1 纳入与排除标准
1.1.1 研究类型
回顾性队列研究。
1.1.2 研究对象
病理明确为恶性实体肿瘤的患者,纳入病例临床资料完整。国籍、种族、年龄等因素本次研究中不受限制。
1.1.3 暴露因素
CD47 蛋白表达作为暴露因素。
1.1.4 结局指标
总生存率(overall survival,OS)。
1.1.5 纳入标准
(1)原始研究中的患者均经病理学确诊为恶性肿瘤;(2)采用免疫组织化学染色法检测CD47 在恶性肿瘤组织中的表达情况;(3)研究CD47 的表达与恶性肿瘤患者总生存率之间的关系。
1.1.6 排除标准
(1)非中英文文献;(2)重复发表的文献;(3)文章的研究对象是细胞或者动物;(4)会议论文;(5)原始数据不全,无法获取风险度(hazard ratio,HR)及95%置信区间(Confidential intervals,CI)及生存曲线的文献。
1.2 检索策略
通过互联网检索OVID、PubMed、EMbase、知网、Cochrane Library、维普、CBM、和万方等数据库,搜集CD47 在恶性实体肿瘤表达的文献,检索时间限制均为数据库建库以来至2020 年3 月。检索采用自由词与主题词相结合的形式完成,英文检索词包括CD47、IAP-50 Antigen、Thrombospondin-1 Receptor CD47、Integrin-Associated Protein p50、sarcoma、cancer、carcinoma、neoplasm、malignant tumor、epithelioma 等。中文检索词包括CD47、整合素相关蛋白、癌、恶性肿瘤、肉瘤等。
1.3 文献筛选、资料提取与偏倚风险评价
由两名研究人员背靠背筛选并甄别文献,提取数据后互相核对,如有不同意见则讨论达成统一,不能形成共识则征求第三位研究人员的意见以多数人员意见为最终决定。提取数据包括第一作者,发表年份,肿瘤类型,病例数量,阳性临界值,阳性患者比例,HR,95%CI,P值等。纽卡斯尔-渥太华量表(newcastle-ottawa scale,NOS)被采用评价纳入研究的偏倚风险。NOS <5分的文献将不能入选。
1.4 统计分析
RevMan 5.3 或者stata15.1 选择做Meta 分析。HR为判断预后的效应指标,比值比(odds ratio,OR)为CD47 与临床参数关系的效应指标。同时给出其点估计值和95%CI。用Engauge Digitizer 软件提取生存分析图中各点的坐标数据,用Tierney 等提供的统计量表计算HR,95%CI及P 值[5]。采用Q 检验和I2进行异质性分析(P>0.1,I2≤5O%为无明显异质性;反之,异质性较大),纳入文献间无明显异质性,采用固定效应模型进行后续分析;若纳入文献间存在明显异质性,则采用亚组分析或敏感性分析进一步分析异质性来源,在排除明显临床异质性的影响后,采用随机效应模型进行Meta 分析。P<0.05 为差异有统计学意义。
2 结果
2.1 纳入文献和相关特征
通过初步的检索,本研究一共筛选出41 项研究。分析文献的题目和摘要,共发现26 项重复、数据雷同、不能提取结局统计量或方法学不能满足纳入要求的文献被剔除。剩余15项符合纳入标准的研究被用于本次分析。所有文献均保留有总生存期。依据NOS 对15 项篇文献进行质量评价,文献的质量评分为6~9 分,8~9 分的文献质量相对较高,6~7 分为质量相对低组。
2.2 CD47 表达与实体恶性肿瘤患者预后的关系
CD47 的表达与实体恶性肿瘤患者的预后关系并不密切(P=0.90),差异无统计学意义,死亡风险轻度增加2%(HR=1.02,95%CI=0.73~1.43,P=0.90)(图1)。此结果的I2=84%,P<0.01,存在较大的异质性,因此,本研究进行了亚组分析,在NOS 8~9 分组,文章中直接提供HR,95%CI及P值组,病人数小于100 人组和做有多因素生存分析组中CD47 的表达与实体恶性肿瘤患者的不良预后显示密切关联性(P<0.05)见表1。

表1 CD47 表达与总生存期关系的亚组分析
2.3 CD47 表达与实体恶性肿瘤患者临床病理特征的关系
实体恶性肿瘤组织中CD47 的阳性表达与分期(OR=2.01,95%CI=1.19~3.40,P<0.01)、分级(OR=1.91,95%CI=1.31~2.70,P<0.01)、淋巴结转移(OR=1.6,95%CI=1.25~2.00,P<0.01)、远处转移(OR=2.63,95%CI=1.51~4.60,P<0.01)和 复 发(OR=3.86,95%CI=1.98~7.50,P<0.01)有相关性(P<0.05),但与性别(OR=0.87,95%CI=0.65~1.10,P=0.33)、年龄(OR=1.03,95%CI=0.80~1.30,P=0.84)、肿瘤大小(OR=1.23,95%CI=0.85~1.70,P=0.27)及肿瘤浸润深度(OR=1.21,95%CI=0.75~1.90,P=0.43)无相关性(P>0.05)(表2)。除分期分析外均采用固定效应模型进行统计分析。
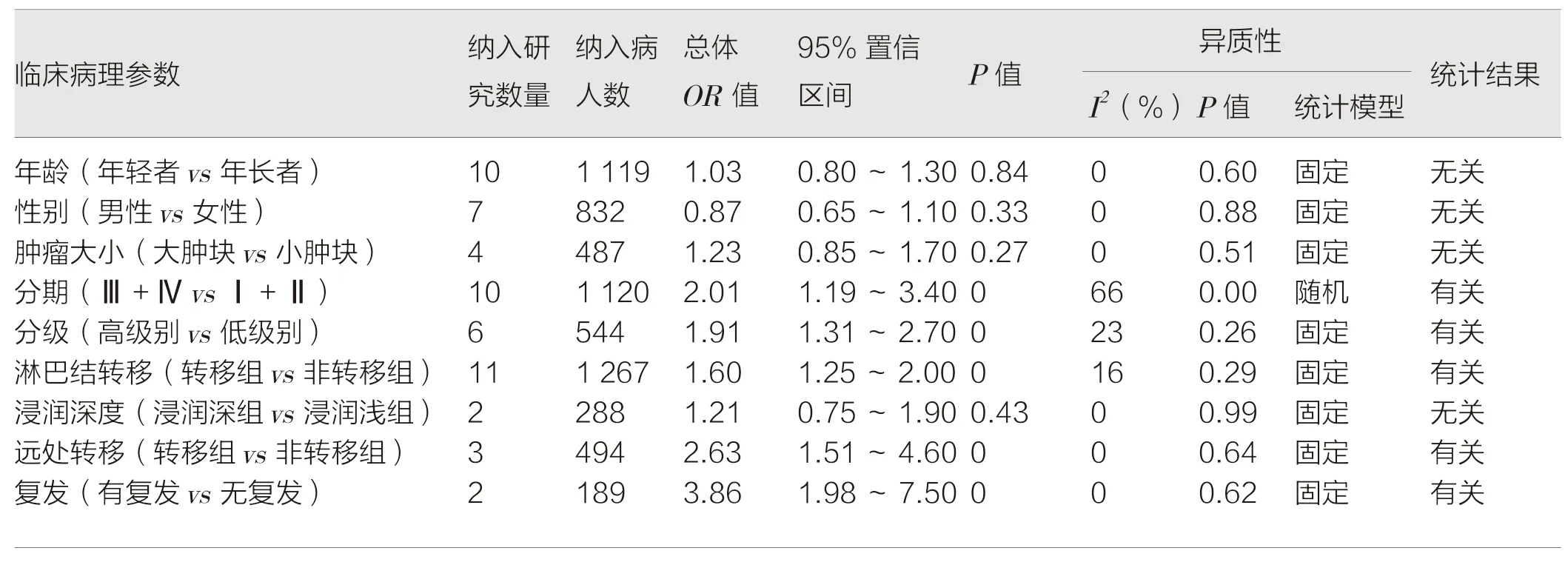
表2 CD47 表达与临床病理参数分析
2.4 异质性分析
Q检验和I2检验被应用分析各项研究之间的异质性。统计后发现,CD47 表达与预后(I2=84%,P<0.01)及分期(I2=66%,P<0.01)的相关性分析之间存在异质性。本研究的15 篇文献进行敏感性分析(图2),未发现任何一篇文献对本次研究的结果造成明显的干扰。对本次的15 篇文献进行亚组分析发现,生存分析(单因素vs.多因素),病人人数(大于100 人组vs.小于100 人组),数据来源(文章提供数据vs从图中提取数据)和NOS 评分(8~9 分组vs.6~7 分组)均能降低部分亚组的异质性同时显示出CD47 与患者预后不良的关系,且亚组间具有明显的差异(P<0.05)。CD47 表达与分期的关系采用随机效应模型(OR=2.01,95%CI=1.19~3.40,P<0.009)。

图2 纳入文献的敏感性分析
2.5 偏倚分析
本研究通过绘制漏斗图考察否存在发表偏倚,漏斗图对称性并不佳,发表偏倚尚不确定,于是本次研究实施begg 偏倚检验(P=0.961)和egger 偏倚检验(P=0.137),P>0.05 差异无统计学意义,意味着本次研究文献不存在发表偏倚。
3 讨论
CD47 是属于免疫球蛋白超家族的跨膜蛋白,在20世纪80年代首次被鉴定为人类卵巢癌的生物标志物[2]。它也广泛表达于正常细胞表面,并在许多类型的癌症中过度表达[1]。SIRPα 属于免疫受体的多基因家族,在中枢神经系统的髓细胞和神经元细胞中表达。CD47可以通过激活吞噬细胞中的信号转导通路使癌细胞逃避免疫监控。CD47-SIRPα 轴是髓细胞活化的关键调节因子,并作为髓细胞特异性免疫检查点发挥作用[8]。在许多癌症类型中,CD47 高表达与晚期预后相关,阻断CD47-SIRPα 相互作用可促进吞噬细胞对癌细胞的清除[9]。
本次meta 分析评估CD47 表达与实体恶性肿瘤患者预后和临床参数之间的关系。本次研究分析了15 篇文献和1756 个病例。最早研究发现患者的预后不佳和CD47 表达增加关系并不密切。接着通过敏感性分析显示,没有任何一篇文献对本次meta 分析的结果造成明显的干扰。亚组分析显示,生存分析(单因素vs.多因素),病人人数(大于100 人组vs.小于100 人组),数据来源(文章提供数据vs.从图中提取数据)和NOS 评分(8~9 分组vs.6~7 分组)均能降低部分亚组的异质性同时显示出CD47 与患者预后不良的关系。而且亚组间差异有统计学意义(P<0.05),表明亚组分类较理想,增加组内文献的同质性。CD47 表达与分期的关系统计效应量OR 值较大,I2尚可接受,故采用随机效应模型。本次研究通过漏斗图、begg 检验和egger 检验分析纳入文献的质量,排除了发表偏倚的影响,本次研究发现CD47 的表达与患者预后不良、分级、分期、淋巴结转移、远处转移及复发明显相关,提示CD47 可以作为重要的生物标记物。CD47 因此可能是有效的抗癌治疗靶点。
以前的研究表明,阻断CD47-SIRPα 相互作用有助于通过刺激巨噬细胞吞噬和抗肿瘤免疫反应来根除癌细胞[10]。吞噬作用可以诱导细胞因子和趋化因子的分泌,在肿瘤内募集更多的免疫细胞,并增强CD47 阻断剂的治疗效果。髓系免疫细胞,例如单核细胞、粒细胞和树突细胞,以及非髓系免疫细胞,例如T 细胞和自然杀伤(NK)细胞,也可以CD47/SIRPα 阻断疗法产生效应[11]。阻断CD47 在淋巴瘤和肺癌中启动或增强适应性免疫反应。CD47 还通过调节细胞间信号传导诱导非依赖半胱氨酸蛋白酶性癌细胞死亡[12],表明对CD47 阳性癌细胞的直接细胞毒性可能是CD47 靶向治疗的作用机制。
CD47 作为恶性肿瘤靶点的研究正逐渐增多,而相关的meta 分析并不是很多,因此本研究存在以下几个局限性。首先,实体恶性肿瘤相关研究有限,如肺癌、乳腺癌、胃癌、胶质母细胞瘤和黑色素瘤都不是很多,这降低了分析结果的可靠性。其次,在纳入的文献中,阳性临界值划分不一致,这可能导致了统计异质性。第三,有些文献未直接提供生存分析数据,从Kaplan-Miere 曲线中提取的数据不像文章中直接报道的那样可靠,并且可能导致错误,第四,由于本次研究纳入的肿瘤类型较多,但是相同类型肿瘤数量较少,因此本研究未对分级、分期、淋巴结转移、远处转移及复发等进一步进行亚组,这在一定程度上可能影响本研究结论的可靠性。

