高压电脉冲技术在肿瘤治疗领域的研究与应用进展
任冯刚,张雨驰,陈雪,吴荣谦,仵正,吕毅
1. 西安交通大学第一附属医院 a. 精准外科与再生医学国家地方联合工程研究中心;b. 肝胆外科,陕西 西安 710061;2. 西安交通大学 电气科学与技术研究院,陕西 西安 710049
引言
恶性肿瘤严重威胁人类健康,疾病负担极其严重。多数恶性肿瘤起病隐匿,早期并无明显症状,导致大量病例在确诊时已经处于中晚期,失去了根治性治疗机会[1]。当前,以外科手术为主的综合治疗是实体肿瘤的主要治疗模式,外科治疗与化疗、放疗、局部治疗、靶向治疗、免疫治疗等共同构成恶性肿瘤的全周期治疗体系。尽管当前肿瘤治疗水平已较过去取得很大提高,但是现有的肿瘤治疗技术在适应证和治疗效果上仍然存在一定局限,特别是针对中晚期肿瘤的治疗手段和长期疗效仍然有限,探索恶性肿瘤新的治疗技术具有重要的临床意义。
近三十年来,随着生物医学工程技术的不断发展,涌现出多种基于电磁学、声学和光学原理,借助外部物理因子能量在原位毁损肿瘤组织以实现肿瘤局部治疗的新型医疗技术。同时,超声、CT、MRI等医学影像技术进一步促进了图像引导下肿瘤消融技术在临床的广泛应用[2]。当前常见的肿瘤消融技术主要基于生物传热原理:将物理因子能量转化成热能后升高肿瘤组织的温度,通过引起肿瘤组织发生不可逆性热损伤实现消融目的,因此也被称为热消融技术,射频、微波、高能聚焦超声等是当前应用最为广泛的热消融技术。此外,还有通过降低组织温度来实现消融治疗的低温冷冻消融技术[3]。热消融技术易受组织热力学性质、能量吸收效率和热沉效应等影响,在临床应用过程中易对热敏感区域(如血管、胆道、神经等)产生不可逆性热损伤,因而在临床应用过程中存在一定限制[4]。
1 高压电脉冲技术原理和生物效应特点
基于脉冲电场(Pulsed Electric Field,PEF)生物效应原理的高压电脉冲技术是一种新型非热能局部治疗手段[5]。高压电脉冲技术通常采用一定强度和数量的微秒方波电穿孔脉冲(Electroporation Pulse,EP)作用于肿瘤组织,利用消融电极在目标消融区内形成具有一定强度和形态分布的PEF,通过一连串EP不断作用破坏肿瘤细胞膜和细胞环境稳态,最终导致细胞死亡[6]。由于EP在一个周期内的作用时间极短,电流经过组织所产生的焦耳热可以很快扩散和吸收,组织最终累积的热量很少,因此不会对组织产生热损伤[7]。
研究发现,不同脉宽、不同强度的EP作用引起的生物效应特点存在差异。通常认为,微秒脉宽EP作用可以改变细胞膜跨膜电位差,使细胞膜磷脂双分子层形成大量微孔,增加细胞膜通透性,破坏细胞结构稳定性,也被称为细胞膜电穿孔效应[5]。若PEF强度较低,细胞膜结构在EP作用结束后可以恢复,细胞活性不受影响,也称可逆电穿孔技术,当前主要用于电化学治疗(Electrochemotherapy,ECT)和经皮递药[8]。若PEF强度较高,细胞膜结构在EP作用结束后不能恢复,同时细胞膜通透性增加加速细胞内外物质交换,可以破坏细胞环境稳定性,最终导致细胞死亡,也被称为不可逆电穿孔(Irreversible Electroporation,IRE)技术[9]。同时,EP会对肿瘤微环境带来改变,包括激活肿瘤免疫反应、炎症反应和引起局部微血管灌注改变等,也在细胞死亡中发挥作用[6]。纳秒脉冲作用引起细胞死亡的机制目前仍存争议,主流研究认为纳秒脉冲可以作用于细胞器的膜结构,引起包括线粒体等细胞器膜结构和功能改变,但仍需进一步研究探索其内在机制[10-11]。
在宏观层面,高压电脉冲肿瘤消融技术的特点主要包括:① 电场依赖性:EP作用下肿瘤细胞的结局与EP波形特征、强度和数量等相关,且存在一定的强度依赖性。低强度EP作用并不会引起细胞死亡,甚至对细胞增殖、迁移和分化具有促进作用[12];一定数量的高强度EP对于细胞活性具有较为明显的抑制作用;② 不依赖温度:EP作用可以在不对组织产生热损伤的情况下毁损细胞,因而可以较好地保护组织支架结构,对于蛋白等对温度敏感的活性分子功能影响较小[13];③ 作用范围可控:电场强度和分布范围是决定消融结局的主要因素,主要与电极配置、脉冲参数、组织结构、电导率和介电常数等有关,可以利用数值仿真的方法在术前进行计算和估计,并通过调整脉冲参数和电极配置等方式进行调整和控制[14]。
2 高压电脉冲技术在生物医学领域的应用现状
基于上述特点,当前高压电脉冲技术在生命科学和医学领域的应用主要包括杀菌消毒、细胞电融合、基因电转染、ECT、心脏电生理治疗和肿瘤组织消融等。其中,高压电脉冲技术在杀菌消毒领域的应用历史最为悠久,特别是在食品工业中利用高压电脉冲对牛奶、饮料、蔬菜等进行灭菌处理,可以较好地保护食品口感,保存生物酶活性[15]。细胞电融合和电转染技术在生物医学研究领域有较为广泛的应用,这类技术主要是利用可逆电穿孔原理,通过改变细胞膜通透性促进细胞膜发生融合,或促进外源性物质进入细胞[16]。美国Harvard Bioscience公司研制的BTX ECM系列电穿孔仪是当前实验室较为常用的EP发生设备。常见的高压电脉冲治疗系统如图1所示。
图1 常见高压电脉冲治疗系统
ECT是高压电脉冲技术在肿瘤治疗领域最早的尝试,这项技术主要是基于细胞膜可逆电穿孔原理,通过升高细胞膜通透性促进需要在胞内发挥作用的细胞毒性药物(如博来霉素)入胞来杀伤细胞。意大利团队研发的Cliniporator系统是较早获批的ECT治疗系统,当前主要应用于皮肤原发或转移肿瘤治疗[8]。ECT需要EP和化疗药物联合使用发挥抗肿瘤效应,利用IRE效应直接实现肿瘤消融的设想最早由美国UC Berkerly大学Rubinsky教授提出,该团队于2007年成功研制首台高压电脉冲消融设备[9],相关技术由AngioDynamics公司技术转化后于2011年经FDA批准上市,目前已在北美、欧洲和亚洲等多个国家和地区开展临床研究,主要应用于中晚期胰腺癌、前列腺癌、肝癌和肾癌[6]。我国重庆大学电气工程学院孙才新院士团队也较早开展相关技术研究,在关键技术研发方面取得一定成果[17]。2021年以来,已经先后有两款国产EP消融设备获得NMPA批准上市。
3 高压电脉冲技术在组织消融领域的研究进展
近年来,高压电脉冲在肿瘤治疗领域的临床研究整体上呈现上升趋势,国内外研究结果显示该技术可以使常规治疗无效的中晚期肿瘤患者在一定程度上获益。在胰腺癌治疗方面,NCCN指南已经将IRE列入局部进展期胰腺癌可采用的治疗技术清单。在荷兰阿姆斯特丹肿瘤中心开展的PANFIRE I/II期临床研究中发现,IRE治疗后局部进展期胰腺癌患者的中位无事件生存期8个月,中位局部进展时间2个月,IRE治疗后中位生存期11个月[18]。IRE治疗后的主要潜在并发症包括胰腺炎、脓肿、胆管炎、胆管梗阻、肠系膜上动脉狭窄、胃肠反应等。在随后进行的PANFIRE-2 II期临床研究中发现,IRE联合化疗对于局部进展期胰腺癌患者的中位生存期为17个月,同时发现IRE治疗同时是否进行FOLFIRINOX对生存无影响[19]。最近完成PANFIRE-3 I期临床研究中将IRE与Nivolumab结合治疗局部进展期胰腺癌,同样获得了较为理想的治疗效果[20]。在原发性肝癌治疗方面,已有研究将IRE用于不可切除的肝细胞癌、肝内胆管细胞癌的局部治疗中,也有研究将IRE用于肝癌肝移植术前减瘤等。Sutter等[21]研究发现,消融术后6个月无病生存率为87%,12个月无病生存率为70%,主要并发症包括术区疼痛、气胸、门脉血栓、肝衰等。该研究证实IRE对于不适用于常规局部根治性治疗方法的原发性肝癌是安全和有效的。Martin等[22]研究了IRE用于不可切除的肝门部胆管癌,这部分病例由于肿瘤严重侵犯周围门静脉、肝动脉等结构,失去外科根治性治疗机会,同时射频等热消融技术应用受限,常规治疗手段有限。经IRE治疗后患者中位生存期26个月,无进展生存期18个月。术后主要并发症包括胆管梗阻部位消融后狭窄,常规置入胆道支架解除梗阻。该研究初步证实IRE可以有效控制肝门部胆管癌的进展,在一定程度上延长生存期。针对前列腺癌,来自国内外的研究报道均证实,IRE局部治疗前列腺癌时具有对泌尿生殖功能低毒性特点,在治疗肿瘤时不会对泌尿和生殖功能产生较大影响,对于前列腺癌治疗具有重要意义[17,23]。
高压电脉冲技术在肿瘤治疗领域的研究与应用使其非热消融的优势得以充分显现。近年来,将高压电脉冲技术用于心脏和血管内消融成为热点应用方向。Reddy等[24]率先开展EP用于心脏腔内消融治疗恶性心律失常的研究,证实其用于肺静脉隔离治疗的安全性。此后,该团队进一步研究证实EP对食管、上腔静脉等周围热敏感结构的安全性[25]。美国FARAPULSE公司(已被Boston Scientific收购)是全球较早开展高压电脉冲技术在电生理治疗领域的临床转化应用的公司之一,并将该技术命名为脉冲场消融技术(Pulsed Fields Ablation, PFA),其研制的FARASTAR系统已获得FDA批准上市[7,26]。除此之外,全球已有10余种来自不同厂家的心脏EP消融系统获批上市开展临床研究。高压电脉冲技术未来发展趋势如图2所示。
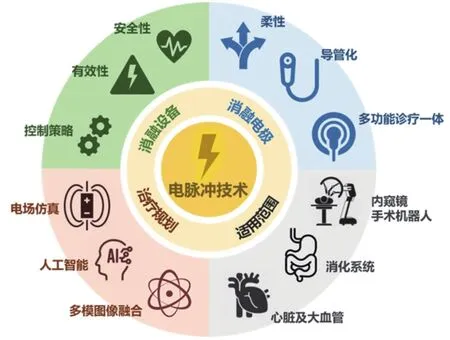
图2 高压电脉冲技术未来发展趋势
4 高压电脉冲技术未来发展趋势
结合临床需求和技术发展趋势,我们认为高压电脉冲技术在肿瘤治疗领域仍具有进一步应用的潜力,其未来发展应当聚焦于以下四个方面。
4.1 肿瘤消融设备
在电力电子技术、脉冲功率技术和先进控制技术等发展下,提升生物医用脉冲发生设备和关键核心部件的安全性、稳定性,特别是通过优化脉冲控制技术和策略,提升脉冲输出的质量水平,通过心电同步等手段减少对机体电生理活动和骨骼肌的不良影响,消除医生和患者“因电生畏”的心理,对于该技术的进一步临床推广和应用具有重要意义[24]。此外,当前成熟的消融设备主要基于微秒脉冲原理,纳秒脉冲所需的阈值电场强度要远高于微秒脉冲,对于消融设备输出脉冲的电压幅值要求较高,增加了设备的技术难度和安全性要求,特别是满足医用设备在电磁兼容、电气安全等方面的要求,还需要开展进一步的理论研究和技术攻关。
4.2 消融电极
人体组织富有弹性,杨氏模量远低于金属,消融电极由传统的刚性器件向柔性器件转变是未来的发展方向。特别是将针刺式电极向导管化电极转变,由微创向无创转变,电极本身由单一功能向复合功能转变,进一步提升消融电极的功能性,实现诊疗一体,准确判断消融程度和范围,减少因使用电极对人体带来的额外损伤,是充分发挥消融技术优势的关键[27-28]。
4.3 治疗规划
基于高压电脉冲技术电场依赖的特点,可以将其与智慧医疗技术、人工智能、多模图像融合导航等技术相结合,进一步提升治疗的精准性、安全性和有效性。通过降低脉冲参数设置和治疗范围规划的难度,使临床医生和辅助人员更容易学习和接受这项技术。此外,当前高压电脉冲用于细胞膜电穿孔或组织消融所需要的数学和物理模型研究还存在一些局限,特别是不同类型组织、不同类型细胞在EP作用下发生电损伤的规律和机制仍不完全明确,在缺少实验数据的基础上数值仿真模拟与真实数据会存在较大差异,这方面需要多学科交叉研究进一步解决[14,29-30]。
4.4 适用范围
由当前主要应用的实体肿块型肿瘤向腔道内肿瘤转变,特别是IRE非热消融的优势对于管腔内肿瘤更具应用价值。通过高压电脉冲消融技术与新型医疗技术的发展相结合,包括内镜技术、经自然腔道手术技术、介入技术、新型手术机器人技术等,可以进一步发挥其技术优势[31]。国内外若干研究机构已经在这些方向开展了初步探索,爱尔兰Cork大学Forde等[32]提出了适用于内镜下ECT治疗结直肠癌的消融电极方案。美国纪念斯隆凯瑟琳癌症中心Srimathveeravalli教授团队提出针对支气管肿瘤的网篮状电极方案,以及适用于十二指肠镜下导管化胆道消融电极方案[33-34]。西安交通大学外科梦工场吕毅教授团队率先提出适用于消化道黏膜消融的内窥镜下磁锚定导管电极方案[35-36]。但是,上述研究目前仍较多处于实验室研究阶段,尚未有较成熟的内镜下消融电极导管进入临床研究。此外,美国Gala Therapeutic公司设计了适用于支气管镜下的网状电极,将高压电脉冲技术用于慢性阻塞性肺部疾病治疗,且疗效显著。
5 总结与展望
新型高端数字诊疗装备是推动健康中国战略的重要引擎,是我国“十四五”规划的重点发展方向。集中优势资源进一步推动“医产学研用”创新链和产业链深度融合,充分发挥新型举国体制优势,加强技术源头创新,集中解决设备关键核心技术问题,实现“卡脖子”技术重大突破,推动国产高端医疗器械发展与应用,对于国家安全和国民经济建设具有重要的战略意义。“十四五”规划纲要中明确指出,要集中优势攻关医药和医疗设备领域关键核心技术。我国在高压电脉冲技术领域和核心关键技术方面已有较多积累,将该技术由国防军事和工业生产领域向医疗装备领域转化,同时结合前沿医学技术和治疗手段,充分提升国产高端诊疗装备的数字化、智能化和集成化水平,可以进一步完善国家医疗装备工业体系,为健康中国战略提供更为有力的科技支撑。

