攀西地区某蔬菜生产基地土壤镉污染评价及其对蔬菜安全性的影响
何争珍 谢玉成 廖海燕
(攀西无公害农产品监测中心,四川攀枝花 617000)
土壤中重金属在各种复杂的物理化学和生物化学过程作用下,会形成不同的重金属化学形态,其与农作物对重金属的富集积累特征及生物有效性密切相关[1~4]。目前,国际上应用最广泛的重金属形态分析方法——Tessier五步连续提取法,将土壤中重金属分为可交换态、碳酸盐结合态、铁锰氧化物结合态、有机物结合态和残渣态5种形态[1,5~6]。
镉(Cd)是生物的非必需元素,亦是生物毒性最大的重金属元素之一,若大量摄入会对人体免疫系统、生殖系统、心脑血管系统产生毒性,造成致癌、致畸、致突变的严重危害[7~9]。据《全国土壤污染状况调查公报》显示,全国土壤受镉污染最为严重[10]。因而,众多学者对土壤中镉的赋存形态及生物有效性进行了研究,窦韦强等[11]阐述了土壤pH是影响镉形态的重要因素之一的观点;翟琨[12]的研究表明,随外源镉处理浓度的升高,土壤中碳酸盐结合态和有机结合态的镉向交换态和残渣态方向转化;另有多位学者对多个地区土壤中镉的形态进行了研究,结果发现,因镉受多方复杂因素的影响,各地土壤中镉赋存的形态差异明显[13~18]。同时,有研究显示,不同蔬菜品种对重金属镉的富集能力有较大差异,土壤中镉超标并不一定造成蔬菜中镉含量超标[19~21],因此,对具体区域进行土壤中镉与蔬菜的协同监测分析是科学评价蔬菜安全性的重要基础。本文选取四川省攀西地区某蔬菜生产基地作为调查对象,该基地是重要南菜北调基地之一,也处在矿产资源丰富区域,因此十分必要对该基地土壤和蔬菜开展镉调查和分析。本文通过分析土壤中镉含量及其形态,并同步开展对应点位蔬菜中镉含量的检测,旨在探讨土壤镉含量及其赋存形态与蔬菜之间的关联性,为控制环境污染、合理调整蔬菜产业结构、保障蔬菜质量安全提供依据。
一、材料与方法
(一)样品采集与处理选择攀西地区某蔬菜生产基地110个采样单元作为监测对象,采集土壤和蔬菜样品。同一土壤类型、采用同一种植规范生产的地块为一个采样单元,若是大棚种植,一个大棚作为一个采样单元。每个采样单元按对角线、棋盘法、蛇形法布点,取0~20 cm耕作层土壤,由5个点位的土样组成一个混合样品(原始质量≥1 kg),共计采集110个样品。同步采集成熟蔬菜样品,采样点位与土壤采样点位置对应,也由5个采样点的样品组成一个混合样品(原始质量≥3 kg)。采样单元内间种(套种)蔬菜产品同时抽取,共计采集122个样品,其中茄果类产品77个,包括番茄41个、辣椒26个、茄子10个;豆类产品25个,包括豇豆7个、四季豆18个;瓜类产品20个,包括黄瓜4个、南瓜4个、西葫芦5个、丝瓜6个、苦瓜1个。
采集的土壤样品自然风干后,去除碎石、砂砾及植物残体等杂质,用陶瓷研钵研磨后,分别过2.00 mm和0.150 mm尼龙筛,保存在塑料瓶中备检。蔬菜样品测定部位按照GB 2763附录A相关要求,茄果类、瓜类去柄,全果、全瓜制样,豆类带荚全豆制样,制样时用干净纱布擦去样本表面附着物,用四分法分取至500 g左右放入食品加工机中捣碎成匀浆,冷冻保存备检。
(二)仪器与试剂
1.主要仪器。NexION 350X电感耦合等离子体质谱仪(美国Perkin Elmer公司)、AA 800石墨炉原子吸收光谱仪 (美国Perkin Elmer公司)、Multiwave微波消解仪(奥地利Anton paar公司)、Sension 4台式离子浓度计(美国HACH公司)、HC—3018R高速冷冻离心机(安徽中科中佳仪器公司)、D2KW—4恒温水浴锅(北京中兴伟业仪器公司)、HY—B调速振荡器(常州荣冠分析仪器厂)、ME204电子天平(瑞士METTLERTOLEDO公司)。
2.主要试剂。氢氟酸(优级纯,国药集团化学试剂有限公司),盐酸(优级纯,四川西陇化工有限公司),硝酸[分析纯,赛默飞世尔科技(中国)有限公司],高氯酸[分析纯,默克化工技术(上海)有限公司],双氧水(分析纯,天津市科密欧化学试剂有限公司);氯化镁、醋酸钠、盐酸羟胺、醋酸铵、醋酸,均为分析纯,均购自成都市科隆化学品有限公司;镉标准储备液(1 000μg/mL,国家有色金属及电子材料分析测试中心),内标液[Bi、Ge、In、6Li、Sc、Tb、Y,10μg/mL,美国Perkin Elmer公司],实验用去离子水 (电阻率18.25 MΩ·cm,成都艾柯超纯水机)。
(三)测定方法土壤样品测定pH、Cd全量和5种形态Cd含量,蔬菜样品测定总Cd。土壤pH依据NY/T 1377—2007《土壤pH的测定》的方法测定。土壤Cd全量采用GB/T 17141—1997《土壤质量 铅、镉的测定 石墨炉原子吸收分光光度法》的方法测定。Cd土壤形态分析采用Tessier五步提取法[5]。蔬菜中镉含量的测定依据GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》。土壤Cd全量、蔬菜Cd检测分别用中国地质科学研究院地球物理地球化学勘查研究所研制的成分分析标准物质GBW07408(GSS—8)(土壤)、GBW10014(GSB—5)(圆白菜)和GBW10015(GSB—6)(菠菜)进行质控。
(四)评价公式
1.生物活性系数(K)和迁移系数(M)。K、M计算方法分别见公式(1)、公式(2)[17]。

公式 (1)、公式 (2)中,F1为可交换态;F2为碳酸盐结合态;F3为铁锰氧化物结合态;F4为有机物结合态;F5为残渣态。
2.富集系数(BCF)。BCF计算方法见公式 (3)[19]。

公式(3)中,Cv为蔬菜中镉的含量,单位为mg/kg;Cs为土壤中镉的含量,单位为mg/kg。
(五)数据处理与分析数据统计分析和绘图采用Microsoft Excel 2010。
二、结果与分析
(一)土壤酸碱度特征按照NY/T 1377—2007测定110个土壤样品的pH。结果显示,土壤pH范围在3.9~7.3之间,平均值为5.6,中位值为5.5,标准偏差为0.85,中位值和平均值差距不大,说明土壤样品pH成正态分布。对数据进一步分析可知,土壤总体属酸性,其中极强酸性、强酸性、酸性和中性所占比例分别为10.0%、39.1%、32.7%、18.2%,总体变异系数为15.1%,属于中等变异程度。
(二)土壤中Cd含量
1.土壤中Cd全量特征。按照GB 15618—2018对土壤Cd污染进行筛选和分类,结果见表1。由表1可知,研究区域土壤Cd含量最小值为0.077 mg/kg,最大值为2.77 mg/kg,平均值为0.384 mg/kg,变异系数为103.0%,土壤中Cd含量变异程度大;Cd污染安全范围、风险筛选范围、管制范围分别占57.3%、40.9%、1.8%,存在较为严重的镉污染风险。

表1 土壤中Cd全量统计
2.土壤中Cd形态分布特征。研究区域土壤中Cd形态分布结果见表2,可以得出,可交换态、碳酸盐结合态、铁锰氧化物结合态、有机物结合态、残渣态平均含量分别为0.133、0.054 4、0.123、0.015 1、0.055 2 mg/kg,各形态含量变异系数在49.1%~178.4%区间内,表现为碳酸盐结合态>铁锰氧化物结合态>可交换态>有机物结合态>残渣态,属于高强度变异,空间差异性大。

表2 土壤Cd形态分析结果
研究区域土壤中Cd各形态含量占比差异大,可交换态占比为7.8%~57.0%、碳酸盐结合态占比为1.2%~31.1%、铁锰氧化物结合态占比为13.3%~45.3%、有机物结合态占比为1.9%~12.7%、残渣态占比为0~57.5%。Cd各形态的平均含量占比情况为可交换态>铁锰氧化物结合态>残渣态>碳酸盐结合态>有机物结合态,Cd主要以可交换态、铁锰氧化物结合态、残渣态的形态存在。
3.土壤中Cd各形态含量与Cd全量的关系。通过Cd各形态含量与Cd全量的显著性分析得出,可交换态、碳酸盐结合态、铁锰氧化物结合态、有机物结合态、残渣态含量与Cd全量均呈极显著差异性(p<0.01),其中可交换态、碳酸盐结合态、铁锰氧化物结合态、有机物结合态含量与Cd全量呈极显著正相关关系,相关系数(r)分别为0.95、0.89、0.98、0.88;残渣态含量与Cd全量相关性不显著,相关系数(r)为0.27(见图1)。

图1 Cd各形态含量与土壤Cd全量的关系
4.Cd形态占比及生物活性系数与土壤pH的关联性。通过各形态含量占比与土壤pH的显著性分析可知,可交换态、有机物结合态和残渣态含量占比与土壤pH呈极显著差异性(p<0.01)且为负相关关系,相关系数 (r)分别为—0.32、—0.35、—0.27;碳酸盐结合态和铁锰氧化物结合态含量占比与土壤pH呈极显著差异性(p<0.01)且为正相关关系,相关系数(r)分别为0.75、0.38,尤其是碳酸盐结合态影响显著(见图2)。经分析,生物活性系数(K)平均值为42.0%,存在较高的不稳定性或活性,但生物活性系数(K)受土壤pH影响小(r=0.12);迁移系数(M)(同可交换态含量相对于总量Cd的占比)随土壤pH增大而降低,呈负相关,表明Cd元素随土壤pH增大其迁移能力降低,存在形态向碳酸盐结合态转化的可能。
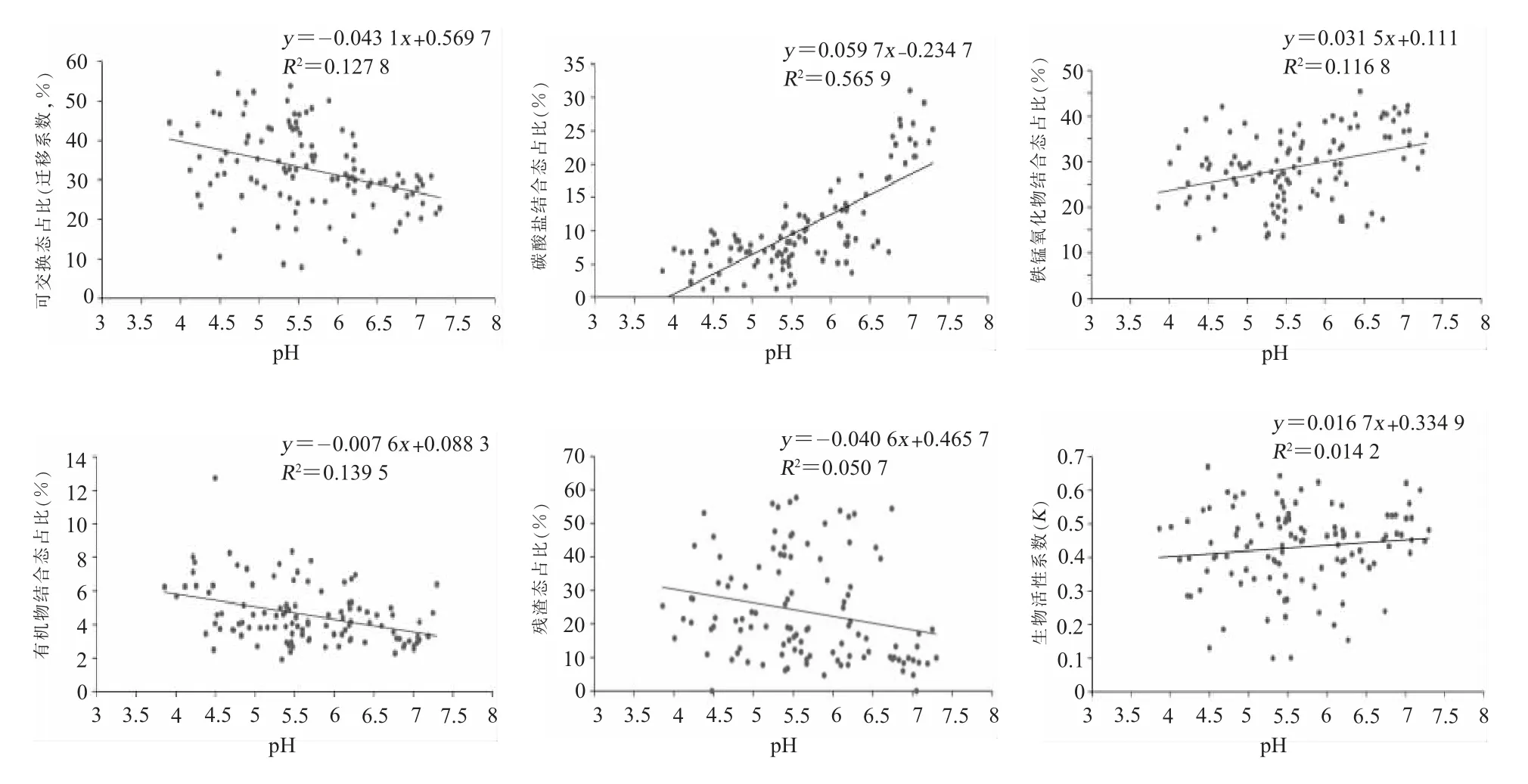
图2 Cd各形态占比及生物活性系数与土壤pH的关联情况
(三)蔬菜中Cd含量及安全性评价
1.蔬菜中Cd含量特征。在110个采样单元中共抽取122个蔬菜样品,对其进行Cd总量测定,结果见表3。由表3可知,Cd含量范围在ND~0.064 4 mg/kg之间,平均值为0.012 0 mg/kg,按照GB 2762—2017判定合格数121个,合格率99.2%,不合格数1个,不合格率0.8%,不合格产品为辣椒。茄果类产品平均Cd含量高于豆类和瓜类产品。各蔬菜中Cd含量变异系数范围在68.6%~245.0%,呈强变异程度,说明受土壤pH、Cd含量、迁移系数等因素的影响,产品中积累富集的空间性差异大。
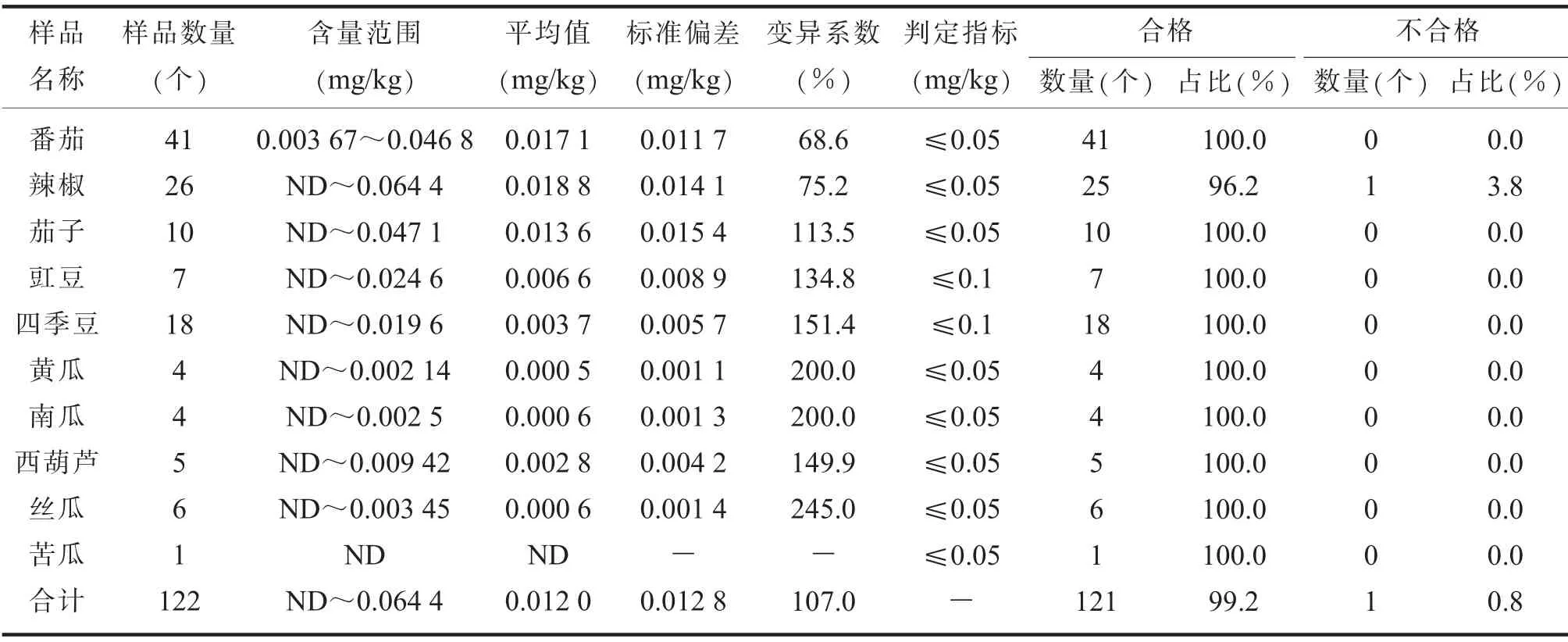
表3 蔬菜中Cd含量及判定情况
2.蔬菜对Cd元素的富集特征。各类蔬菜富集系数(BCF)计算结果见表4。由表4可知,各类蔬菜富集系数范围在0.001 26~0.339之间,平均值为0.041 7,变异系数107.1%。不同品种对Cd的富集程度不一样,且富集程度差异显著,番茄对Cd的平均富集能力是黄瓜的17.6倍。
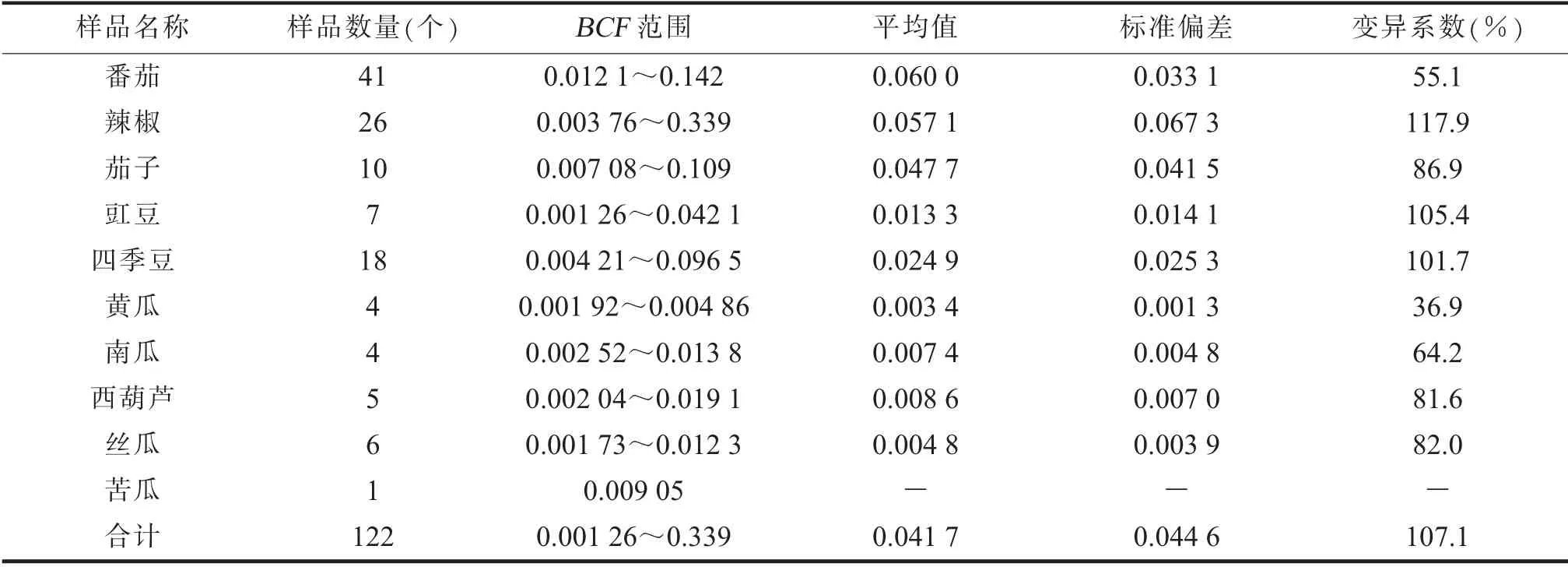
表4 不同类别品种蔬菜Cd的富集系数(BCF)
茄果类、豆类、瓜类蔬菜对Cd的富集系数与土壤pH呈极显著差异性(p<0.01)且为负相关关系,相关系数 (r)分别为—0.53、—0.35、—0.15(见图3)。通过分析蔬菜Cd含量与土壤Cd、有效Cd、可交换态Cd含量之间的相关性,得到茄果类、豆类、瓜类蔬菜Cd含量与土壤Cd相关系数(r)分别为0.55、0.28、0.17,与有效Cd相关系数(r)分别为0.58、0.24、0.10,与可交换态Cd相关系数(r)分别为0.66、0.38、0.09,其中茄果类和豆类蔬菜Cd含量与可交换态Cd含量的相关系数最大,说明可交换态Cd是影响豆类和茄果类蔬菜Cd含量的主要因素;瓜类蔬菜Cd含量与土壤Cd含量的相关系数最大,说明土壤中Cd含量是影响瓜类蔬菜Cd含量的主要因素。

图3 各类蔬菜Cd富集系数与土壤pH的关系
三、讨论与结论
(一)讨论
1.调查区域土壤样品中分别有40.9%、1.8%的样品在风险筛选范围和管制范围,存在较为严重的Cd污染风险。该区域的大背景是矿产资源丰富,因而土壤中重金属元素含量较为丰富,加之该区域农耕历史悠久,是重要的南菜北调基地,在蔬菜种植过程中长期使用化肥和农药,从而加重了土壤中Cd含量的积累[22~23]。该区域土壤中Cd含量变异系数为103.0%,变异程度大,说明受土壤质地、pH、阳离子交换量、有机质、微生物等影响大[24]。井永苹等[25]对不同种植年限设施菜地土壤重金属超标问题研究表明,随种植年限的增长,Cd累积量增加。该区域以小农户自主生产为主,对土地的使用和管理较为粗放,缺乏标准化生产,因人为用肥、用药、对土地的利用率等因素造成土壤中Cd含量的差异是存在的。
2.调查区域土壤Cd形态中可交换态、碳酸盐结合态、铁锰氧化物结合态、有机物结合态的含量受土壤Cd全量影响大,残渣态的含量受土壤Cd全量影响不大,说明该区域受外源Cd污染,Cd易于转化为具有活性的形态,将会对植物造成更大的影响,此情况符合关天霞等[24]查阅大量文献得出的结论。可交换态、有机物结合态、残渣态占比与土壤pH呈负相关,碳酸盐结合态和铁锰氧化物结合态占比与土壤pH呈正相关。颜世红[26]和刘佳丽等[27]通过人工模拟试验得出结论,土壤pH越低时,碳酸盐结合态Cd和铁锰氧化物结合态Cd极易向可交换态Cd转化,使可交换态Cd的含量增加。该区域土壤呈酸性,随土壤pH降低,碳酸盐结合态Cd和铁锰氧化物结合态Cd占比降低,可交换态Cd和有机物结合态Cd占比增加,与上述学者试验结论一致。通过分析生物活性系数(K)和迁移系数(M)与土壤pH的关系发现,土壤中Cd元素的生物活性系数(K)受土壤pH影响不大。从崔妍等[28]的分析来看,碳酸盐结合态重金属对pH敏感,当土壤pH升高时会使重金属形成碳酸盐沉淀,反之,当土壤pH下降时重金属易重新释放出来进入环境,因此,在可交换态与土壤pH呈负相关、碳酸盐结合态与土壤pH呈正相关的共同影响下,生物活性系数(K)基本维持稳定而迁移系数(M)与土壤pH呈负相关。所以,要降低该区域土壤Cd的生物有效性,可通过提高土壤pH的方法进行治理。
3.调查区域蔬菜Cd含量合格率达99.2%,安全性高,说明土壤存在Cd污染风险并不能简单据此判定会对蔬菜质量安全造成影响。汪婷等[29]对攀西某芒果产区土壤重金属污染情况进行研究发现,研究区域土样中Cd超标率达100%,而芒果果肉中未富集。毕华等[19]对广州市2个区农村菜地土壤与蔬菜Cd污染的相关性研究和谢薇等[21]对天津蔬菜主产区土壤中Cd的研究也表明,土壤Cd有超标而农作物中Cd并不超标。本文通过分析各类蔬菜对Cd元素的富集能力发现,茄果类比豆类和瓜类更容易积累富集Cd元素,这与杨定清[23]对攀西地区主要蔬菜水果基地重金属含量研究结果一致。土壤pH会对各类蔬菜富集Cd产生影响,各类蔬菜对Cd元素的富集能力与土壤pH呈负相关,可交换态Cd是影响豆类和茄果类蔬菜中Cd含量的主控因素,防止土壤酸化可降低Cd的迁移能力,减少各类蔬菜对Cd的富集作用,这与前面土壤pH影响Cd存在形态而造成迁移性影响的分析结论是一致的。
4.受成土过程及土壤质地、有机质含量、pH、氧化还原电位等环境条件的影响和制约,重金属会以多种形态存在,加之我国地域广阔,土壤类型多样,不同类型土壤对重金属的环境容量有显著差异,而土壤—作物系统中重金属迁移又是一个十分复杂的过程,除受土壤中重金属含量、形态及环境条件的影响外,不同类型农作物吸收重金属元素的生理生化机制也不同,因而各类作物有不同吸收和富集重金属的特征[1,24,30]。因此,评价土壤Cd污染是否对蔬菜安全性造成影响,应保持客观科学的态度。
(二)结论通过对调查区域土壤中Cd和同点位蔬菜Cd含量的协同分析发现,该区域土壤酸化严重,大大提高了土壤中Cd的生物有效性,同时发现,蔬菜对Cd的富集能力与土壤pH呈负相关,通过改良土壤的酸碱平衡有助于保障蔬菜的质量安全。调查区域土壤受到严重的Cd污染,但蔬菜Cd安全性高,说明蔬菜对Cd的吸收和积累受土壤环境复杂因素的综合影响,降低了蔬菜的富集能力。土壤中Cd与植物系统的迁移转化规律是十分复杂的生化过程,其作用机理和机制还需要更加深层次的研究,也需对重金属的特征毒性因子的检测技术进行开发,为科学评价土壤污染及对农产品安全的影响提供更加有力的科学支撑。

