超声波辅助提取骆驼皮胶原蛋白的工艺及结构表征
史 睿, 何 静, 吉日木图,2*
(1 内蒙古农业大学 乳品生物技术与工程教育部重点实验室 呼和浩特010018 2 内蒙古骆驼研究院 内蒙古阿拉善750306)
胶原蛋白是动物体内丰富的蛋白质之一,在所有脊椎动物和无脊椎动物的细胞外基质中起着关键作用,其自身组装成横纹原纤维,为细胞生长提供支持,并影响结缔组织的机械弹性[1-2]。胶原蛋白主要存在于动物的皮、骨、软骨及肌腱等结缔组织中,约占动物总蛋白的30%[3]。 它被广泛用于食品、化妆品(皮肤植入物)、生物医学及细胞培养等多个领域[1,4-7]。胶原蛋白作为一种安全的有效成分应用于产品加工中, 可以从肉类加工行业的原材料中有效回收[8]。
内蒙古自地区拥有丰富的骆驼资源, 然而牧区交通不便且条件有限,牧民屠宰骆驼后,只注重食肉, 许多骆驼皮被弃置, 未能充分发挥皮张价值。 研究表明,骆驼皮的脂腺远不如猪皮发达,也比牛皮弱,骆驼皮中油脂含量低于猪皮、牛皮[9],可将骆驼皮作为提取胶原蛋白的优质原料。通常,将富含胶原纤维的皮肤或肌腱等组织通过中性盐、酸、碱和蛋白酶处理来提取胶原蛋白,相比之下,在0.5 mol/L 乙酸中使用胃蛋白酶提取胶原蛋白可以获得更高的产量。 虽然在酶的作用下胶原蛋白的端肽被水解切割, 但是其三螺旋结构基本保持完整[10-11]。 这些常规的提取方法效率不高,且在提取过程中会造成大量的胶原组织残留物[12]。 目前,低强度的超声波作为一种非破坏性[13]、安全高效的辅助提取方式被广泛应用在食品加工、 蛋白质等物质的提取及改性中[14]。 本试验通过低强度超声波辅助的方式,从骆驼皮中提取胶原蛋白,促进骆驼源胶原蛋白的工业化生产, 增加骆驼副产品的附加值。
1 材料与方法
1.1 材料与试剂
骆驼皮,内蒙古骆驼研究院。
胃蛋白酶(1∶10 000),北京索莱宝科技有限公司;中性蛋白酶(1398),山东龙元生物工程有限公司;羟脯胺酸(碱水法)试剂盒,南京建成生物工程研究所;其它主要试剂均为分析纯级。
1.2 仪器与设备
JY 88-IIN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;JJ-2 型组织捣碎机,常州赛普实验仪器厂;XK78-2 型磁力加热搅拌器, 江苏新康医疗器械有限公司;LAMBDA 365 紫外-可见分光光度计,PerkinElmer 股份有限公司;Thermo Scientific Nicolet iS10 傅里叶变换红外光谱仪,赛默飞世尔科技公司;TM4000 台式扫描电子显微镜,日立高新技术公司;Zetasizer Nano ZS90 纳米粒度电位仪,英国马尔文仪器有限公司。
1.3 方法
1.3.1 胶原蛋白含量的测定 参照朱敏[15]的方法,使用羟脯胺酸(碱水法)试剂盒测定羟脯氨酸质量分数。 胶原蛋白质量分数(%)=羟脯氨酸质量分数×7.1。
通常,羟脯氨酸占胶原蛋白干重的14%左右,然而组织来源、部位甚至测定方法的不同,其含量也会随改变,如在软骨中约占10%左右。人们常用11.1 作为水生动物换算系数, 陆生动物则多采用7.1[16]。
1.3.2 胶原蛋白提取率的计算 胶原蛋白的提取率按下式计算:
1.3.3 提取工艺流程 骆驼皮→修剪、 浸泡→去毛→脱脂→去除盐溶性非胶原成分→超声波辅助提取→盐析、纯化→冷冻干燥
1.3.4 骆驼皮的预处理
1) 浸泡 冷冻的骆驼皮在4 ℃解冻后,用蒸馏水冲洗干净。 将骆驼皮切分为5 cm×5 cm 块状,盆中加入0.5% Na2CO3浸泡数小时后, 蒸馏水洗净备用。
2) 去毛 浸泡后的原料皮中加入不同质量浓度(2,4,6,8,10 mg/mL)的1398 中性蛋白酶,温度控制在25 ℃,保温去毛4 h,根据去毛效果选择最优去毛工艺。
3) 脱脂 将脱毛后的骆驼皮切分为0.5 cm×0.5 cm 小块, 称取适量样品按料液比1∶10 加入5% Na2CO3,搅拌脱脂18 h,蒸馏水洗净。
4) 去除盐溶性非胶原成分 脱脂后的原料按料液比1∶10 加入2% NaCl 搅拌18 h,蒸馏水洗净。
以上操作均在低温下进行, 将预处理后的骆驼皮储存在-20 ℃备用。
1.3.5 匀浆液的制备 称取一定质量预处理后的骆驼皮加入适量蒸馏水, 使用组织捣碎机间隙工作,控制物料温度不超过25 ℃,捣碎后离心去除多余水分。 将捣碎后样品加入到0.5 mol/L 乙酸介质中,料液比为1∶10,继续使用组织捣碎机匀浆,使其充分混匀搅碎。
1.3.6 超声波辅助提取骆驼皮胶原蛋白 将胃蛋白酶溶解于0.5 mol/L 乙酸溶液中,称取一定质量的上述匀浆液,二者混匀后进行超声波处理,搅拌提取48 h 后,于8 000 r/min 离心20 min,分离上清液和沉淀,保留上清液,得到骆驼皮胶原蛋白提取液。 所有操作,均在低温下进行。
1.3.7 胶原蛋白的盐析纯化 在提取液中加Na-Cl 至浓度为0.9 mol/L 后盐析24 h,10 000 r/min离心10 min,沉淀加入0.5 mol/L 乙酸溶液,搅拌充分溶解。 完全溶解后用0.1 mol/L 乙酸透析24 h,再用蒸馏水透析24 h,经冷冻干燥得到超声波辅助提取的骆驼皮胶原蛋白(UPSC)。 所有操作,均在低温下进行。
1.3.8 超声波辅助提取骆驼皮胶原蛋白工艺的优化
1.3.8.1 单因素实验 在前期试验的基础上,固定酶添加量4%、料液比1∶20、超声波处理时间20 min、超声波功率200 W、总提取时间48 h 条件,分别考察酶添加量(0.5%,1.0%,2%,4%,8%)、料液比(1∶5,1∶10,1∶20,1∶30,1:40)、 超声波处理时间(5,10,15,20,25,30 min)、 超声波功率(50,100,150,200,250 W) 及总提取时间(12,24,36,48,60 h)对骆驼皮胶原蛋白提取率的影响。1.3.8.2 响应面优化试验 在单因素实验结果的基础上, 依据Box-Behnken 中心组合试验设计原理,以胶原蛋白提取率为响应值,选取酶添加量、料液比、 超声波处理时间和总提取时间4 个影响显著的因素,进行四因素三水平的组合试验,使用DesignExpert 8.0.6.1 软件进行响应面分析。 因素水平及编码见表1。

表1 骆驼皮胶原蛋白提取试验因素及水平Table 1 Factors and levels of collagen extraction from camel skin
1.3.9 胶原蛋白的结构表征
1.3.9.1 SDS-PAGE 凝胶电泳分析 利用SDSPAGE 凝胶电泳分析法分析UPSC, 采用5%浓缩胶和8%分离胶体系进行电泳分离, 用0.5 mol/L乙酸将样品配置成0.5 mg/mL 的胶原蛋白溶液,上样量为5 μL。 分别采用浓缩胶电压80 V、分离胶电压100 V 进行电泳。 电泳结束后,用考马斯亮蓝R-250 染色胶片, 并用乙醇-乙酸脱色液进行脱色,最后使用凝胶成像仪观察分析。
1.3.9.2 紫外光谱分析 将提取得到的UPSC 置于0.5 mol/L 乙酸溶液中, 配制成0.5 mg/mL 的溶液, 稀释10 倍后利用紫外-可见分光光度计上机测试,在200~400 nm 近紫外光区对胶原蛋白溶液进行扫描。
1.3.9.3 傅里叶变换红外光谱分析 分别称取适量UPSC 冻干样品与KBr 按一定的比例混合研磨,置于压片机上压片,使用傅里叶变换红外光谱仪在4 000~500 cm-1波数范围对样品进行扫描测定,分辨率为2 cm-1。
1.3.9.4 扫描电子显微镜观察 将UPSC 剪成小块,固定在载物片上,然后用扫描电子显微镜观察其形态特性。 使用10 kV 的加速电压,以200×倍的倍率采集图像。
1.3.9.5 Zeta 电位测定 将UPSC 用0.5 mol/L 乙酸溶解,低温下搅拌6 h,使其最终质量浓度为0.5 mg/mL。 用1 mol/L 的HCl 和1 mol/L 的NaOH 调节pH,分别测定不同pH 值(2~9)下UPSC 的Zeta电位。
2 结果与分析
2.1 不同质量浓度的中性蛋白酶(1398)对去毛效果的影响
不同质量浓度的中性蛋白酶(1398)对骆驼皮的去毛效果不同。从图1 中可以看出,使用质量浓度为2 mg/mL 中性蛋白酶处理骆驼皮, 去毛效果较差,有些区域不能完全将毛去除干净;酶的质量浓度4~6 mg/mL 范围可达到较好的去毛效果,使用6 mg/mL 酶处理后的皮张色泽较白, 皮质较为柔软。 研究表明,酶可以使皮的内容物溶解出来,改变皮表面的折光性能,使颜色变白,同时,酶具有松散胶原纤维的作用,使皮张变得柔软[17]。 随着酶质量浓度的增加,皮质发生变化,使用质量浓度为8 mg/mL 的中性蛋白酶处理时, 局部区域颜色开始变黄且毛孔粗大,使用10 mg/mL 蛋白酶处理后,皮质过度松软,颜色发黄,胶原纤维被高浓度的酶破坏, 所以选择6 mg/mL 的酶质量浓度以达到最佳去毛效果。

图1 不同质量浓度的中性蛋白酶(1398)对骆驼皮去毛效果的影响Fig.1 The effects of different mass concentrations of neutral protease (1398) on the hair removal of camel skin
2.2 超声波辅助提取骆驼皮胶原蛋白的单因素实验
2.2.1 酶添加量对骆驼皮胶原蛋白提取率的影响
由图2 可知,随着酶添加量的增加,提取率随之升高。当酶量增加时,更多的底物可以与酶充分结合,增加提取率。当酶添加量为4%时,此时提取率为(42.05±2.42)%,达到最高水平。 当酶量继续增大时,酶对胶原蛋白非螺旋区域的反应过度,使其组织结构遭到破坏,导致胶原蛋白浓度下降,提取率降低。 因此,初步确定最佳酶添加量为4%。

图2 酶添加量对提取率的影响Fig.2 Effects of enzyme addition amount on extraction rate
2.2.2 料液比对骆驼皮胶原蛋白提取率的影响图3 表明,随着液料比的增大,提取率呈先增加后降低趋势。当料液比较小时,预处理后的原料在乙酸溶液中会发生溶胀现象,导致体系中黏度较高,酶与底物不能充分结合, 且不利于超声波空化作用的传导[18],影响酶解进程,使提取率较低。 增加乙酸溶液的体积,降低了体系的黏度,超声波可充分发挥空化作用且震动强度增加,打散胶原纤维,有利于更多胶原蛋白的溶出,从而使提取率增高。同时,各体系中酶制剂用量是相同的,料液比增加会使酶浓度降低,可以酶解的骆驼皮的质量有限,导致提取率逐渐下降。因此,确定最适液料比为1∶20,此时提取率可达(42.02±2.78)%。

图3 料液比对提取率的影响Fig.3 Effects of solid-liquid ratio on extraction rate
2.2.3 超声波处理时间对骆驼皮胶原蛋白提取率的影响 由图4 可知, 胶原蛋白提取率呈先增加后降低的趋势。 超声时间在5~25 min 内胶原蛋白的提取率显著增加,说明超声波可增加提取率,缩短提取时间,在超声波处理20 min 时提取率达到最大,此时原料中胶原蛋白基本溶出;然而随着超声波处理时间加长, 其产生的空化效应和机械作用增强,在局部的高温高压作用下,会加速提取到的胶原蛋白发生降解[19],破坏胶原蛋白结构,使得提取率开始下降。因此,初步选择超声波处理时间为15~25 min。
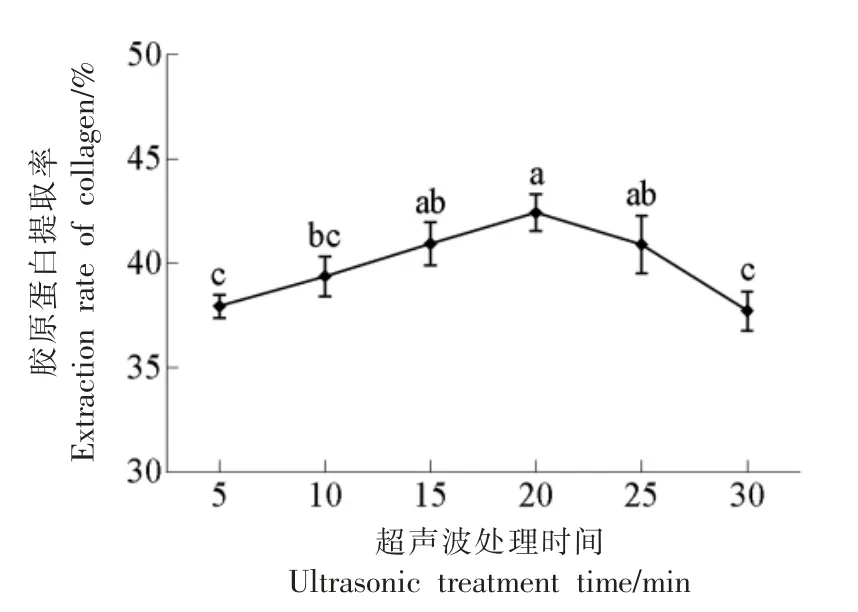
图4 超声波处理时间对提取率的影响Fig.4 Effects of ultrasonic treatment time on extraction rate
2.2.4 超声波功率对骆驼皮胶原蛋白提取率的影响 由图5 可知, 在料液比为1∶20, 超声波处理20 min,总提取时间48 h 的条件下,随着超声功率的提高整体提取率先上升, 功率达到200 W 时胶原蛋白提取率最高, 骆驼皮中的胶原蛋白大部分已溶出,随着超声波功率的增加,胶原蛋白提取率呈平稳趋势,变化不显著。 有研究表明,当超声波功率过大时,会增加散射衰减,形成声屏障,影响提取效果[19]。 因此,为避免过分超声处理影响胶原蛋白的组织结构, 选择200 W 为提取胶原蛋白的最优超声波功率。
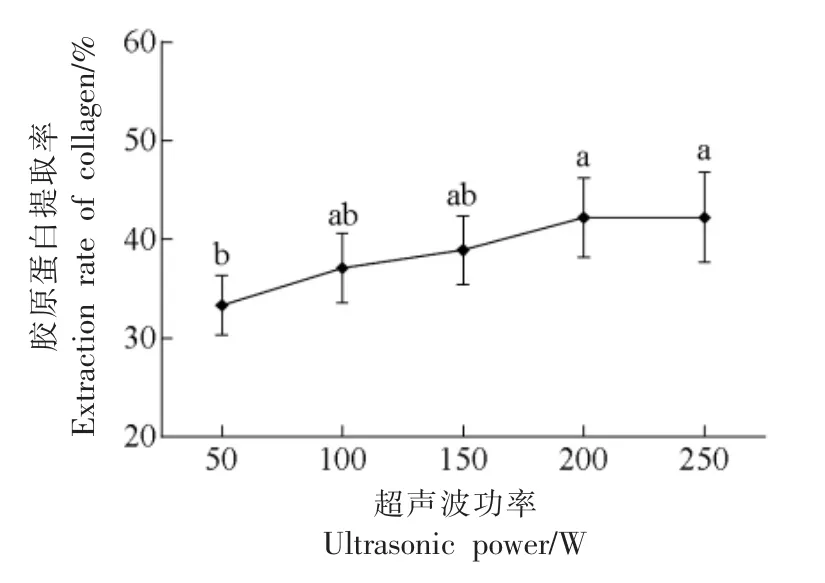
图5 超声波功率对提取率的影响Fig.5 Effects of ultrasonic power on extraction rate
超声波产生的微声流能加快传质扩散, 产生空化、震荡效应,活化酶分子构象及催化部位[20]。然而超声波处理的一个主要缺点是其产生的空化效应会在介质内部引起高温、 高剪切力以及高压[21],同时它还可以破坏多肽链上的氢键和范德华相互作用,导致蛋白质或酶发生变性[12]。 本试验采用冰浴的方式来消除热效应, 并选择适当的超声波功率及处理时间, 在保正其完整结构及生理活性的基础上, 以温和的超声波辅助方式高效提取胶原蛋白。2.2.5 总提取时间对骆驼皮胶原蛋白提取率的影响 图6 表明,随着总提取时间的增加,胶原蛋白的提取率呈先升高后降低的趋势。 胶原蛋白溶出的过程是固体溶质向溶剂传递的过程[22],在其二者未达平衡前,随着提取时间的延长,胃蛋白酶促使胶原蛋白不断释放到提取液中, 提取率逐渐增加。 在48 h 处, 胶原蛋白提取率达最高值为(42.48±1.35)%。 然而着时间的继续增加,其有下降趋势,部分胶原蛋白发生了水解,使得提取率下降。 综上,初步选择酶提取时间为36~60 h。
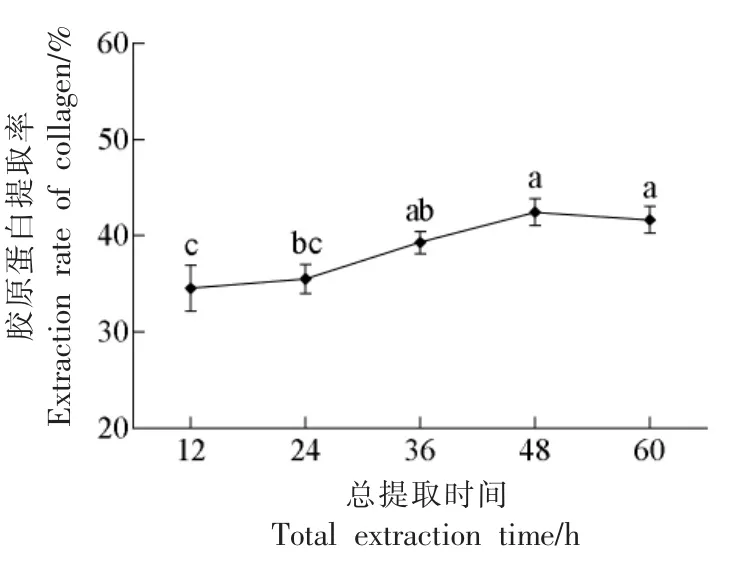
图6 总提取时间对提取率的影响Fig.6 Effects of total extraction time on extraction rate
2.3 响应曲面法对超声波辅助提取骆驼皮胶原蛋白工艺的优化
在单因素实验的基础上, 根据Box-Behnken原理,以骆驼皮胶原蛋白提取率为响应值,设计四因素三水平响应曲面分析试验, 使用DesignExpert8.0.6.1 软件进行数据分析。表2 为骆驼皮胶原蛋白提取工艺响应曲面试验设计及结果。
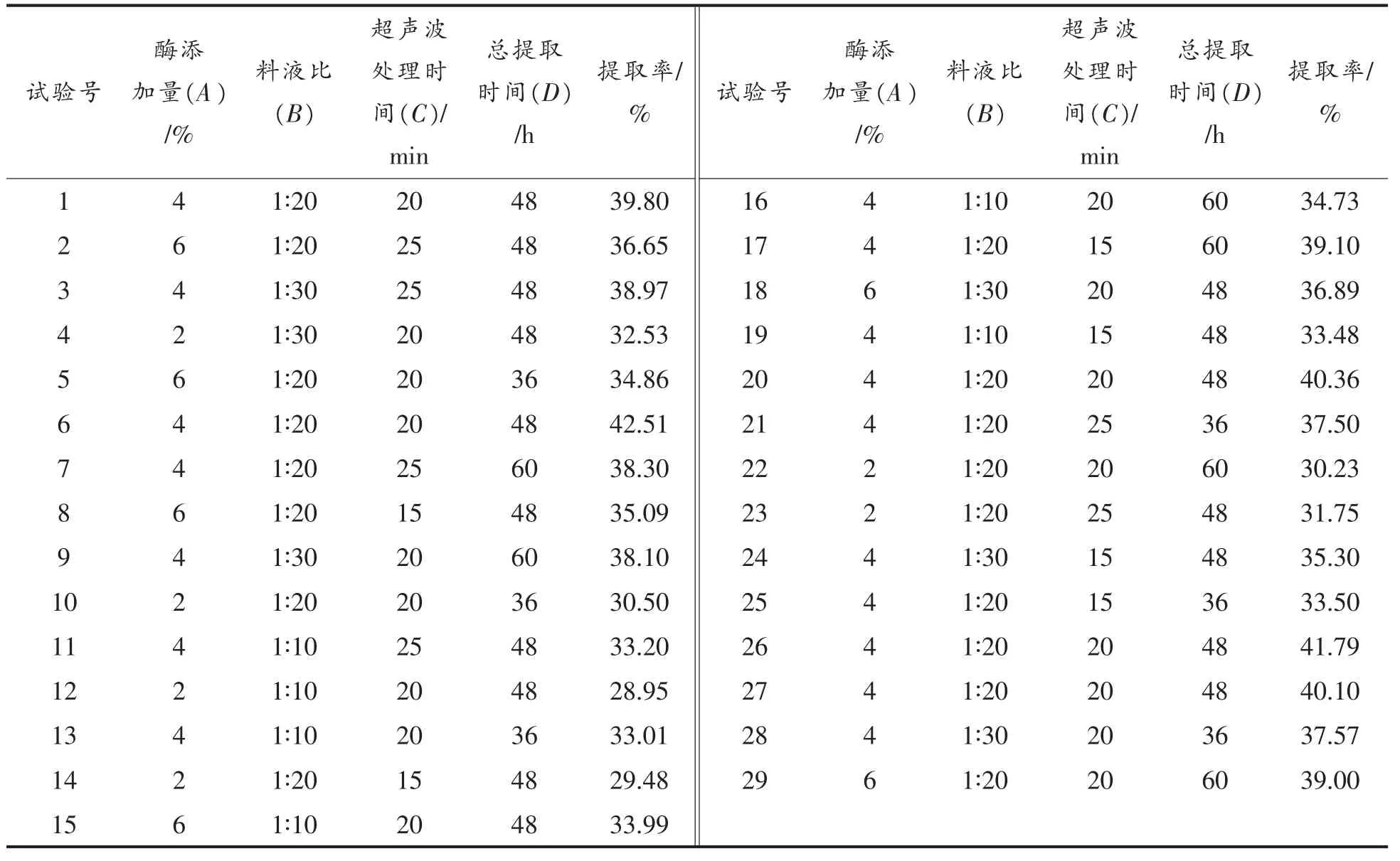
表2 骆驼皮胶原蛋白提取工艺响应曲面试验设计及结果Table 2 Experimental design and results of collagen extraction from camel skin for response surface analysis
2.3.1 回归模型的方差分析 通过对响应曲面试验结果进行拟合回归分析, 得到骆驼皮胶原蛋白提取率与各因素变量的二次多项回归方程为:y=40.91+2.75A+1.83B+0.87C+1.04D-0.17AB-0.18AC+1.10AD+0.99BC-0.30BD-1.20CD-5.16A2-3.06B2-2.36C2-1.85D2。
对二次多项回归模型进行方差分析, 结果如表3 所示。 模型F=32.01,P<0.0001,意味该回归模型显著性极高,具有统计学意义,可以用模型分析预测骆驼皮胶原蛋白提取率的结果。 失拟项F=0.46,P=0.8557>0.05,失拟项不显著,可用该回归方程代替试验真实点对试验结果进行分析。 决定系数R2=0.9697,校正决定系数R2Adj=0.9394,说明回归模型与实际试验拟合程度较高, 可以模拟93.94%的响应值变化, 只有6.06%的变异不能由此模型解释,进一步说明模型拟合程度较好,能够用于骆驼皮胶原蛋白提取率的理论预测。
根据表3 可知, 模型中A、B、C、D、A2、B2、C2、D2对响应值影响极显著(P<0.01),AD、BC、CD 对响应值影响显著(P<0.05)。F 检验可以反映回归模型的有效性,F 值越大,说明此因素对胶原蛋白提取率的影响越显著[19],因此,4 个因素对胶原蛋白提取率的影响顺序为:酶添加量(A)>料液比(B)>总提取时间(D)>超声波提取时间(C)。
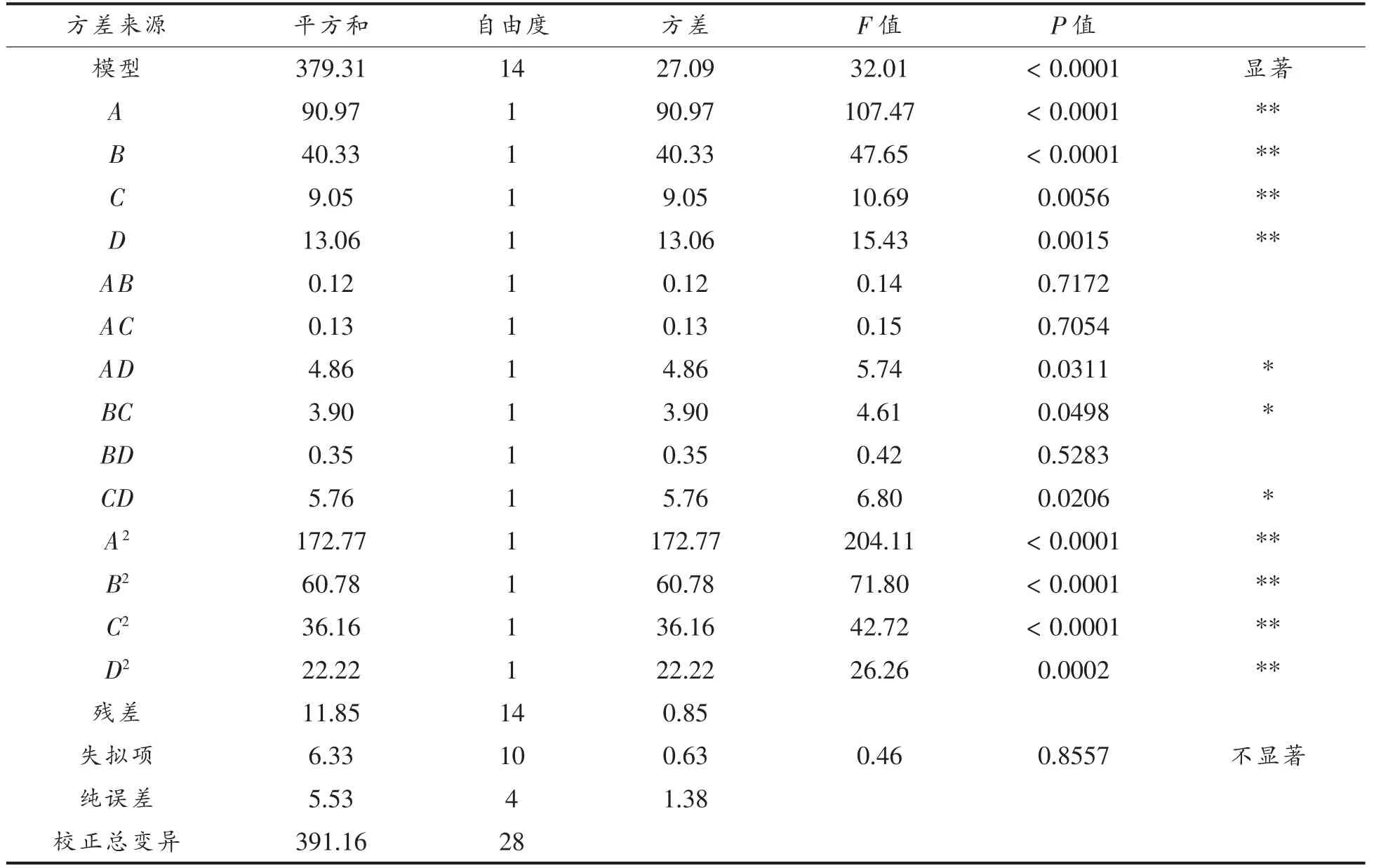
表3 回归方程方差分析Table 3 Analysis of variance for the regression model
2.3.2 过程变量的交互作用 图7 中的响应曲面图和等高线图直观反映了酶添加量(A)、 料液比(B)、超声波提取时间(C)及总提取时间(D)各因素间的交互作用对骆驼皮胶原蛋白提取率的影响。
通过观察图7 中各响应曲面的陡峭程度及等高线图的疏密程度, 可以看出4 个因素中酶添加量与总提取时间、料液比与超声波提取时间、超声波提取时间与总提取时间的交互作用显著, 对胶原蛋白提取率的影响较大, 其它因素间的交互作用不显著,这与方差分析的结果一致。

图7 过程变量的响应曲面图Fig.7 Response surface diagram of process variables
2.3.3 最优提取条件的确定与验证 通过模型计算分析得到理论上的最佳提取条件为: 酶添加量4.58%、 料液比1∶23.03、 超声波提取时间20.81 min、总提取时间51.49 h,提取率可达(41.81±1.89)%。 考虑实际操作情况,将优化条件整合为:酶添加量4.5%、料液比1∶23、超声波处理时间20 min、总提取时间51 h,在此条件下进行3 次平行试验进行验证,得到胶原蛋白提取率为(41.99±1.57)%,与拟合模型的预测值接近,说明该模型合理,参数可靠,可以用来预测提取骆驼皮的最优工艺条件。
2.4 骆驼皮胶原蛋白SDS-PAGE 凝胶电泳分析结果
通过SDS-PAGE 凝胶电泳对UPSC 的分子质量进行测定,分析其亚基组成。如图8 所示,UPSC是由α 链(α1和α2)、β 链及γ 链组成。 在135 ku处有两条谱带,较粗的一条是由两条α1肽链重叠构成的,另一条是单条的α2肽链;在245 ku 处是α 链二聚体,即β 链;高于245 ku 处的条带是Ⅰ型胶原蛋白α 链的三聚体,即γ 链。 此结构与刘雯恩等[23]研究一致。 因此,可初步判断提取出的UPSC 为结构完整的Ⅰ型胶原蛋白。
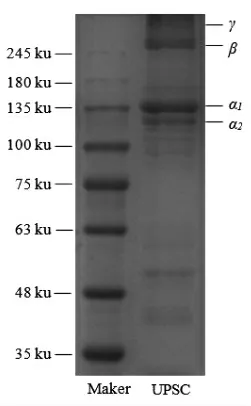
图8 骆驼皮胶原蛋白的SDS-PAGE 图谱Fig.8 SDS-PAGE patterns of collagen extracted from camel skin
2.5 骆驼皮胶原蛋白紫外光谱分析结果
胶原蛋白的近紫外吸收光谱可判断其酪氨酸含量和非螺旋端肽的完整性[18]。 图9 中UPSC的最大吸收峰在218 nm 处,与Lin 等[24]的研究结果一致, 这是由于C=O 的n→π* 跃迁所致。 同时,在280 nm 处无吸收峰出现,说明芳香族氨基酸含量较少,提取得到的胶原蛋白纯度较高[16]。

图9 骆驼皮胶原蛋白的紫外吸收光谱图Fig.9 Ultraviolet absorption spectrum of collagen extracted from camel skin
2.6 骆驼皮胶原蛋白傅里叶变换红外光谱分析结果
由图10 可知,UPSC 具有Ⅰ型胶原蛋白红外光谱特征吸收峰,即酰胺A、B 和酰胺Ⅰ、Ⅱ、Ⅲ。酰胺A 带主要是由N-H 键的伸缩振动引起,自由N-H 伸缩振动发生的范围是3 400~3 450 cm-1,然而当N-H 基团参与氢键形成时, 其振动频率会偏低,通常为3 300 cm-1左右[25]。 UPSC 的酰胺A 带在3 301.32 cm-1,说明UPSC 中有较多的NH 键参与肽链的形成。 在2 922.03 cm-1附近为酰胺B 带, 这是由-CH2基团的不对称伸缩振动产生的, 反映了酰胺A 与酰胺Ⅱ带之间的相互作用[26]。酰胺Ⅰ带的范围一般在1 625~1 690 cm-1之间, 酰胺Ⅱ带的范围一般在1 550~1 600 cm-1之间。 观察到UPSC 的酰胺I 带在1 630.46 cm-1左右,酰胺II 带在1 543.98 cm-1,移动到了更低的频率, 进一步说明胶原蛋白中氢键的存在。 在1 236.46 cm-1处存在的吸收峰是由N-H 键平面弯曲形成的酰胺Ⅲ带特征频率。 酰胺Ⅱ和酰胺Ⅲ带可确定胶原蛋白螺旋结构的存在。 综上,UPSC保有较完整的三螺旋结构。

图10 骆驼皮胶原蛋白的傅里叶红外光谱图Fig.10 Fourier transform infrared spectroscopy of collagen extracted from camel skin
2.7 骆驼皮胶原蛋白扫描电子显微镜观察结果
通过肉眼和扫描电子显微镜观察冻干后的UPSC,并对其形态进行分析。 图11a 为肉眼观察下的UPSC 形态,质轻且柔软,呈乳白色的海绵状态,表面可见有一定的孔隙;图11b 为扫描电子显微镜下UPSC 的微观结构, 更清楚的显示出大量多孔、疏松的横截面,呈现相互缠绕的卷曲状结构,由此表明UPSC 具有胶原的纤维特性[27]。

图11 骆驼皮胶原蛋白肉眼观察图(a)及扫描电子显微镜观察图(b)Fig.11 Camel skin collagen as viewed in naked eye (a)and SEM micrograph (b)
2.8 骆驼皮胶原蛋白Zeta 电位分析结果
胶原蛋白表面的净电荷数量会影响其稳定性,因此测定了不同pH 值(2~9)UPSC 的Zeta 电位值。 如图12 所示,UPSC 在pH 2~6.7 范围时带正电荷,在pH 6.7~9 范围时带负电荷。 蛋白质水溶液在其等电点(PI)处净电荷为零[28]。 由图可知UPSC 的等电点为6.7。
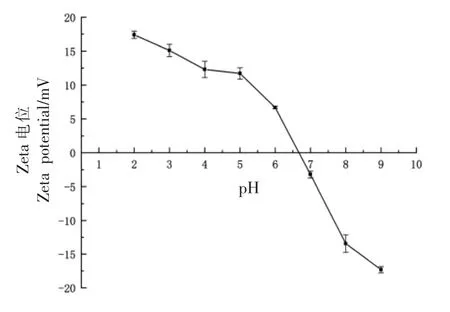
图12 不同pH 值下骆驼皮胶原蛋白Zeta 电位数据Fig.12 Zeta potential of collagen extracted from camel skin at different pH values
3 结论
为节约成本,提高提取效率,本试验采用超声波辅助法提取骆驼皮中的胶原蛋白, 确定了最优工艺: 使用质量浓度为6 mg/mL 的中性蛋白酶(1398)对骆驼皮进行去毛,将预处理后的骆驼皮进行单因素实验,确定提取超声波功率为200 W,在此基础上, 结合响应曲面分析法得到最佳提取条件为:酶添加量4.5%、料液比1∶23、超声波提取时间20 min、总提取时间51 h,胶原蛋白的实际提取率为(41.99±1.57)%,与模型预测拟合较好,证明该模型能够用于骆驼皮胶原蛋白提取率的理论预测。
从骆驼皮中提取到的胶原蛋白为I 型胶原蛋白,由α 链(α1和α2)、β 链及γ 链组成。 紫外光谱分析进一步推断UPSC 为典型I 型胶原蛋白,经红外光谱分析证实UPSC 具有完整的三螺旋结构,通过扫描电子显微镜观察到胶原纤维的存在。 同时测定UPSC 在pH 2~9 的Zeta 电位, 确定其等电点为6.7。

