木薯淀粉介导肠道菌群加剧小鼠肥胖症的机制
汪媛媛, 常海波, 张 增, 张家超
(海南大学食品科学与工程学院 海口570228)
淀粉是由葡萄糖分子聚合而成的高分子碳水化合物,是人类膳食中主要的组成部分,主要分为直链淀粉、支链淀粉和抗性淀粉三大类[1]。
木薯为世界三大薯类作物(木薯、甘薯、马铃薯)之一,是一种淀粉根作物,是热带、亚热带地区生活的人类日常膳食最主要能量来源, 其嫩茎叶富含优质的蛋白质, 具有很高的食用价值和工业利用价值[2-3]。 木薯富含淀粉,其块根含30%的淀粉,木薯干则含有70%的淀粉,普通木薯淀粉属于可消化淀粉,支链淀粉和直链淀粉含量比为4∶1[4]。淀粉组成中支链淀粉越高, 越易被人体消化吸收并引起胰岛素应答,更容易引发肥胖[5],而高直链淀粉消化速率慢,部分不被前端小肠消化,在后端小肠和大肠中消化吸收, 抗性淀粉不易被小肠消化吸收, 而能够在盲肠和结肠中被缓慢吸收利用[6]。 抗性淀粉能促进肠道益生菌的生长繁殖,如双歧杆菌、乳酸菌等[7]。 人体摄入抗性淀粉食物可减缓餐后血糖上升,增加脂质的排泄,从而减少机体对热量的吸收利用,同时可以维持饱腹感[8],有效控制体重。
动物肠道中存在着种类繁多、 数量庞大的微生物,它们相互制约、平衡共生,共同维持肠道环境的稳定[9]。肠道菌群在一定程度上也是人类的一个重要器官, 它在维持人体健康中发挥的作用远超人们的想象[10],为宿主提供自身不具备的反应酶和生化反应途径, 使机体可以消化吸收一些不能直接吸收利用的物质并产生正常生长所必需的营养物质,与人体的营养、免疫和代谢等息息相关[11]。
相比于抗性淀粉,木薯淀粉属于可消化淀粉,支链淀粉含量高达80%, 目前的研究多集中于对结构的解析, 对体外功能评价以及有益碳源的研究[12-13],有必要对潜在的有害支链淀粉进行基于肠道菌群的营养评估。本研究基于小鼠肥胖模型,采用16S rRNA 基因序列同源性分析技术分析小鼠血液中总胆固醇(TC)、甘油三酯(TG)以及免疫指标免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM),并分析肠道微生物菌群结构以及代谢通路的, 旨在研究摄入木薯淀粉对小鼠肠道菌群结构的影响, 也为以肠道菌群为靶点的人体肠道微生态平衡调控及宿主健康饮食提供理论依据。
1 材料与方法
1.1 主要材料
C57BL/6 小鼠采购自湖南斯莱克景达实验动物有限公司,均为4 周龄雄性,体重18~20 g,经过一周适应期后用于实验,饲喂温度为26 ℃,每天更换一次垫料。
基础饲料(玉米41%、麸皮26%、豆饼29%、食盐1%、骨粉1%、赖氨酸1%、其它1%)、高脂饲料(胆固醇1%、蛋黄粉10%、猪油10%、胆酸钠0.2%、基础饲料78.8%组成),所有的饲料均由湖南斯莱克景达实验动物有限公司提供。
木薯淀粉,上海枫未实业有限公司;测定血液总胆固醇(TC)试剂盒、测定血液甘油三酯(TG)试剂盒,北京索莱宝科技有限公司;测定小鼠免疫指标免疫球蛋白M(IgM)试剂盒、测定小鼠免疫指标免疫球蛋白A(IgA)试剂盒、测定小鼠免疫指标免疫球蛋白G(IgG)试剂盒,上海信裕生物科技有限公司。
1.2 仪器和设备
PCR 扩增仪,杭州朗基科学有限公司;凝胶成像分析系统,美国Cell Biosciences 公司;高速冷冻干燥机,Thermo Scientific 公 司;DYY-12 电 泳仪,北京市六一仪器厂;TGL-16G 高速离心机,上海安亭科学仪器厂。
1.3 方法
1.3.1 建立模型与实验样本分组 所有40 只小鼠平均分成4 组。 4 组分别为对照组、模型组和2个处理组。 对照组(Z): 饲喂基础饲料; 高脂组(G):饲喂高脂饲料;处理组1(MZ):饲喂基础饲料和木薯淀粉(含量10%)的混合饲料;处理组2(MG):饲喂高脂饲料和木薯淀粉(含量10%)的混合饲料。
1.3.2 观察指标
1) 一般情况 体质量;
2) 血液临床指标 总胆固醇(TC)、甘油三酯(TC);
3) 免疫指标检测 免疫球蛋白G (IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)。
1.3.3 实验小鼠血液及粪便收集 每日上午9 点对每组小鼠置换10 g 新的饲料和饮水,每7 d 对每组小鼠的体重进行称量并记录数据。 参考相关肥胖造模方法[14],试验周期为4 周,第2、4 周分别从各笼子中收集粪便,置于2 mL 样品管中,收集约1 g 粪便, 做好标签置于-40 ℃冰箱中保存,用于16S rRNA 测序。 第4 周饲养结束,对小鼠禁食12 h 后,眼球取血0.5~0.7 mL,常温放置1 h 后进行离心(2 500 r/min,10 min),吸取血清并保存于-80 ℃冰箱。
1.4 16S rRNA 高通量测序
采用CTAB 冻融法[15-17]提取菌株基因组DNA。 利用1.0%的琼脂糖凝胶电泳,100V 电压,0.5×TBE 电泳液中电泳15 min, 用Nanodrop 通过OD260/280比值检测DNA 的纯度并用Qubit 2.0 对DNA 浓度进行精确定量。提取的DNA 样品于-20℃保存。
扩增16s rRNA 的V3-V4 区, 引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[18-19]。 PCR 扩增体系(50 μL):基因 组DNA 模板(100 ng/μL)1.5 μL、引物(10 pmol/μL)各1.5 μL、2×Es Taq Master Mix(高纯度耐热DNA 聚合酶)扩增预混合液25 μL、ddH2O 20.5 μL。
反应参数:94 ℃预变性5 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min, 循环30次;72 ℃末端延伸10 min;4 ℃恒温保存。
PCR 扩增结束后, 取2 μL PCR 产物与2 μL 6×上样缓冲液混合均匀于1.0%琼脂糖凝胶中点样电泳(100 V,15 min),如在468 bp 附近观察到清晰的条带, 且无明显的特异性扩增, 表明PCR成功。 DNA 样品送于北京诺禾致源科技股份有限公司,采用Illumina HiSeq 平台进行测序。 下机后使用QIIME 工具包进行分析[20],根据97%的序列相似度将所有序列进行同源比对并聚类成可操作分类单元(Operational taxonomic units, OTUs)后与数据库Greengenes 进行比对以获得物种信息,基于微生物OTU 表进行PICRUSt 宏基因组功能预测[21],通过与KEGG 数据库比对得到二级和三级功能基因代谢通路的预测结果。
1.5 统计学分析方法
统计学分析使用R 软件进行。使用“ggplot”包进行PCoA 分析[22];热图的绘制使用“pheatmap”包绘制的;箱型图的绘制使用了“ggpubr”包[23];微生物菌属的含量以平均值±标准差表示, 采用Wilcoxon 检验和Kruskal-Wallis 检验进行不同组别差异性比较分析, 基于Weighted Unifrac 距离的PCoA 主坐标分析和Heatmap 均采用R 程序做图,R 程序计算Spearman 相关性后, 通过Cytoscape 实现网络图的可视化。 原始测序数据已经上传至NCBI(项目号:PRJNA663287)。
2 结果分析
2.1 实验小鼠体重对比结果分析
将4 周小鼠的体重进行比较, 结果见图1(*为P<0.05)。 在0 周和1 周,4 组小鼠体重无明显差异(P>0.05);在第2 周,与Z 组小鼠体重进行比较,MZ 组和MG 组小鼠体重有显著升高(P<0.05)同时MZ 组和G 组无显著差异(P>0.05); 在第4周, 与Z 组小鼠进行比较,MZ 组和MG 组小鼠体重有显著升高(P<0.05),同时MZ 组和G 组无显著差异。由此可见,对小鼠喂养含有木薯淀粉的饲料更容易导致体重上升。
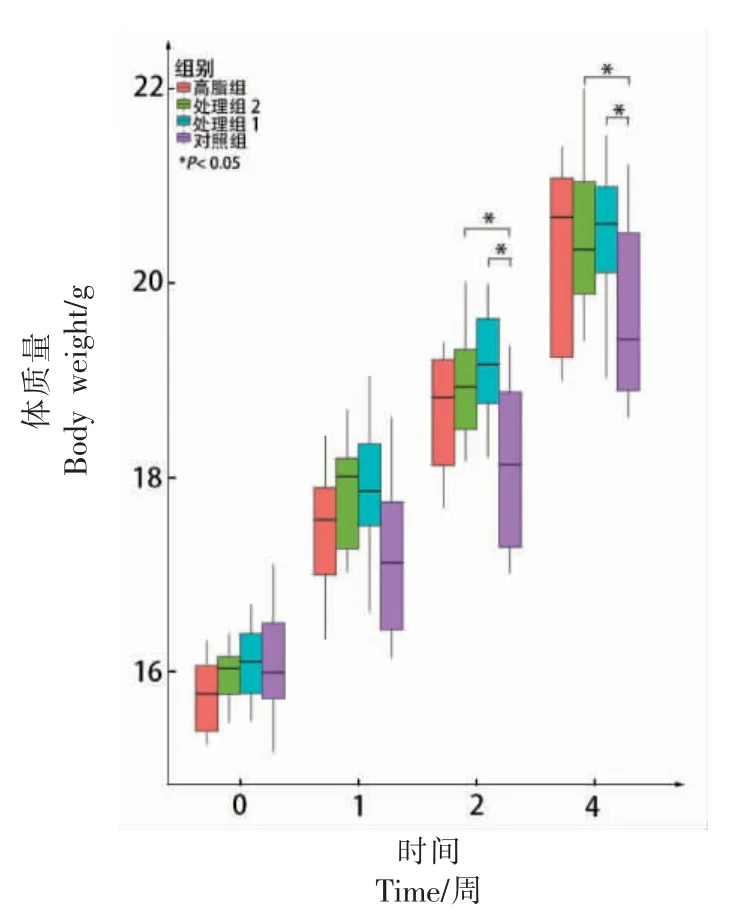
图1 不同时间点各组小鼠的体质量Fig.1 The weight of each group at different times
2.2 实验小鼠血液临床与免疫指标分析
采用试剂盒对小鼠血液进行血液临床指标TG、TC 和免疫指标IgG、IgA、IgM 测定, 结果如表1 所 示。 G 组、MZ 组 和MG 组 与Z组免疫指标IgG、IgA、IgM 的含量相比显著升高 (P<0.05);G组、MZ 组与Z 组相比TG 的含量显著升高(P<0.001),MG 组与Z 组相比无显著差异(P>0.05);G 组、MZ 组和MG 组与Z 组TC 的含量相比无显著差异(P>0.05)。 由此可见,高脂饮食和含有木薯淀粉的饲料能提高小鼠的血脂水平和免疫球蛋白IgA、IgG、IgM 的含量。

表1 小鼠血清观察指标分析Table 1 Analysis of serum observed indexes of mice
2.3 肠道微生物菌群多样性分析
为了对样品中微生物多样性和物种丰富度进行比较, 计算了样品中ACE 指数、Chao1 指数、香农指数(Shannon)和辛普森指数(Simpson)。如图2所示,ACE 指数和Chao1 指数在各样品组间无显著性差异(P>0.05),表示各组样品微生物丰富度无显著差异;对于香农指数(Shannon),MZ 组与Z组和MZ 组与G 组的2 周和4 周的样品均有显著性差异 (P<0.05),MG 组与G 组4 周的样品也有显著性差异(P<0.05);对于辛普森指数(Simpson),MZ 组与Z 组2 周的样品有显著性差异,MZ 组与G 组2 周和4 周的样品均有显著性差异 (P<0.05),MG 组与G 组4 周的样品也有显著性差异(P<0.05),同时MG 组和MZ 组的样品在不同的时间点(2 周和4 周)也有显著性差异,均能说明木薯淀粉摄入后肠道微生物多样性降低。
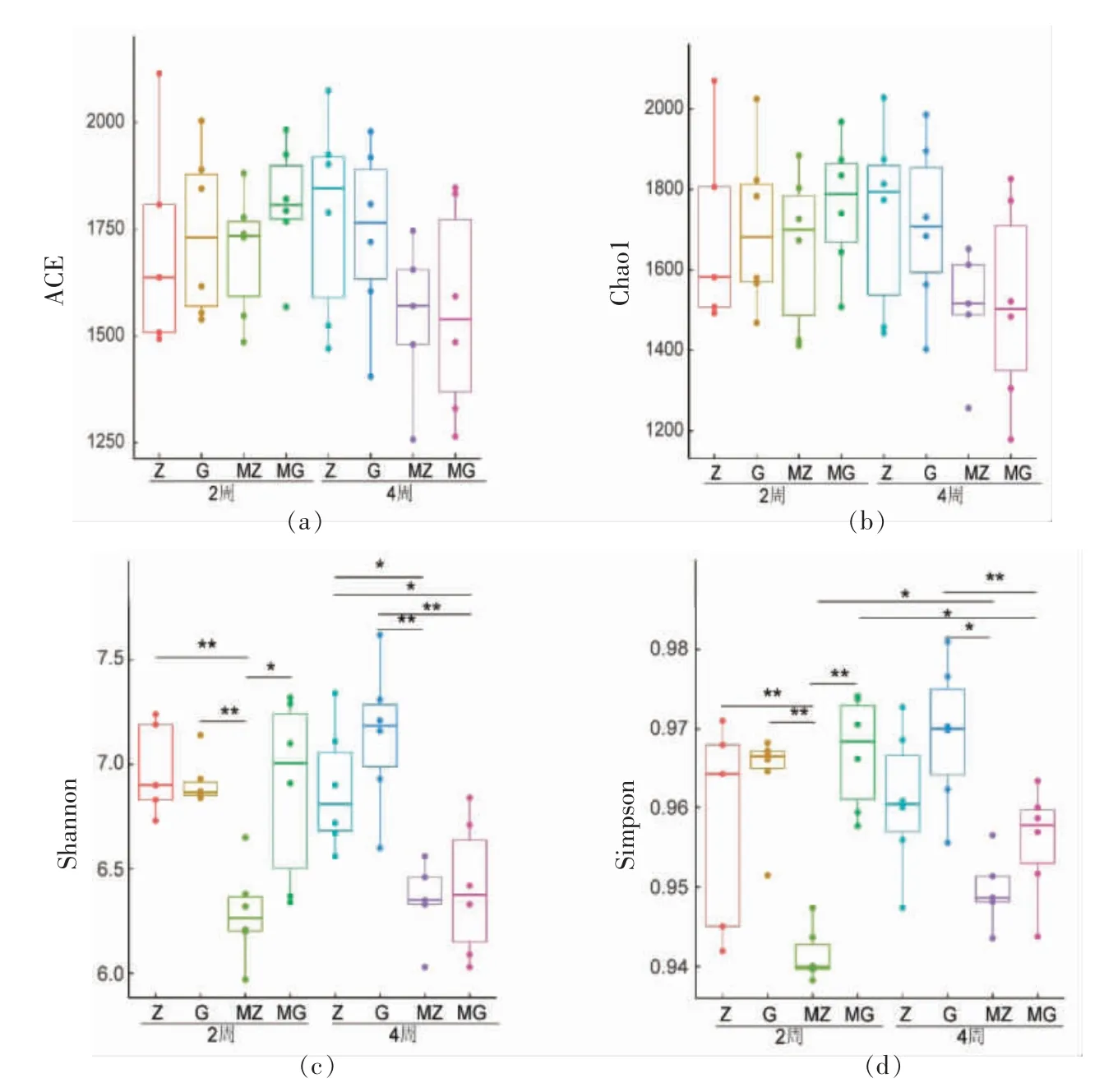
图2 小鼠肠道微生物α 多样性比较Fig.2 The α diversity of gut microbiota in mice
2.4 肠道微生物群落结构与差异性菌属分析
基于非加权(Unweighted unifrac)距离的主坐标分析(Principal coordinate analysis, PCoA)对样品进行分析,结果如图3a 和3b 所示。G 组、MZ 组和MG 组与Z 组相比较, 小鼠肠道菌群构成在主坐标上的位置存在明显聚类,MZ 组与G 组,4 周较2 周菌群结构逐渐靠近的趋势, 说明高脂饮食和木薯淀粉的摄入会改变小鼠肠道菌群结构。 进一步细化差异性菌属,G 组、MZ 组和MG 组与Z组相比较, 差异性菌属中苏黎世杆菌属和多尔氏菌属显著减少,双歧杆菌属显著增加;MZ 组、G 组与Z 组相比较,差异性菌属艾克曼菌属显著减少。
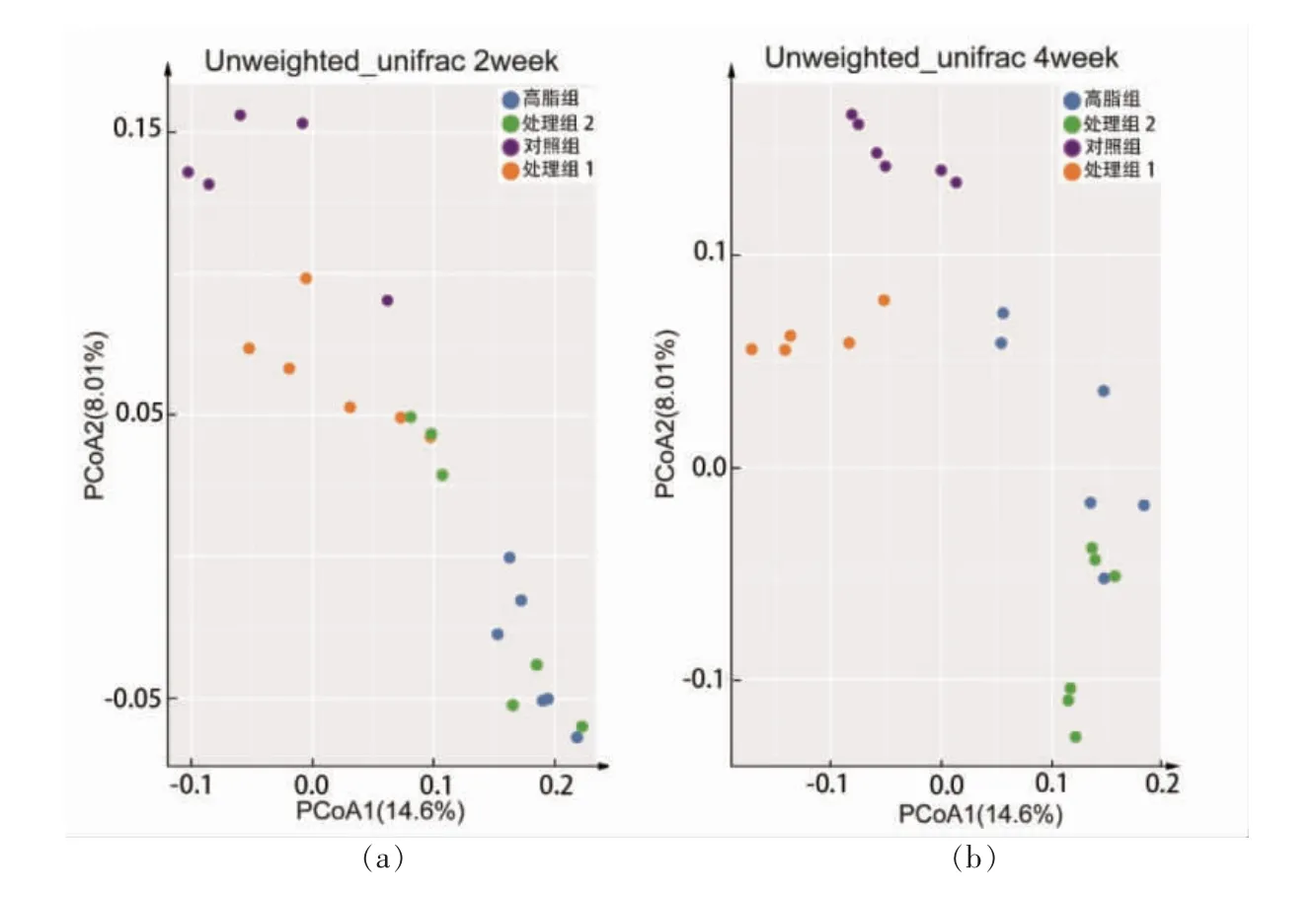
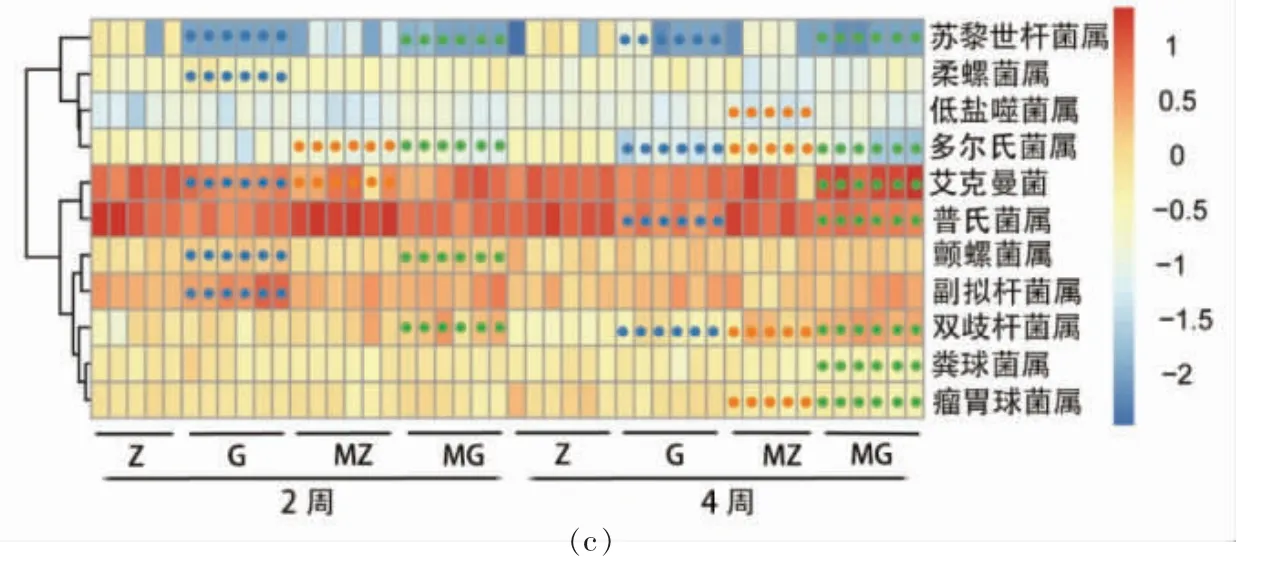
图3 β 多样性与差异性菌属分析Fig.3 Ananlysis of beta diversity and differential genus
2.5 肠道微生物差异性功能单元分析
选取贡献率大于1%且经Kruskal-Wallis 检验P 值小于0.05 的差异微生物代谢通路绘制成气泡图,结果如图4 所示。三级代谢通路主要差异主要和碳水化合物代谢、 氨基酸代谢和糖代谢有关,MZ 组与其它组相比, 氨基酸代谢和碳水化合物代谢呈现增高的趋势。 对于代谢通路分子伴侣催化蛋白质折叠, 与Z 组相比,G 组明显降低,而MG 组明显升高。对于与细菌运动蛋白相关的代谢通路,与Z 组相比,G 组明显上升而MG 组明显降低。

图4 肠道微生物差异性功能单元分析Fig.4 Analysis of different ial functional units of gut microbiota
2.6 肠道微生物差异性菌属、三级代谢通路以及生化指标的相关性分析
目标选取平均含量大于1%、代谢通路贡献率大于1%的差异性菌属, 通过Spearman 相关性计算r 值,选择相关性大于0.6 的菌属、三级代谢通路以及生化指标构建关系网络图。图5 中,红色代表正相关,蓝色代表负相关,用于表示相关性强弱的线条颜色连续变化。G 组和Z 组相较(图5a),三级代谢通路主要与碳水化合物和糖代谢有关,其中糖代谢与艾克曼菌属有极强的正相关关系,核糖体合成和氨基酸代谢与拟杆菌属存在正相关,碳水化合物代谢和甲烷代谢与艾克曼菌属极强负相关。副拟杆菌属只与TG 呈正相关。木薯高脂组和对照组相较(图5b),三级代谢通路主要与碳水化合物和氨基酸代谢有关, 其中糖代谢和氨基酸代谢与艾克曼菌属有极强的正相关关系, 甲烷代谢和碳水化合物代谢与艾克曼菌属有极强的负相关关系, 免疫指标IgA 和IgM 与厌氧枝原体属有极强的负相关关系。木薯正常组和对照组相较(图5c),三级代谢通路主要与氨基酸代谢有关,其中氨基酸代谢主要和低嗜盐细菌属有极强的正相关关系, 糖代谢和甲烷代谢与艾克曼菌属有极强的负相关关系,TG 指标与多尔氏菌属、 瘤胃球菌属和低嗜盐细菌属有极强的负相关关系。
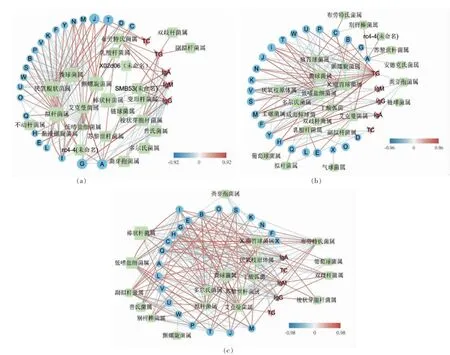
图5 肠道微生物差异性菌属、三级代谢通路以及生化指标的相关性分析Fig.5 Correlation analysis of different genera of gut microbiota, tertiary metabolic pathways and biochemical indicators
3 讨论
本研究采用小鼠动物模型, 通过建立肥胖模型以及喂养含木薯淀粉的饲料, 采用16S rRNA扩增子高通量测序技术分析了小鼠摄入木薯淀粉后生理生化指标以及肠道微生物菌群和代谢通路的变化。
木薯淀粉属于极易被肠道消化吸收的支链淀粉,容易引起胰岛素应答[24],因此更容易引发肥胖。 本研究的试验组和对照组小鼠体内总胆固醇的含量差异不显著, 可能由于肠道中具有改善脂质代谢紊乱功能的双歧杆菌相对丰度的增加。 摄入木薯淀粉有效改变了小鼠的肠道微生物组,与对照组相比, 苏黎世杆菌属和多尔氏菌属显著减少,双歧杆菌属显著增加。苏黎世杆菌属参与发酵代谢,乳酸是其主要代谢产物,具有调节肌肉和抗疲劳的作用[25]。 由于摄入极易被肠道消化吸收的木薯淀粉, 双歧杆菌可以高效分解利用碳水化合物,代谢产生乙酸和乳酸,且可以降低血清胆固醇和甘油三酯,改善脂质代谢紊乱[26-27]。 试验组和对照组小鼠体内总胆固醇的含量差异不显著, 可能是由于双歧杆菌相对丰度的增加以及其具有改善脂质代谢紊乱的功能所致。
小鼠肠道内能代谢产生短链脂肪酸的益生菌的显著减少可能是小鼠更容易患上肥胖症的原因之一。 短链脂肪酸可以作用于β 细胞促进胰岛素的分泌从而缓解肥胖以及有关研究发现肠道内益生菌代谢产生的丁酸可以抑制非酒精性脂肪肝小鼠的系统性肥胖[28]。 木薯高脂组肠道微生物苏黎世杆菌属、多尔氏菌属、普氏菌属、粪球菌属以及瘤胃球菌属的相对丰度都显著降低。 粪球菌属Coprococcus 能发酵碳水化合物,代谢产生丁酸[29]。瘤胃球菌属主要靠吸收单糖和降解黏蛋白来获取能量,其主要发酵代谢产物为乙酸和丁酸[30]。 肠道内能代谢产生乙酸、 丁酸等短链脂肪酸的有益菌显著减少, 可能是小鼠更容易患上肥胖症的原因之一。
小鼠饲喂高脂饮食同时摄入木薯淀粉, 会使肠道微生物中一些代谢产生短链脂肪酸的有益微生物的相对丰度显著降低, 同时比对高脂组与木薯高脂组肠道微生物丰富度及均匀度发现两者相似。在摄入高脂饲料与木薯淀粉后,小鼠的碳水化合物代谢和甲烷代谢升高, 与相对丰度降低的艾克曼菌属呈极强的负相关关系; 木薯高脂组与对照组相比肠道微生物中艾克曼菌属相对丰度显著增加。 有关研究表明, 艾克曼菌属有助于降低肥胖、糖尿病、炎症等疾病的风险[31],然而当艾克曼菌属相对丰度太高的时候反而会有相反的作用,加剧肥胖程度[32],可见木薯淀粉与高脂饮食有类似加剧肥胖程度的作用。
基于肠道微生物及其代谢通路的网路互作分析可以看出, 摄入木薯淀粉提供了丰富的碳水化合物, 促进了能分解代谢碳水化合物的微生物如双歧杆菌属和多尔氏菌属相对丰度的增加, 也增加了如梭状芽胞杆菌属[33-34]等致病菌的增殖。木薯淀粉介导的肠道菌群结构的改变使小鼠肠道代谢产物的改变, 同时丰富的碳水化合物也给机体提供了足够的能量来源,从而增加了能量的储存,生理生化指标如总胆固醇(TC)、甘油三酯(TG)以及免疫指标免疫球蛋白A (IgA)、 免疫球蛋白G(IgG)、免疫球蛋白M(IgM)以及肠道环境的改变表明摄入木薯淀粉更容易导致小鼠产生肥胖症状。

