血清ProGRP和NSE在晚期非小细胞肺癌中的表达及其临床意义
马晓平 闫红娟 徐丹 孟群 巩平
(石河子大学医学院第一附属医院 1肿瘤内科,新疆 石河子 832000;2口腔科;3镇江市第三人民医院;4新疆生产建设兵团第十师北屯医院肿瘤科)
根据组织病理学不同,将肺癌分非小细胞肺癌(NSCLC) 和小细胞肺癌(SCLC) 两大类,其中,NSCLC病理类型主要是腺癌和鳞癌〔1〕。目前,临床上运用较多的检测肺癌的手段有影像学检查、支气管镜活检、体液细胞学涂片、经皮肺穿刺活检等,但由于缺乏普及性及依从性,80%的肺癌患者在确诊时已出现局部或远处转移 (ⅢB/Ⅳ期),失去了手术机会,5年生存率≤15%〔2〕。因此,早期、准确判断患者疗效及耐药状况,以指导临床医师用药及方案的调整显得尤为重要。血清胃泌素释放肽前体(ProGRP)水平在小细胞肺癌患者中呈高表达,而且ProGRP对SCLC的早期诊断价值较高,与神经元特异性烯醇化酶(NSE)联合,能提高对SCLC分型的检出率。那么在NSCLC患者中是否是类似作用呢?基于此,本研究拟检测晚期NSCLC患者血清ProGRP和NSE水平的表达情况,分析其与患者临床特征、TNM分期、病理学特征之间的相关性,初步探讨其在晚期NSCLC中的临床意义。
1 材料与方法
1.1标本及其来源 收集来自石河子大学医学院第一附属医院肿瘤内科、心胸外科2018年11月1日至2019年10月31日就诊的晚期NSCLC患者75例。其中,女43例,男32例,年龄42~80岁,平均59.91岁,有吸烟史者39例,均经病理组织学或细胞学 (包括手术标本病检、支气管镜活检、肺穿刺、体液涂片、浅表器官活检、胸腔积液包埋等) 确诊。按组织学分类:其中腺癌60例,鳞癌15例;表皮生长因子受体(EGFR)基因状态:其中阳性 (突变型) 43例,阴性 (野生型) 32例;病理学分级:其中低分化39例,中分化32例,高分化4例。本研究已通过石河子大学医学院第一附属医院伦理委员会审核批准。
1.2主要仪器和试剂 ProGRP电化学发光法检测试剂盒、NSE电化学发光法检测试剂盒、Cobas E602全自动电化学发光免疫分析仪 (德国罗氏公司);离心机TD5A (中国长沙英泰仪器有限公司)。
1.3ProGRP、NSE水平检测 所有入组患者需禁食水至少8 h,入院第2天清晨抽取静脉血至少2 ml,置于BD真空采血管中,室温静置20~30 min,以4 000 r/min离心5 min,立即分离血清,使用电化学发光免疫检测法,采用双抗体夹心法原理,检测血清ProGRP和NSE水平;血清ProGRP正常参考水平≤84 pg/ml,血清NSE正常参考水平≤25 ng/ml。 检测值高于正常参考水平即判定为阳性结果。所有入组患者,一律使用肌酐酶法同时检测肌酐水平。
1.4统计学方法 应用SPSS20.0软件进行中位数与四分位间距描述、秩和检验。
2 结 果
2.1血清ProGRP和NSE水平与患者临床特征之间的关系 血清ProGRP和NSE与晚期NSCLC患者的年龄、性别、吸烟史、美国东部肿瘤协作组(ECOG)评分之间均无显著相关性(P>0.05),见表1。
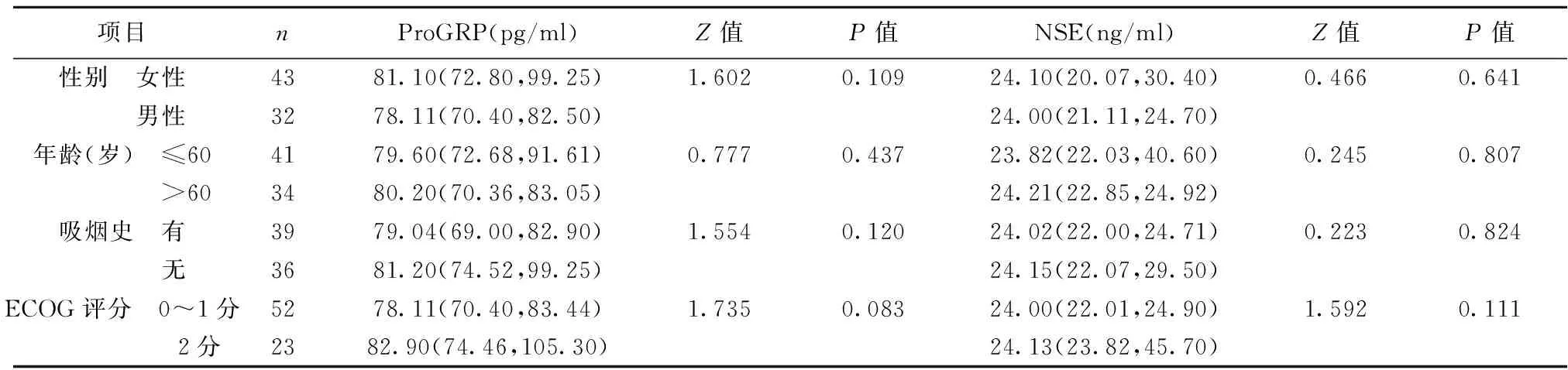
表1 血清ProGRP和NSE水平与临床特征的相关性〔M(P25,P75)〕
2.2血清ProGRP和NSE水平与患者临床TNM分期的关系 血清ProGRP和NSE水平与晚期NSCLC患者临床肿瘤直径、有无区域淋巴结转移均无显著相关性 (P>0.05);而随着患者临床转移部位数目的增多,血清ProGRP和NSE水平显著升高(P<0.05),见表2。
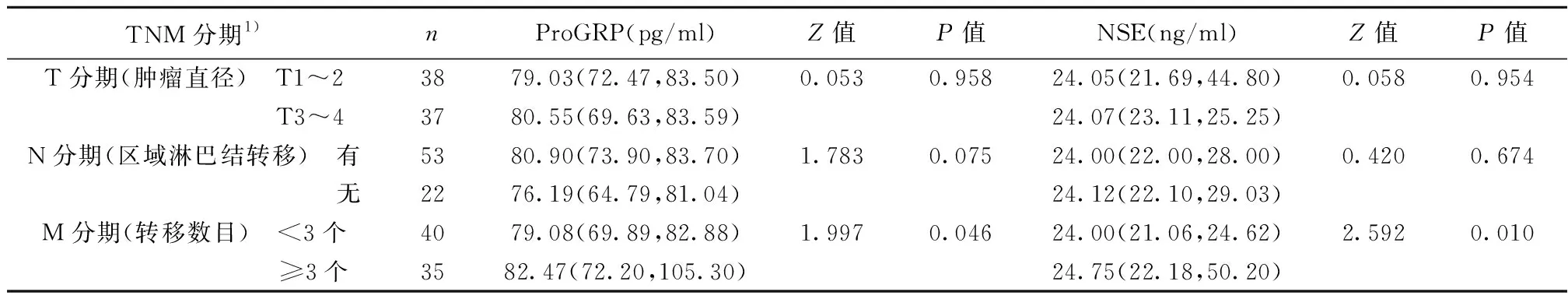
表2 血清ProGRP和NSE水平与临床TNM分期的相关性〔M(P25,P75)〕
2.3血清ProGRP和NSE水平与患者病理特征之间的关系 腺癌患者血清ProGRP和NSE水平显著高于鳞癌(P<0.05);EGFR基因阳性(突变型)血清ProGRP和NSE水平显著高于EGFR基因阴性 (野生型)(P<0.01,P<0.001);血清ProGRP和NSE水平与肿瘤分化程度无明显相关性(P>0.05),见表3。
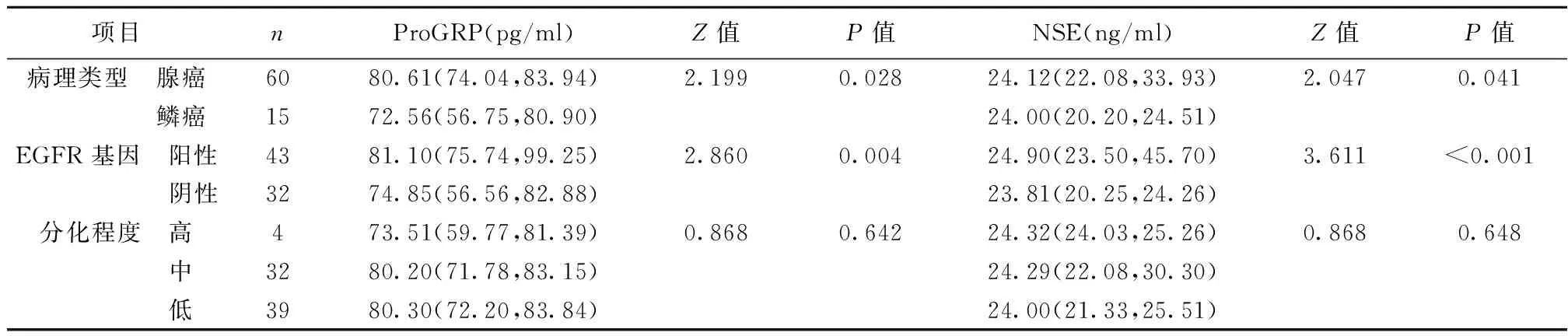
表3 血清ProGRP和NSE水平与患者病理特征的相关性〔M(P25,P75)〕
3 讨 论
随着吸烟人数增加、大气污染加重,肺癌发病率呈逐年上升趋势,已处于所有恶性肿瘤死亡率第一位〔3~5〕。NSCLC具有病理机制复杂、易耐药、预后差等特点。肿瘤标志物(TM)〔6〕是由肿瘤细胞自身合成释放,是宿主对肿瘤细胞反应而产生或升高的一类物质,存在于血液、体液或组织、细胞中,其作为一种非侵袭性的检测方法,具有创伤小、高效、方便、价廉及标本易获取等优点,逐步成为NSCLC临床诊断和治疗中可信赖的指标。
NSE是神经源性细胞分泌的一种蛋白酶〔7〕,是糖酵解过程中催化2-磷酸甘油与磷酸烯醇式丙酮酸相互转化的水解酶,在神经源性恶性肿瘤和神经内分泌细胞中含量较多。NSE在神经内分泌系统肿瘤中,其水平呈明显高表达状态。血清NSE检测已多年运用于临床,是目前小细胞肺癌诊治最常用的实验室检测指标。血清NSE水平在SCLC里显著高于NSCLC,因此,血清NSE水平对小细胞肺癌的诊断及与NSCLC之间鉴别诊断有较高的临床应用价值,并可用于化疗、放疗效果的检测。
GRP属于胃肠激素类,其作用是主要刺激胃的G细胞分泌胃泌素、参与平滑肌细胞的收缩、促进细胞间的相互作用〔8〕。SCLC是神经内分泌起源的恶性肿瘤之一,许多SCLC的细胞株、血液和肿瘤组织里都分泌GRP,并且,GRP和自身受体结合促进DNA合成。因而SCLC患者血中可检测到升高的GRP。但GRP半衰期只有2 min,稳定性差,难以检测。作为GRP的前体ProGRP的稳定性更好,半衰期更长 (明显>2 min),可通过检测血清或血浆样本,体现GRP的水平〔9〕。有研究表明〔10〕,血清中GRP的水平与ProGRP呈正相关。ProGRP是GRP的前体结构,因氨基酸残基的不同,一般分为3种分子亚型,它们都有共同的ProGRP (31-98) C端序列。ProGRP是一种新的SCLC的肿瘤标志物,广泛存在于神经纤维、非胃窦组织、肺、前列腺及脑组织的神经内分泌细胞内。
文献证实〔11〕血清ProGRP和NSE在SCLC患者中的诊断价值,针对血清ProGRP和NSE在肺癌中的应用价值进行了Meta分析显示〔12〕,血清ProGRP和NSE组合检测与血清NSE单独检测对SCLC的诊断能力相近,而血清ProGRP拥有更高的特异度,可以作为SCLC诊断的检测指标。彭彦等〔13〕研究结果证实,血清NSE及ProGRP水平在治疗有效的患者中较化疗前明显降低,提示血清肿瘤标志物变化情况可能对SCLC化疗疗效评估有一定的预测作用。结果显示,血清ProGRP和NSE表达水平与晚期非小细胞肺癌耐药后患者的年龄、性别、吸烟史、ECOG评分、分化程度及临床肿瘤大直径、有无区域淋巴结转移均无相关性,这与宋华等〔14〕研究结果相似。同时,本研究显示,血清ProGRP和NSE水平与临床M分期远处转移部位数目有关。相关研究报道,程黎明等〔15〕表明,患者血清肿瘤标志物水平越高,其临床分期越晚,生存期越短。GRP与相应受体结合后,可以促进恶性肿瘤的细胞增殖、浸润转移、血管生成等,参与肺癌的生长及转移,ProGRP的促生长作用是引起恶性肿瘤更有攻击性及预后差的原因〔16〕。Shibayama等〔17〕研究者发现,进展期SCLC患者的血清ProGRP水平显著高于局限期患者,血清ProGRP水平在广泛期肺癌患者中表达更高、更明显。此外,本研究发现晚期肺腺癌、EGFR基因检测阳性患者,较鳞癌、EGFR阴性患者,血清ProGRP和NSE水平更易呈高表达状态。
本项研究的不足之处在于为样本量较少,仍需进一步积累,以便得到更稳健的结果。总之,血清ProGRP、NSE在晚期NSCLC的分期、指导治疗方面有一定作用,联合应用可在临床中发挥更好的作用。

