计算流体力学在主动脉夹层中的应用及研究进展
李昭明,邓 丽,王茂生
目前主动脉夹层(aortic dissection,AD)诊疗基于影像学进行,影像图像可以显示夹层的位置、大小等信息,但无法评估血流动力学参数的变化,与传统的诊疗策略相比,计算流体力学(computational fluid dynamics,CFD)近年来被应用于模拟人体心脏大血管系统中和血流情况,将难以直接分析的血流动力学问题直观地展示出来,获取主动脉内血液的流速、壁面压力、壁面剪切力等数据,在主动脉夹层的风险评估、术后评估、疾病进展、模拟手术、手术方案设计、医疗器械设计等都有巨大的潜力。本文将重点讨论CFD在AD中的应用及研究进展,并进一步讨论目前的挑战和前景。
1 AD概述
1.1AD诊疗现状 AD是一种病情重、进展快、致死率高的以剧烈的胸背部疼痛为主要表现的主动脉疾病,是最严重的大动脉综合征之一,对患者生命和生存质量造成巨大影响。研究显示,AD的发病率为6人/10万人[1]。但由于受到调查对象的限制,AD实际的发生率要比此前描述的要高[2]。由于该病发生原因多、机制复杂,目前仍未被完全研究清楚,尽管近年来高血压发病率下降,但人群带病率上升[3],高血压已经成为引发AD的最重要因素。
AD患者常常以剧烈胸痛或腹痛为就诊原因,部分患者以腹痛为首发症状,少数患者疼痛不明显,而表现为瘫痪、晕厥、呼吸困难、咯血或类休克[4]。
经胸超声心动图适合作为早期筛查使用,但不能对主动脉全段进行评估,易漏诊。经食管超声心动图可以发现升主动脉末端到降主动脉的夹层病变,但是操作过程中可能会引起病情加重。核磁共振成像(magnetic resonance imagin,MRI)和CT血管成像(CT angiography,CTA)目前被广泛应用于主动脉夹层的诊断,69%病例的AD的诊断、特征和危险分级是通过CTA进行的[5],两者均能准确反映内膜撕裂的部位,清楚显示AD的真假腔,还可以对病变数量及范围进行精确测定,从而准确分型,指导临床治疗。然而,单纯的影像学检查难以提供全面的AD病变信息,特别是血流状态与管壁压强等血流动力学参数的变化;同时,随着精准医学需求的日益增加,患者特异性的AD的功能学评估成为个性化诊断和治疗的趋势[6]。
现今临床上治疗AD的方式主要包括内科药物治疗、外科手术治疗和胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)。孙立忠教授提出的“全主动脉弓替换+支架象鼻手术”,即“孙氏手术”,成为许多心脏外科中心治疗Stanford A型AD的标准术式[7]。术后需要对手术疗效进行充分评估,以降低患者术后死亡率,但目前常规的检查手段难以获得一个可靠的术后疗效评价。Stanford B型AD还可以通过TEVAR植入支架封闭主动脉内膜撕裂口,然而不同期Stanford B型AD具体进展程度以及病理变化均不同,TEVAR疗效也具有一定差异[8]。
1.2CFD的重要意义 CFD是近代流体力学、数值数学和计算机科学结合的产物。它以电子计算机为工具,通过计算机和数值方法来求解流体力学的控制方程,对流体力学问题进行模拟和分析,以解决各种实际问题[9]。CFD作为了解AD中解剖学和血流动力学相互作用的工具,可明确描述AD患者的血流动力学[10]。
2 CFD在AD中应用及相关研究
2.1CFD在AD中的应用价值 基于AD患者的影像学数据(MRI、CTA),构建该患者主动脉三维模型和血流动力学的数值模拟研究,分析流场速度分布、夹层破口剖面速度分布以及壁面切应力等数据[6],CFD的流程见图1所示。应用CFD可以个性化仿真患者主动脉内血流状况,识别易发生不良后果的人群,并通过模拟不同的干预措施支持临床医师进行决策[11];CFD可以模拟AD真腔和假腔在形态学改变时的血流动力学变化,可用于连续监测治疗前后AD的血流动力学变化[12]。通过虚拟手术构建不同手术后的术后模型,对比不同手术方式后主动脉内流速、壁面压力、壁面剪应力(wall shear stress,WSS)以及相对停滞时间等相关参数,以得出最佳手术方案,对于术后的患者可以应用CFD从血流动力学的角度评价AD手术效果[13]。影像学方法难以直接观察主动脉内的血流情况,通过CFD模拟可以直观展示,然后选取关键部位,获取该部位的血流流动状态、壁面压力和WSS等数据。
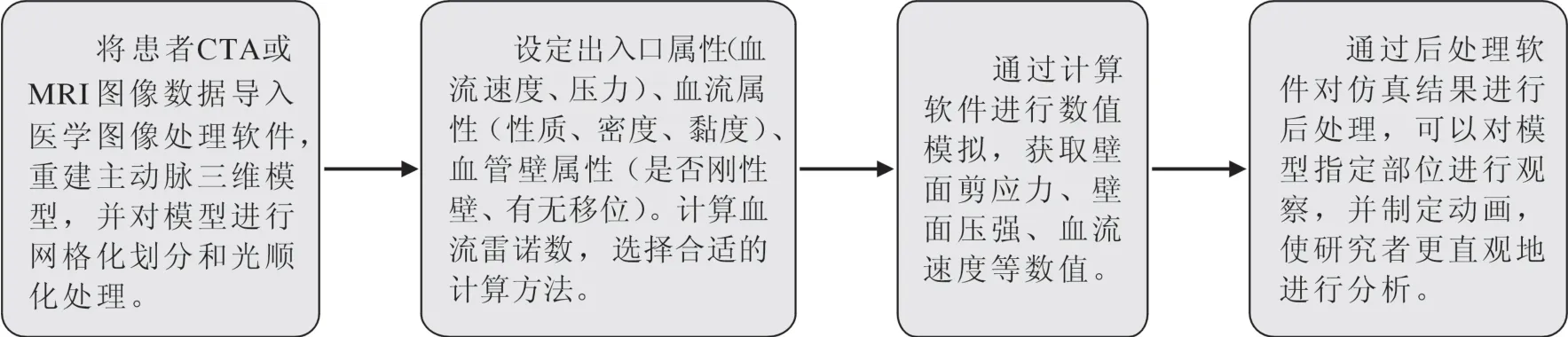
图1 CFD数值模拟流程
2.2模型建立及边界条件 血管的几何形状多采用基于医学影像的数据(CTA、MRI数据等),利用软件(如Mimics)进行三维重建,对模型进行裁剪、光顺化及网格化处理,进行网格化处理时,理论上网格划分越细,模型精确度越高,但也使得计算量增大,因此需根据计算机性能选择合适的计算精度,充分发挥计算机性能的同时获得更精确的数据。模型施加符合人体实际的边界条件。①进口边界条件:获取主动脉内精确的血流流速需要对受试者采用侵入性的方法才能获取血流相关数据,这样的操作具有一定风险性,在实际临床上很难实现,可以通过四维相位对比磁共振成像和多普勒超声测速,分别获得主动脉内的三维血流速度分布和流速[14-15],部分研究为方便获取计算数据,直接采用已有研究者的研究数据进行分析。②壁面边界条件:为了方便进行计算,许多研究都把主动脉血管壁假设为无渗流且刚性的管道,但是真实的主动脉血管壁是有弹性的,血流流动时管壁会发生运动,因此需要考虑血液对血管壁的作用,需运用流固耦合(fluid-structure interaction,FSI)方法。有研究分别用刚性壁和FSI方法对AD患者进行CFD计算,发现某些低剪应力和振荡WSS的组合区域仅在FSI方法中被识别出来,这些区域可能是AD进展的关键[16]。③血液流场:需考虑血液流场选用层流还是湍流模型。层流或湍流的发生与雷诺数Re密切相关,Re定义为:

注:ρ为流体密度;V为流体流动的速度;D为圆管的内直径;μ为流体黏度。当Re小于临界值(通常为2 300)时,流动为层流,当Re大于临界值时,流动为湍流。理想条件下(心脏的搏动周期为75次/min,在0.8 s的心脏搏动周期中,一般认为心缩期占0.35 s,心舒期占0.45 s)人体血流Re=1 137,因此,正常人体模型中的血流视为层流[17]。④血液的属性:许多研究将血液视为不可压缩的牛顿流体,但血液并不是单纯的液体,含有无数血细胞及蛋白质,因此有研究者进行了血浆及血细胞的两相流动模拟,能准确捕捉到局部低流速涡流与低红细胞体积分数区域、高振荡剪切指数值之间的关系,有利于分析局部血栓形成的可能性[18]。⑤多个裂口的问题:Dillon-Murphy等[19]提出了耦合多域血流模拟方法,分别计算各区域的入口和出口简化模型,再组合在一起计算,进行简化计算以解决多个裂口的计算问题。
2.3影像建模质量 由于应用CFD进行分析必须基于影像学图像建模,正如Clough等[20]评论:“模型结果的好坏取决于用于构建模型的信息的特异性和质量。”模拟结果将受到影像学成像质量的限制。最主要的困难来自于内膜皮瓣和撕裂部位的动态运动[21],这些部分体积较小,常常在影像学图像上难以发现或清晰度欠佳,难以获取内膜皮瓣和撕裂部位的运动情况,导致建立的主动脉三维模型结构不理想,难以精确模拟人体真实的血流情况。而且,有研究利用CFD模拟对比夹层血流和去除内膜皮瓣和撕裂部位的模型血流后发现,内膜皮瓣和撕裂部位对主动脉,特别是降主动脉和胸主动脉的血流动力学有显著影响[19],难以忽略进行计算。
2.4CFD应用在AD中的研究成果
2.4.1CFD中需要关注的因素 Menichini等[22]发现,血栓形成区域往往是血流停滞时间长的区域。Menichini等[23]随后创建了一个计算模型,表明低WSS的区域可以与血栓形成的区域相关联,低WSS区域有利于血栓形成。他们最后在随访中通过CT验证了这一点。Ben等[10]创建了几个理想的AD模型进行CFD分析,认为主动脉曲率、撕裂口的大小、位于主动脉内弯的假腔和远端撕裂口闭塞均可引起血流动力学的恶化。继发性交通性撕裂,特别是较大的撕裂,对降主动脉和胸主动脉的血流动力学有显著影响[19]。由于真假腔在各处的压力差不一样,Xu等[24]提出应用腔间压强差来量化真假腔在不同位置的真假腔压强优势,而真腔压强占优者可引导良性重塑,多出现在主动脉近端;假腔压强优势者则增加不良事件概率,多出现在主动脉远端。
2.4.2在Stanford A型AD中的相关研究 Osswald等[25]发现在发生逆行Stanford A型AD的患者中,WSS较周围壁明显增加。Long Ko等[26]在CFD模型中观察到,在收缩期中期,假腔WSS明显高于真腔WSS,这可能会引起假腔的进一步扩大,逆行Stanford A型AD发病的血流动力学与此密切相关。Malvindi等对1例合并单尖瓣主动脉瓣的升主动脉瘤患者进行了CFD分析,结果显示动脉瘤内血液呈异常螺旋状流动,升主动脉右后外壁WSS增加,这些数值大大高于主动脉壁剥离的理论临界值,他们由此判断此处将发生AD,随后通过CT扫描,并在夹层修复手术中证实了Stanford A型AD的发生[27]。
2.4.3在Stanford B型AD中的相关研究 Cheng等[28]通过CFD研究了5例急性Stanford B型AD患者后发现,近端撕裂的位置和大小决定了假腔内的血流量,形态学分析与CFD模型相结合可能有助于预测急性B型AD的进展,从而选择合适的治疗方式,但仍需要进一步的研究得以证实。Ben等[10]研究发现多种因素可以引起Stanford B型AD患者假腔内压力升高,引起假腔进一步扩大,其中远端撕裂闭塞和近端较大撕裂对假腔压力的影响最为密切。段晓杰等[29]通过CFD模拟不同血压条件下Stanford B型AD患者的血流动力学,在高血压条件下的血流对主动脉壁施加更大的压力,易于造成血流涡流,增加了主动脉内膜破裂产生夹层的概率。
2.4.4CFD可以作为评估AD治疗效果的一种方法
Karmonik等[30]应用CFD和MRI对急性Stanford B型AD治疗前后的血流情况进行研究,观察TEVER治疗前后WSS和动压(dynamic pressure,dynP)的变化,治疗前,WSS>5 Pa和dynP>80 Pa出现在入口撕裂处和真腔狭窄区。治疗后,除支架近端和再入口撕裂处外,真腔内WSS低于3.3 Pa,dynP低于55 Pa。随访1年后,胸主动脉段完全重构,腹主动脉假腔未有血栓形成。通过虚拟闭塞入口撕裂模拟TEVER治疗,发现治疗后假腔内压力显著降低[31]。Costache等[32]应用CFD分析了16例应用多层支架治疗的Stanford B型AD患者治疗前后主动脉内血流动力学后发现,患者术后真腔体积增大,假腔体积减小,真腔内血流呈流线型,血流整体流速和压力降低,流动的阻力也明显减少,他们认为这可以成为一种评估AD治疗效果的方法。Armour等[33]研究了TEVAR术后患者血流动力学,发现胸段支架远端与再撕裂入口(SG-FRT)的距离越远、假腔流量减少、时间平均WSS较低、越有利于假腔内血栓形成。通过CFD合理选择支架植入的区域,以保证足够的SG-FRT距离,有利于术后血栓形成。熊江等人提出应用血流功能指标真假腔压强差平衡位置(first balance position,FBP)来判断TEVER术后的真假腔重塑效果和残余假腔扩张的风险,由于主动脉近端多位真腔压强占优势,因此,FBP位置越高说明真腔受压越严重,意味着病情越严重;他们分析了TEVER术前及术后的模型,发现植入支架后,FBP向主动脉远端移动,该移动距离sFBP可由于量化患者TEVER术后的血流动力学获益,可作为评价TEVER有效性的血流动力学指标。
2.5当前CFD研究的限制性 很多研究虽然利用CFD对主动脉内血流进行了分析,不同的研究采用的建模方法各有不同,这导致研究者们的结果也有差距,而且研究结果缺乏有效验证,特别是没有利用4D Flow MRI进行高质量的验证[23]。应用CFD参与AD的诊疗,目前仍处于实验阶段,距离指导临床决策仍有一段距离。由于每个患者都是独特的个体模型,难以使用理想的标准模型进行针对患者个体的研究,CFD应用于临床中最主要的挑战是开发和测试一种临床医师可用于为患者进行个性化的风险评估、疗效评价的方法。深度学习神经网络有望成为解决这个问题的一种途径,深度学习神经网络能够分析有无数种可能的复杂问题,因为神经网络中的层能够将每一步近似为因果序列对结果进行分析。通过机器深度学习实现当前CFD模拟流程的自动化,在未来可以明显加快对患者的评估,并且临床医师可以在没有具备CFD和高性能计算知识的专业工程师的帮助下进行。程序包括以下内容:访问CTA或MRI数据开始重建患者AD模型;生成AD结构的计算网格;将边界条件应用到模型中;计算模拟数值计算流速、压力和WSS等血流动力学数据,最后得出可视化结果数据[34]。随着对CFD在临床上的持续深入研究,它可能成为大多数病例的常规诊疗手段,包括那些根据其他特征被认为是高风险的病例,当该患者发病时,计算模型可以把关键信息在超急性期提供给临床医师,帮助临床医师开展诊疗工作。
3 结语及展望
CFD在AD中的应用目前还处在实验阶段,CFD在AD患者的风险评估、模拟手术、疗效评估等方面有巨大的潜力,这是以往各种诊疗手段都难以完成的。但是,目前应用CFD评估患者需要耗费大量时间,且需要临床医师和计算工程师相互配合完成,对于超急性期、急性期AD患者并不合适。尽管有不少研究者通过CFD研究了压力、解剖、流速等因素对主动脉内血流动力学的影响,但很多因素,如内膜瓣的运动、主动脉血管壁的运动等很少被研究,这些因素同样被认为对血流动力学有较大的影响。完善各种因素对血流动力学的影响,以开发深度学习神经网络程序,实现临床医师应用CFD快速对患者进行分析并得出决策,将是未来的重要发展方向[35]。

