半枝莲标准汤剂的指纹图谱建立与抗氧化活性成分的化学模式识别
杜义龙 李赛 李艳荣 潘海峰





中圖分类号 R284.1 文献标志码 A 文章编号 1001-0408(2022)04-0425-08
DOI 10.6039/j.issn.1001-0408.2022.04.08
摘 要 目的 测定半枝莲标准汤剂中总黄酮的含量,评价其体外抗氧化活性,建立其指纹图谱,并进行化学模式识别分析。方法 采用紫外-可见分光光度法测定半枝莲标准汤剂中总黄酮含量(以野黄芩素计);采用1,1-二苯基-2-三硝基苯肼(DPPH)自由基、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除实验考察半枝莲标准汤剂的体外抗氧化活性;采用高效液相色谱(HPLC)法,以野黄芩苷峰为参照峰,采用《中药色谱指纹图谱相似度评价系统(2004A版)》绘制16批半枝莲标准汤剂的指纹图谱并进行相似度评价,确定共有峰;采用SPSS 24.0软件进行Pearson相关性分析,筛选具有体外抗氧化活性的潜在物质,并以其为变量,采用SPSS 24.0、SIMCA 14.1软件进行聚类分析和主成分分析。结果 总黄酮检测质量浓度的线性范围为2.106~21.06 μg/mL(R 2=0.999 3);精密度、重复性、稳定性(120 min)试验的RSD均小于2%;加样回收率为100.62%(RSD=0.55%,n=6);总黄酮含量为0.634~1.053 mg/mL。DPPH自由基清除实验的半数抑制浓度(IC50)为1.120~3.602 mg/mL,ABTS自由基清除实验的IC50为0.684~1.327 mg/mL;相关性分析结果显示,半枝莲标准汤剂中总黄酮含量与DPPH自由基、ABTS自由基清除实验的IC50均呈负相关,相关系数分别为-0.976、-0.940(P<0.01)。16批半枝莲标准汤剂共有18个共有峰,相似度为0.964~0.997;共指认出其中4个共有峰,分别为野黄芩苷(8号峰)、野黄芩素(14号峰)、木犀草素(15号峰)、芹菜素(17号峰)。半枝莲标准汤剂HPLC指纹图谱中3~4、8~9、12~15、17号峰峰面积与DPPH自由基、ABTS自由基清除实验的IC50均呈显著负相关(P<0.05或P<0.01)。聚类分析结果显示,16批半枝莲标准汤剂可聚为两类,其中S2、S7~S8、S14~S16为一类,S1、S3~S6、S9~S13为一类;主成分分析将16批半枝莲标准汤剂分为两类,其中S2、S4、S7、S14~S16为一类,S1、S3、S5~S6、S8~S13为一类,S4、S13、S15样品的综合评分较高。结论 所建HPLC指纹图谱及化学模式识别分析方法可用于评价半枝莲标准汤剂的质量;3~4、8~9、12~15、17号峰及总黄酮是半枝莲标准汤剂清除DPPH自由基和ABTS自由基的潜在物质基础。
关键词 半枝莲;标准汤剂;总黄酮;体外抗氧化作用;指纹图谱;主成分分析;聚类分析
Fingerprint establishment of Scutellaria barbata standard decoction and chemical pattern recognition of antioxidant components
DU Yilong,LI Sai,LI Yanrong,PAN Haifeng(Hebei Key Laboratory of Traditional Chinese Medicine Research and Development, Chengde Medical University, Hebei Chengde 067000, China)
ABSTRACT OBJECTIVE To determine the contents of total flavonoids in Scutellaria barbata standard decoction, evaluate in vitro antioxidant activity, establish the fingerprint and conduct chemical pattern recognition analysis. METHODS The contents of total flavonoids in S. barbata standard decoction (calculated by scutellarein) were determined by ultraviet-visible spectrophotometry. In vitro antioxidant activity of S. barbata standard decoction was investigated by free radical scavenging tests of 1,1-diphenyl- 2-trinitrophenylhydrazine (DPPH) and 2,2′-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) ammonium salt(ABTS); HPLC method was adopted. Using scutellarin as reference, the fingerprints of 16 batches of S. barbata standard decoction were drawn and evaluated by Similarity Evaluation System of TCM Chromatogram Fingerprint (2004 A edition), and the common peaks were determined; Pearson correlation analysis was carried out by using SPSS 24.0 software to screen substances with in vitro antioxidant activity. Taking them as variables, cluster analysis and principal component analysis were carried out by using SPSS 24.0 and SIMCA 14.1 software. RESULTS The linear range of total flavonoids were 2.106-21.06 μg/mL(R 2=0.999 3); RSDs of precision, reproducibility and stability tests (120 min) were all lower than 2%; the recovery was 100.62% (RSD=0.55%,n=6); the contents of total flavonoids were 0.634-1.053 mg/mL. Median inhibitory concentration (IC50) of DPPH radical scavenging experiment ranged 1.120-3.602 mg/mL, and IC50 of ABTS radical scavenging experiment ranged 0.684-1.327 mg/mL. The results of correlation analysis showed that the content of total flavonoids in S. barbata standard decoction was negatively correlated with the IC50 of DPPH free radical and ABTS free radical scavenging experiment, and the correlation coefficients were -0.976 and -0.940 respectively (P<0.01). There were 18 common peaks in the fingerprints of 16 batches of S. barbata standard decoction; the similarities were 0.964-0.997. A total of 4 common peaks were identified, such as scutellarin (peak 8),scutellarein (peak 14), luteolin (peak 15), apigenin (peak 17).In the HPLC fingerprints of S. barbata standard decoction, the peak areas of peak 3-4, 8-9, 12-15 and 17 were significantly negatively correlated with the IC50 of DPPH free radical and ABTS free radical scavenging experiment (P<0.05). The results of cluster analysis showed that 16 batches of S. barbata standard decoction could be clustered into two categories, of which S2, S7-S8 and S14-S16 were clustered into one category, S1, S3-S6 and S9-S13 were clustered into one category. By principal component analysis, 16 batches of S. barbata standard decoction were divided into two categories, of which S2, S4, S7 and S14-S16 were clustered into one category, and S1, S3, S5-S6 and S8-S13 were clustered into one. The comprehensive scores were high in the samples of S4, S13, S15. CONCLUSIONS Established HPLC fingerprint and chemical pattern recognition analysis method can be used to evaluate the quality of S. barbata standard decoction; peak 3-4, 8-9, 12-15 and 17 and total flavonoids are the potential material basis for S. barbata standard decoction to scavenge DPPH free radical and ABTS free radical.
KEYWORDS Scutellaria barbata; standard decoction; total flavonoids; in vitro antioxidant effect; fingerprint; principal component analysis; cluster analysis
半枝莲Scutellaria barbata D. Don为唇形科黄芩属多年生草本植物,以干燥全草入药,始载于《外科正宗》[1]。半枝莲在明代被称为“解蛇伤之仙草”,主产于我国河南、河北、安徽、四川、浙江等省,主要含有黄酮类、二萜类、多糖类等化学成分,具有清热解毒、化瘀利尿之功效[1-2]。现代药理研究表明,半枝莲所含有的黄酮类成分具有抗氧化、抗肿瘤、抗菌、抗炎、抗病毒等多种药理活性[3-5],是潜在的天然抗氧化剂,临床应用前景广泛[1]。
2016年国家药典委员会提出了“标准汤剂”的概念,是指在中医药理论指导下,通过规范化煎煮、固液分离和适当浓缩或适宜方法干燥制得的中药汤剂[6]。中药标准汤剂是衡量单味中药配方颗粒临床汤剂与对应中药饮片临床汤剂是否一致的物质基准[7]。指纹图谱能够通过共有峰标定、相似度评价等手段较全面地反映中药的整体性[8],故《中药配方颗粒质量控制与标准制定技术要求》将指纹图谱作为评价单味中药标准汤剂与对应中药饮片临床汤剂一致性的重要手段[9]。中药谱效学是着重解决中药活性成分复杂、药理作用机制不明的一门学科,可利用多种数据分析中药药理活性的物质基础[10]。化学模式识别分析包括聚类分析和主成分分析等,是用于揭示隐含于化学量测数据内部规律的一种多元分析技术,已被广泛应用于中药材及中药制剂的质量评价[11]。
目前,有关半枝莲标准汤剂的研究较少,大多为半枝莲饮片标准汤剂中野黄芩苷、野黄芩素的含量测定[12]。半枝莲中的黄酮类成分为其主要活性成分,具有显著的抗氧化活性[13],但尚未有半枝莲标准汤剂中各成分与其抗氧化活性的相关性研究;加之半枝莲在临床主要以水煎服,而中药水煎剂大多具有作用机制复杂、作用靶点多样、成分不确定等特点[8],且煎煮过程中的不稳定因素较多[7,14],故为保证临床用药的一致性,对半枝莲标准汤剂进行全面的质量控制就显得尤为重要。基于此,本研究采用紫外-可见分光光度法测定了半枝莲标准汤剂中总黄酮的含量(以野黄芩苷计),同时以体外抗氧化作用为主要药效基础,筛选半枝莲标准汤剂中与抗氧化活性潜在相关的主要化学成分,采用高效液相色谱(high performance liquid chromatography,HPLC)法建立其指纹图谱,并以筛选出的化学成分为变量进行聚类分析和主成分分析,旨在为半枝莲标准汤剂的质量控制提供参考。
1 材料
1.1 主要儀器
本研究所用主要仪器有1220 infinity Ⅱ型液相色谱仪及配备的双柱塞串联泵、真空在线脱气机、自动进样器、柱温箱、二极管阵列检测器、标准流通池(美国Agilent公司),UV-2600 Probe型紫外-可见分光光度计(日本Shimadzu公司),AG-245型十万分之一分析天平(瑞士Mettler Toledo公司),KQ-700型超声波清洗器(昆山市超声仪器有限公司),HC-2062型高速离心机(科大创新股份有限公司中佳分公司),Multiskan FC型酶标仪(美国Thexmo Fisher Scientific公司),JA2003型电子分析天平(苏州德汇科学仪器有限公司),ZDHW型调温电热套(北京中兴伟业仪器有限公司)等。
1.2 主要药品与试剂
维生素C对照品(批号J1024A,纯度>99.0%)、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis(3-ethylbenzothiazoline-6-sulfonic acid)ammonium salt,ABTS,批号M0403A]均购自昆明泽浩科技有限公司;野黄芩苷对照品(批号18032206,纯度≥98%)购自成都普菲德生物技术有限公司;野黄芩素对照品(批号140107,纯度≥98%)、芹菜素对照品(批号140224,纯度≥98%)均购自上海融禾医药科技发展有限公司;木犀草素对照品(纯度≥98%,HPLC法)由承德医学院崔凤侠教授于北京大学医学部制得;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)自由基(批号464RB-GE)购自梯希爱(上海)化成工业发展有限公司;过硫酸钾(K2S2O8,批号181027)购自天津市欧博凯化工有限公司;甲醇、乙腈均为色谱纯,冰醋酸、甲醇均为分析纯,水为纯净水。
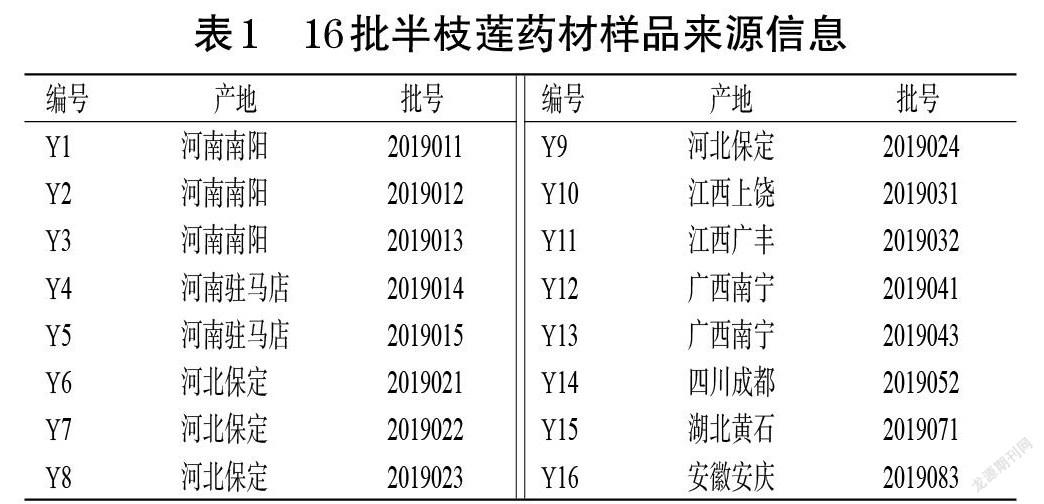
16批半枝莲药材(编号Y1~Y16)于2019年购自河北安国中药材市场,经承德民族师范学院生物系董建新教授鉴定为唇形科植物半枝莲S. barbata D. Don的干燥全草。16批半枝莲药材样品来源信息见表1。
2 方法与结果
2.1 半枝莲标准汤剂的制备
取洗净、充分干燥后的半枝莲药材 100 g,精密称定,置于煎药锅中,加水1 200 mL,浸泡30 min,武火煮沸后,文火保持微沸30 min,趁热用3层纱布滤过;残渣加水1 000 mL,武火煮沸后,文火保持微沸20 min,趁热用3层纱布滤过;合并2次滤液,于60 ℃减压浓缩至500 mL,即得[14],共制备16批(编号S1~S16)。
2.2 半枝莲标准汤剂中总黄酮含量的测定
2.2.1 对照品溶液的制备 取野黄芩苷对照品适量,精密称定,加60%甲醇溶解并稀释,制成质量浓度为1.053 mg/mL的对照品溶液。
2.2.2 供试品溶液的制备 取“2.1”项下半枝莲标准汤剂,滤过,精密移取滤液1 mL,置于100 mL量瓶中,加60%甲醇稀释至刻度,摇匀,即得。
2.2.3 检测波长的确定 按2020年版《中国药典》(一部)“半枝莲”项下总黄酮含量测定方法操作[2]:取上述对照品溶液、供试品溶液(编号S1),以60%甲醇为空白对照,使用紫外-可见分光光度计于200~600 nm波长内进行扫描。结果显示,在335 nm波长处,对照品溶液、供试品溶液均有最大吸收,且空白对照无干扰(图1),故选择检测波长为335 nm。
2.2.4 线性关系考察 精密量取“2.2.1”项下对照品溶液0.1、0.2、0.3、0.5、1.0 mL,分别置于50 mL量瓶中,加60%甲醇稀释至刻度,搖匀,即得系列线性工作溶液。以60%甲醇为空白对照,使用紫外-可见分光光度计于335 nm波长处测定吸光度。以对照品的质量浓度(c)为横坐标、吸光度(A)为纵坐标进行线性回归。结果显示,野黄芩苷的回归方程为A=27.604c-151.63(R 2=0.999 3),表明野黄芩苷检测质量浓度的线性范围为2.106~21.06 μg/mL。
2.2.5 精密度试验 精密量取“2.2.1”项下对照品溶液0.3 mL,置于50 mL量瓶中,加60%甲醇稀释至刻度,摇匀。以60%甲醇为空白对照,使用紫外-可见分光光度计于335 nm波长处连续测定吸光度6次。结果显示,对照品溶液吸光度的RSD为0.06%(n=6),表明仪器精密度良好。
2.2.6 稳定性试验 取“2.2.2”项下供试品溶液(编号S1),分别在室温下放置0、20、40、60、80、100、120 min时,以60%甲醇为空白对照,使用紫外-可见分光光度计于335 nm波长处测定吸光度。结果显示,待测样品吸光度的RSD为1.80%(n=7),表明供试品溶液于室温下放置120 min内稳定性良好。
2.2.7 重复性试验 取“2.1”项下半枝莲标准汤剂(编号S1),共6份,按“2.2.2”项下方法制备供试品溶液,以60%甲醇为空白对照,使用紫外-可见分光光度计于335 nm波长处测定吸光度并按标准曲线法计算样品含量。结果显示,总黄酮含量的RSD为1.85%(n=6),表明方法重复性良好。
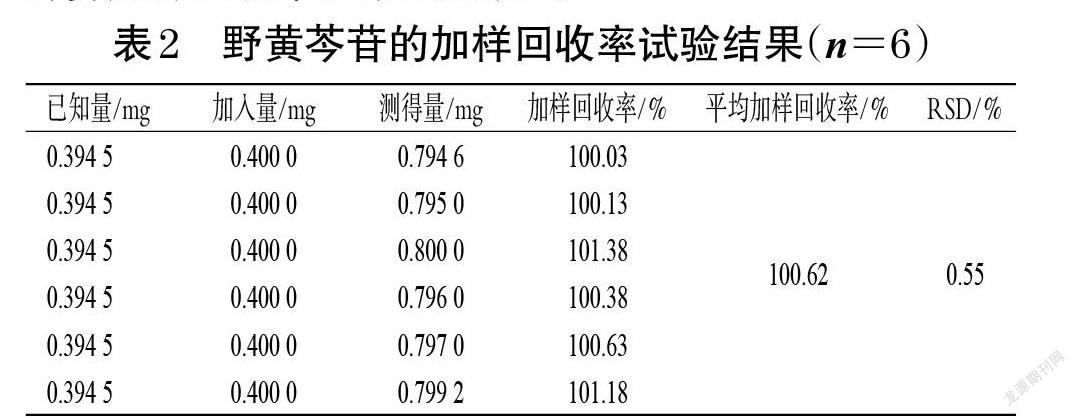
2.2.8 加样回收率试验 精密量取已知含量的半枝莲标准汤剂(编号S1),每份0.5 mL,共6份,精密称定,分别精密加入一定量的“2.2.1”项下对照品溶液,按“2.2.2”项下方法制备供试品溶液,以60%甲醇为空白对照,使用紫外-可见分光光度计于335 nm波长处测定吸光度并计算加样回收率。结果见表2。
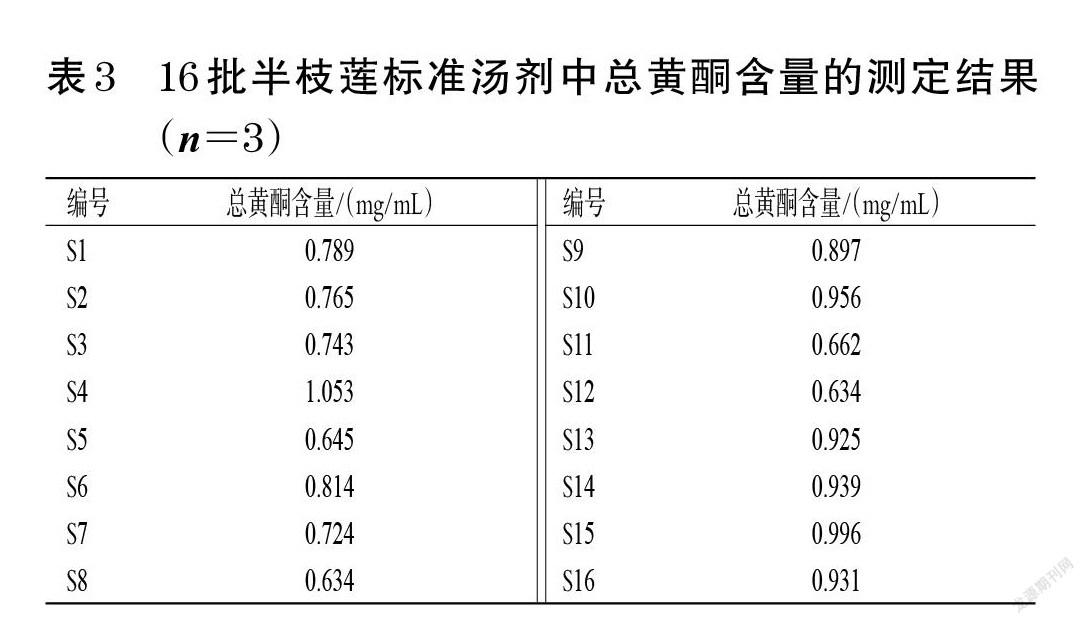
2.2.9 样品含量测定 取16批“2.1”项下半枝莲标准汤剂,按“2.2.2”项下方法制备供试品溶液,以60%甲醇为空白对照,使用紫外-可见分光光度计于335 nm波长处测定吸光度并按标准曲线法计算样品含量,每样品平行测定3次。结果见表3。
2.3 体外抗氧化活性的测定
2.3.1 阳性对照溶液的制备 精密称取维生素C对照品48.4 mg,置于10 mL量瓶中,加水溶解并定容,摇匀,即得质量浓度为4.84 mg/mL的阳性对照溶液。
2.3.2 DPPH自由基溶液的制备 精密称定DPPH12.0 mg,置于100 mL量瓶中,加70%乙醇溶解并定容,摇匀,即得质量浓度为0.12 mg/mL的DPPH自由基溶液。
2.3.3 ABTS自由基溶液的制备 精密称定ABTS 41.0 mg、K2S2O8 18.0 mg,分别置于10 mL量瓶中,加水溶解并定容,得ABTS贮备液和K2S2O8贮备液;分别精密吸取上述单一贮备液各2.5 mL,置于100 mL量瓶中,加水定容,摇匀,即得ABTS自由基溶液,避光储存12~16 h,备用。
2.3.4 样品溶液的制备 取16批“2.1”项下半枝莲标准汤剂,滤过,取续滤液,即得样品溶液。取上述样品溶液,加水稀释,制得质量浓度(以生药量计)分别为0.50、0.75、1.00、1.50、2.50、3.75、5.00 mg/mL的系列样品溶液A,用于DPPH自由基清除率的测定;同法制得质量浓度(以生药量计)分别为0.50、0.75、1.00、1.25、1.50、2.00、2.50 mg/mL的系列样品溶液B,用于ABTS自由基清除率的测定。
2.3.5 DPPH自由基清除率的测定 取“2.3.1”项下阳性对照溶液、“2.3.4”项下系列样品溶液A各50 μL,加至96微孔板中,再加入“2.3.2”项下DPPH自由基溶液100 μL,避光反应30 min后,使用酶标仪于517 nm波长处测得吸光度(A);用水代替样品溶液,同法测得吸光度(B)。按公式计算DPPH自由基清除率:DPPH自由基清除率=
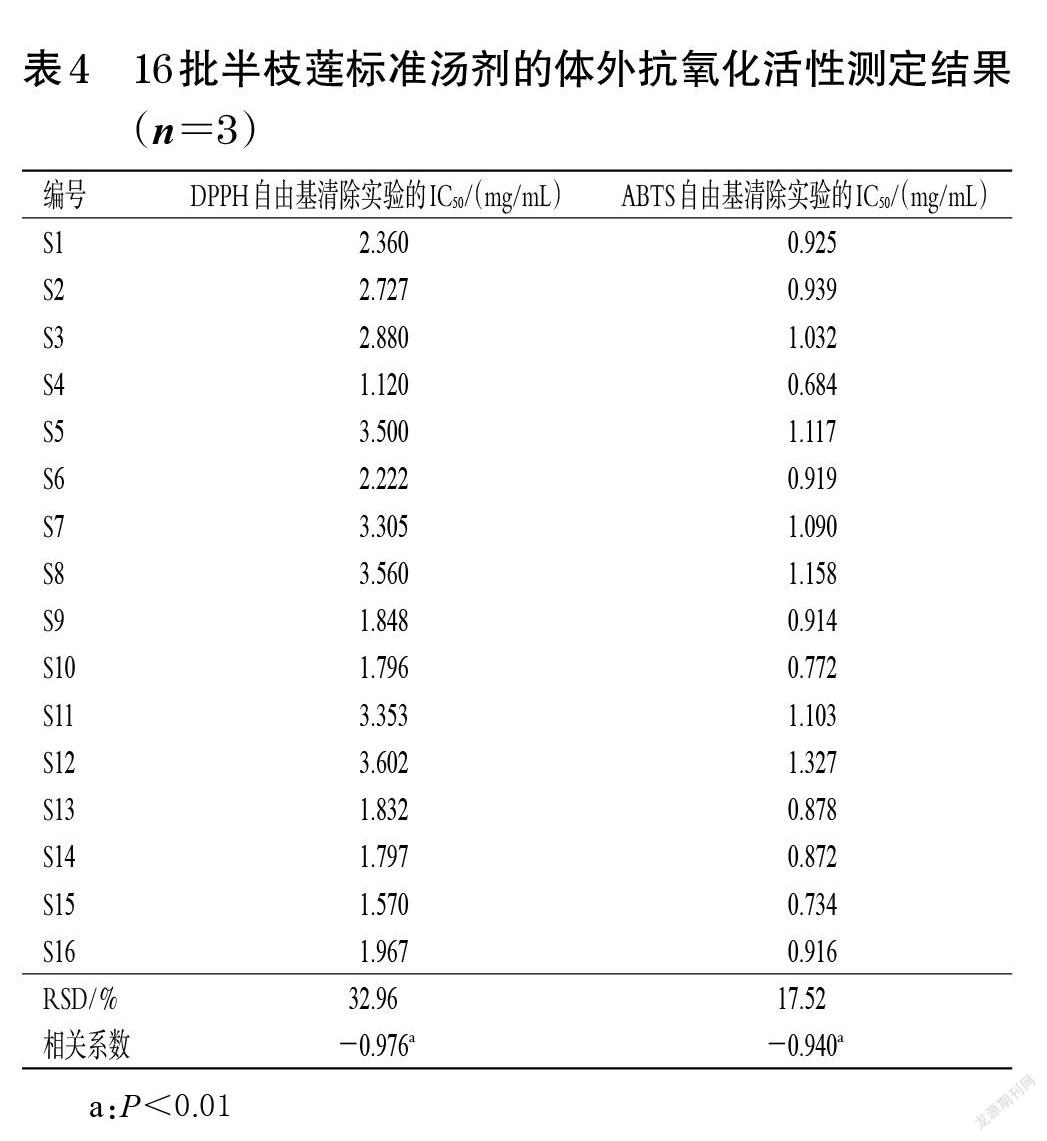
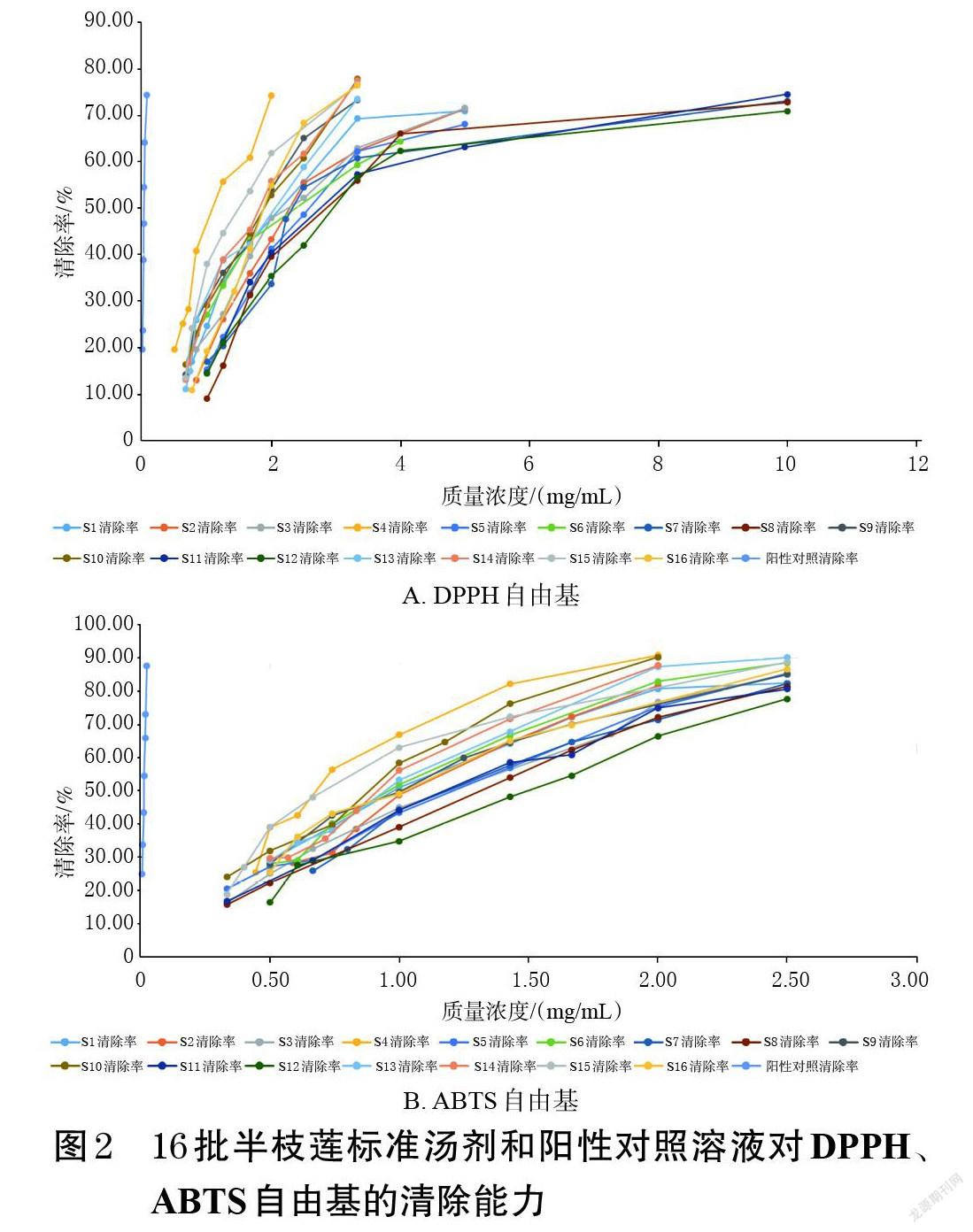
[(B-A)/B]×100%[15]。每样品平行操作3次,取平均值。由于各批半枝莲标准汤剂对DPPH自由基的清除率与其质量浓度不成线性关系,因此采用SPSS 24.0软件中的Probit方法对DPPH自由基清除率进行回归分析。结果显示,拟合后的方程为Probit(P)=Intercept+Bx(式中,Intercept表示截距,B表示斜率,P为DPPH自由基清除率,x为半枝莲标准汤剂稀释后的质量浓度;Probit=0.50时,半枝莲标准汤剂的相应浓度以生药量计)。经χ 2检验后,得到半数抑制浓度(median inhibitory concentration,IC50),其值越小表示半枝莲标准汤剂的体外抗氧化活性越强[10]。结果见表4、图2A。
2.3.6 ABTS自由基清除率的测定 取“2.3.1”项下阳性对照溶液、“2.3.4”项下系列样品溶液B各50 μL,加至96微孔板中,再加入“2.3.3”项下ABTS自由基溶液100 μL,避光反应6 min后,使用酶标仪于734 nm波长处测定吸光度(A);用水代替样品溶液,同法测定吸光度(B)。按“2.3.5”项下公式及方法计算ABTS自由基清除率的IC50[15]。每样品平行操作3次,取平均值。结果见表4、图2B。
2.3.7 相关性分析 采用SPSS 24.0软件以Pearson相关性分析评价半枝莲标准汤剂中总黄酮含量与IC50的相关性,结果见表4。由表4可知,半枝莲标准汤剂中总黄酮的含量与DPPH、ABTS自由基清除实验的IC50均呈负相关(P<0.01),相关系数分别为-0.976、-0.940,表明半枝莲标准汤剂中总黄酮含量越高,其体外抗氧化活性越强。
2.4 半枝莲标准汤剂HPLC指纹图谱的建立
2.4.1 色谱条件 以ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm)為色谱柱,以0.1%冰醋酸溶液为流动相(A)、甲醇-乙腈混合溶液(8 ∶ 2,V/V)为流动相(B)进行梯度洗脱(0~20 min,10%B→28%B;20~30 min,28%B→35%B;30~40 min,35%B→40%B;40~50 min,40%B→50%B;50~60 min,50%B→70%B);检测波长为335 nm;流速为1 mL/min;柱温为30 ℃;进样量为10 μL。
2.4.2 供试品溶液的制备 取“2.1”项下半枝莲标准汤剂,滤过,精密移取滤液10 mL,置于25 mL量瓶中,加水稀释至刻度,摇匀,精密移取5 mL,置于10 mL量瓶中,加甲醇稀释至刻度,混匀,以12 000 r/min离心10 min,经0.45 μm微孔滤膜滤过,取续滤液,即得。
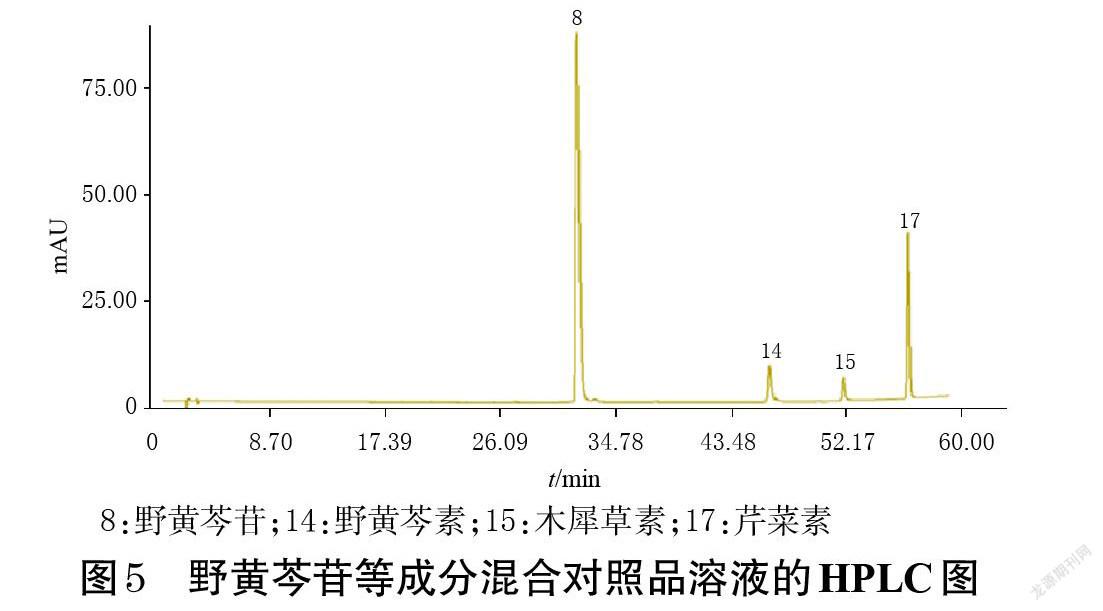
2.4.3 混合对照品溶液的制备 精密称取野黄芩苷、芹菜素、野黄芩素、木犀草素对照品适量,置于100 mL量瓶中,加60%甲醇溶解并定容,混匀,制成上述成分质量浓度分别为77.5、7.5、8.6、30.0 μg/mL的混合对照品溶液。
2.4.4 精密度试验 取“2.4.2”项下供试品溶液(编号S1),按“2.4.1”项下色谱条件连续进样测定6次,记录色谱图。以野黄芩苷峰为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,18个共有峰相对保留时间和相对峰面积的RSD均小于2.50%(n=6),表明方法精密度良好。
2.4.5 稳定性试验 取“2.4.2”项下供试品溶液(编号S1),分别于室温下放置0、2、4、8、12、24 h时按“2.4.1”项下色谱条件进样测定,记录色谱图。以野黄芩苷峰为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,18个共有峰相对保留时间和相对峰面积的RSD均小于3.00%(n=6),表明供试品溶液于室温下放置24 h内稳定性良好。
2.4.6 重复性试验 取半枝莲药材(编号S1),共6份,按“2.1”项下方法制备半枝莲标准汤剂,按“2.4.2”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件进样测定,记录色谱图。以野黄芩苷峰为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,18个共有峰相对保留时间和相对峰面积的RSD均小于3.00%(n=6),表明方法重复性良好。
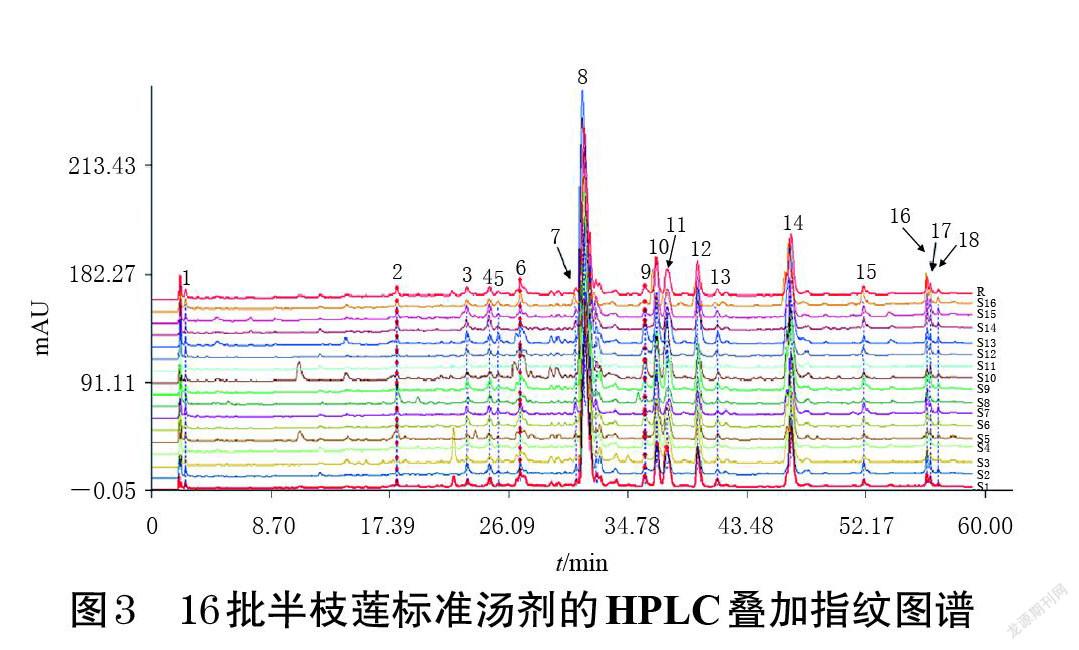
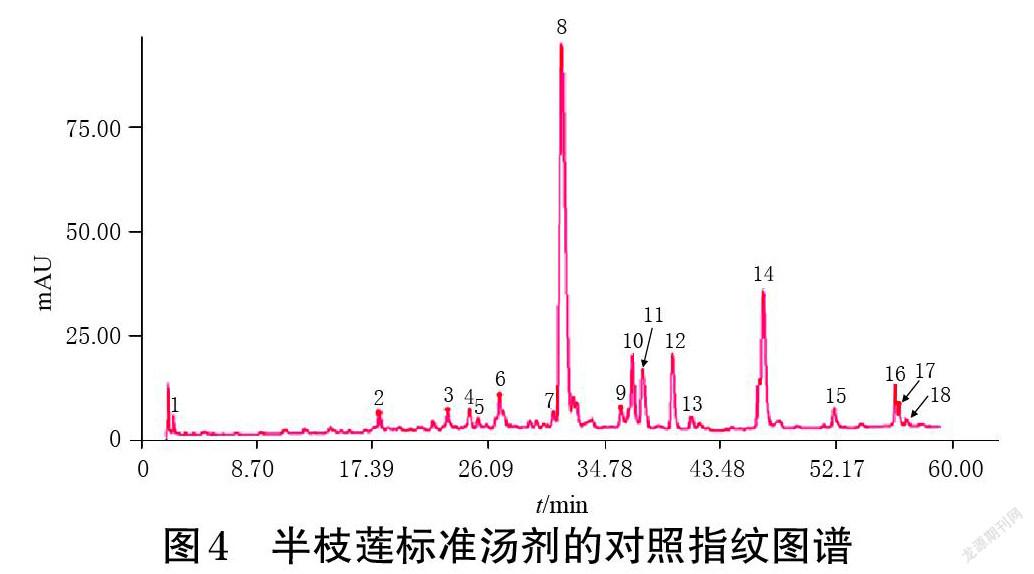
2.4.7 指纹图谱的建立 取16批半枝莲药材,按“2.1”项下方法制备半枝莲标准汤剂,按“2.4.2”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件进样测定,将16批半枝莲标准汤剂的色谱图导入《中药色谱指纹图谱相似度评价系统(2004A版)》进行分析,以各色谱峰保留时间及峰面积适中的S1样品为参照,设定时间窗宽度为0.20,以中位数法生成对照指纹图谱,采用多点校正法生成叠加指纹图谱。结果显示,16批半枝莲标准汤剂共有18个共有峰,其HPLC叠加指纹图谱见图3,对照指纹图谱见图4。
2.4.7 共有峰指认 取“2.4.3”项下混合对照品溶液,按“2.4.1”项下色谱条件进样测定,得混合对照品溶液的HPLC图(图5)。将对照指纹图谱(图4)与该图进行比对,共指认4个共有峰,分别为野黄芩苷(8号峰)、野黄芩素(14号峰)、木犀草素(15号峰)、芹菜素(17号峰)。
2.4.8 相似度评价与共有峰峰面积差异分析 采用《中药色谱指纹图谱相似度评价系统(2004A版)》进行相似度评价。结果显示,16批半枝莲标准汤剂指纹图谱与对照指纹图谱的相似度分别为0.994、0.996、0.992、0.996、0.989、0.993、0.964、0.994、0.997、0.982、0.996、0.982、0.993、0.993、0.990、0.965,均大于0.96,表明不同批次半枝莲标准汤剂所含主要成分的种类基本一致。16批半枝莲标准汤剂共有峰峰面积的RSD为20.52%~68.66%,表明不同批次半枝莲标准汤剂所含主要成分的含量存在一定差异。结果见表5。
2.5 体外抗氧化活性相关化学成分的筛选
以16批半枝莲标准汤剂的DPPH、ABTS自由基清除实验的IC50为因变量,共有峰峰面积为自变量,采用SPSS 24.0软件进行Pearson相关性分析。结果显示,半枝莲标准汤剂的HPLC指纹图谱中3~4、8~9、12~15、17号峰峰面积与DPPH、ABTS自由基清除实验的IC50均呈负相关(P<0.05或P<0.01),相关系数为-0.811~-0.555;同时,结合“2.3.7”项下结果可知,半枝莲标准汤剂中总黄酮含量与DPPH、ABTS自由基清除实验的IC50均呈负相关,表明半枝莲标准汤剂中的3~4、8~9、12~15、17号峰以及总黄酮是半枝莲标准汤剂清除DPPH自由基和ABTS自由基的潜在物质基础。结果见表6。
2.6 聚类分析
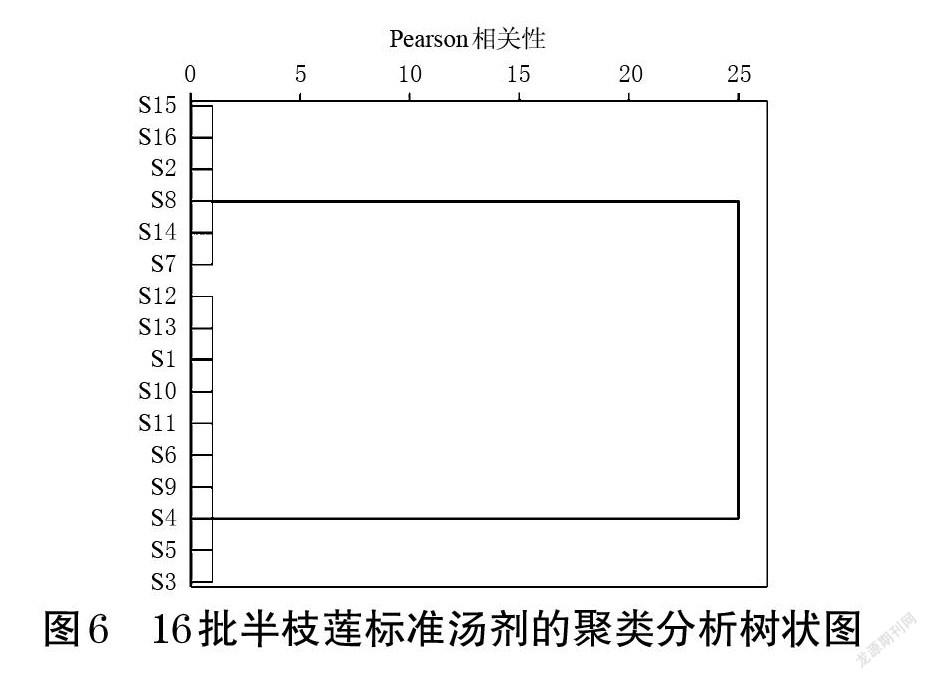
以16批半枝莲标准汤剂指纹图谱中3~4、8~9、12~15、17号峰峰面积及总黄酮含量为变量,采用组间连接聚类法,以Pearson相关性为度量标准,使用SPSS 24.0软件进行聚类分析。结果显示,16批半枝莲标准汤剂可聚为两类,其中S2、S7~S8、S14~S16为一类,S1、S3~S6、S9~S13为一类。结果见图6。
2.7 主成分分析
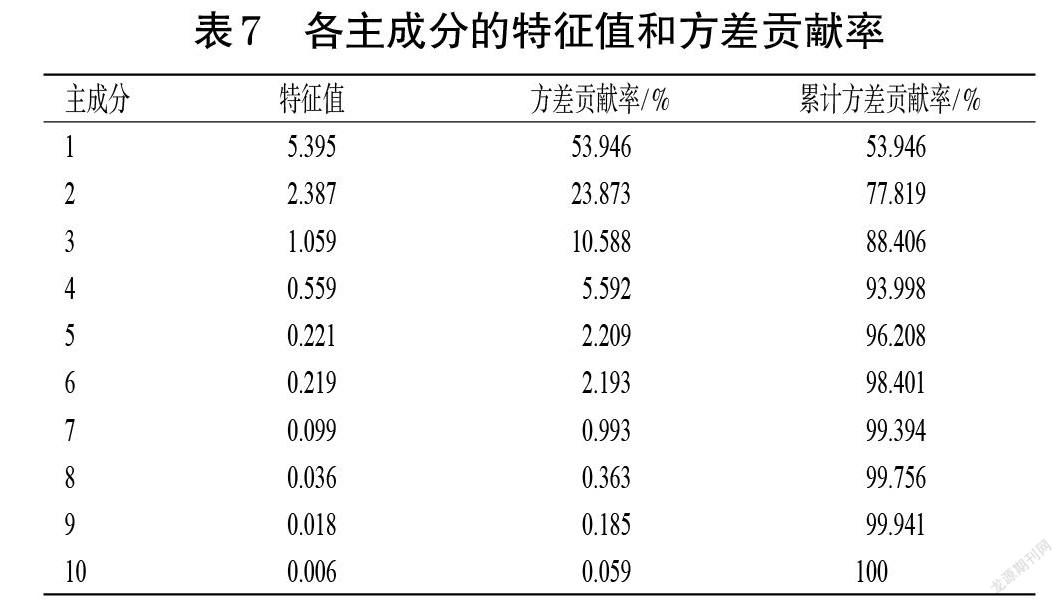
以16批半枝莲标准汤剂HPLC指纹图谱中3~4、8~9、12~15、17号峰峰面积及总黄酮含量为变量,采用SPSS 24.0软件进行主成分分析。结果显示,KMO检验和Bartlett检验的KMO度量值为0.576(P<0.001),提示各变量间存在显著相关性,可进行主成分分析。前3个主成分的特征值均大于1,累计方差贡献率为88.406%,表明前3个主成分可以代表半枝莲标准汤剂中上述10个变量的大部分信息。结果见表7。
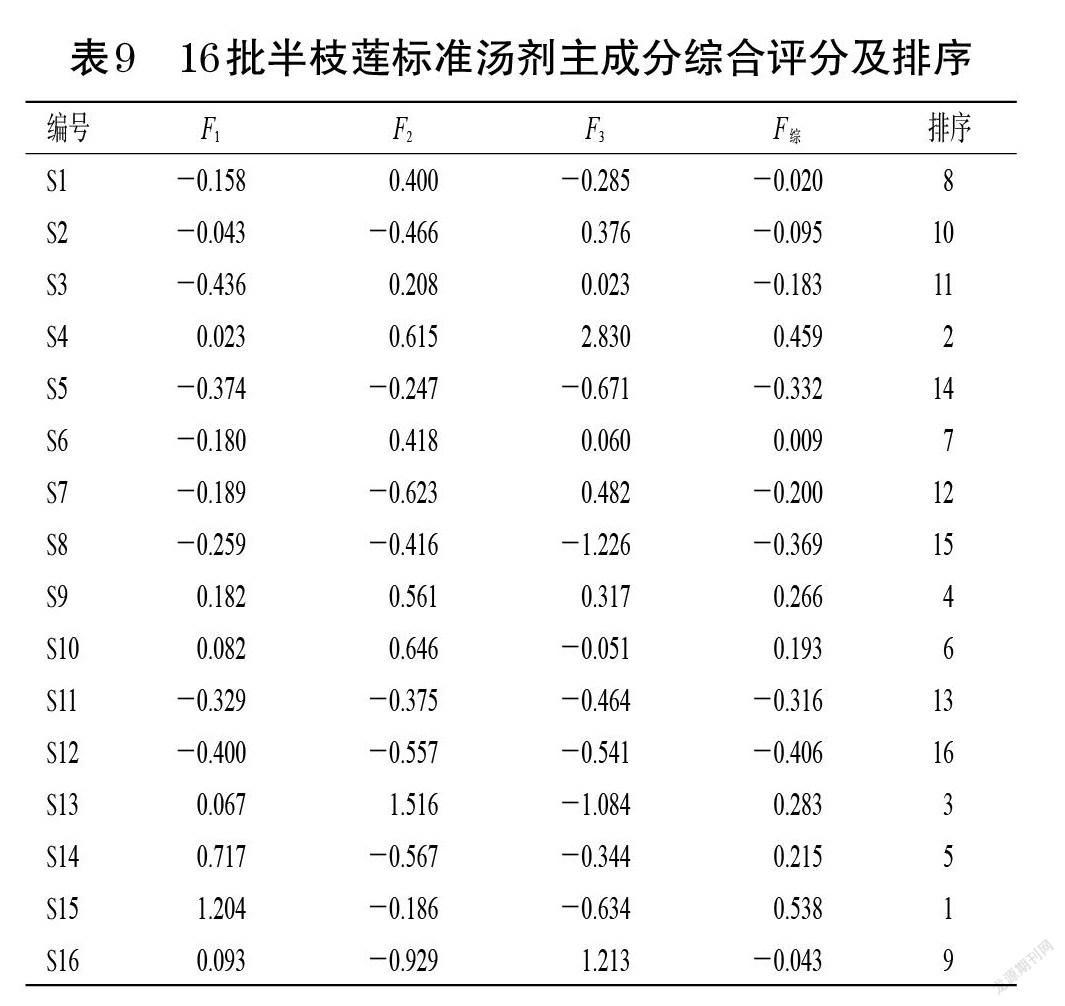
采用SPSS 24.0软件进行因子载荷矩阵分析。结果显示,主成分1与3~4、9、17号峰峰面积及总黄酮含量呈正相关;主成分2与3、8、12~14号峰峰面积及总黄酮含量呈正相关;主成分3与14~15、17号峰峰面积及总黄酮含量呈正相关。结果见表8。根据下式计算各主成分得分值:F=ZX×A(式中,F表示主成分得分,ZX表示原始数据标准化后得到的标准化矩阵,A表示标准化的正交特征向量矩阵);同时,结合各主成分贡献率建立综合评分(F综)模型:F综=0.539 46×F1+0.238 73×F2+0.105 88×F3。综合评分可反映半枝莲标准汤剂的整体质量,评分越高,则质量越好,体外抗氧化活性越强[11]。结果显示,S4、S13、S15样品综合评分较高,表明这3批半枝莲标准汤剂总体质量较好,体外抗氧化活性较强。结果见表9。
以16批半枝莲标准汤剂HPLC指纹图谱中3~4、8~9、12~15、17号峰峰面积及总黄酮含量为变量,采用SIMCA 14.1軟件绘制主成分分析得分图和载荷图。结果显示,第1、2、3主成分所反映的信息与上述主成分分析结果一致;16批半枝莲标准汤剂被分为两类,其中S2、S4、S7、S14~S16为Ⅰ类,S1、S3、S5~S6、S8~S13为Ⅱ类;结合载荷图可知,Ⅰ类样品中3~4、9、15、17号峰对应成分及总黄酮的含量较高,Ⅱ类样品中8、12~14号峰对应成分的含量较高。结果见图7。
3 讨论
本研究对16批半枝莲标准汤剂中的总黄酮含量进行了测定,参考2020年版《中国药典》(一部),以野黄芩苷为对照品,通过紫外吸收光谱扫描发现,野黄芩苷对照品和半枝莲标准汤剂供试品于335 nm波长处均有最大吸收,且空白对照无干扰,故选择335 nm为检测波长。16批半枝莲标准汤剂中总黄酮的含量为0.634~1.053 mg/mL,表明不同产地半枝莲中总黄酮含量差异较大,质量参差不齐,可能与药材的产地、采收、加工方式等因素不同有关[16]。
本研究通过DPPH、ABTS自由基清除实验,考察了16批半枝莲标准汤剂的体外抗氧化活性。结果显示,不同批次样品DPPH自由基清除实验的IC50为1.120~3.602 mg/mL,ABTS自由基清除实验的IC50为0.684~1.327 mg/mL,后者更小,表明半枝莲标准汤剂对ABTS自由基的清除能力相对较强。不同批次半枝莲标准汤剂DPPH自由基清除实验的IC50值、ABTS自由基清除实验的IC50值的RSD分别为32.96%、17.52%,表明不同批次半枝莲标准汤剂的体外抗氧化活性差异较大,可能与不同批次半枝莲药材的内在质量不一致有关。
本研究建立了16批半枝莲标准汤剂的指纹图谱,相似度均大于0.96,共有峰峰面积的RSD为20.52%~68.66%,表明不同批次半枝莲药材所含化学成分种类基本一致,但含量差异较大,可能与产地、贮藏等因素的不同导致各批药材内在质量存在差异有关[17]。
本研究将16批半枝莲标准汤剂的体外抗氧化活性测定结果与其指纹图谱中的18个共有峰峰面积及总黄酮含量进行Pearson相关性分析。结果显示,3~4、8~9、12~15、17号峰对应成分及总黄酮是与DPPH自由基和ABTS自由基清除有关的潜在物质,其中野黄芩苷(8号峰)、野黄芩素(14号峰)、木犀草素(15号峰)、芹菜素(17号峰)及总黄酮的抗氧化活性已有文献报道[18-23],可考虑在后续研究中进一步优化实验条件,将野黄芩苷、野黄芩素、木犀草素、芹菜素及总黄酮含量作为评价半枝莲标准汤剂质量的指标。本研究以3~4、8~9、12~15、17号峰峰面积及总黄酮含量为变量进行聚类分析和主成分分析。聚类分析结果显示,16批半枝莲标准汤剂可聚为两类,其中S2、S7~S8、S14~S16为一类,S1、S3~S6、S9~S13为一类;主成分分析结果显示,16批半枝莲标准汤剂分为两类,其中S2、S4、S7、S14~S16为Ⅰ类,S1、S3、S5~S6、S8~S13为Ⅱ类,Ⅰ类样品中3~4、9、15、17号峰对应成分及总黄酮的含量较高,Ⅱ类样品中8、12~14号峰对应成分的含量较高。综合评分排序结果显示,16批半枝莲标准汤剂的综合评分排序与其体外抗氧化活性趋势基本一致,表明综合评分模型可用于评价半枝莲标准汤剂的整体质量。
综上所述,所建HPLC指纹图谱及化学模式识别分析方法可用于评价半枝莲标准汤剂的质量;3~4、8~9、12~15、17号峰对应成分及总黄酮是半枝莲标准汤剂清除DPPH自由基和ABTS自由基的潜在物质基础。
参考文献
[ 1 ] 李娜,王平,孙铁锋,等.半枝莲化学成分、药理作用及质量控制研究进展[J].中国中药杂志,2020,45(21):5117- 5128.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2020:122-123.
[ 3 ] 吴晓龙,崔思远,王琰,等.中药半枝莲有效成分抗肿瘤作用机制研究进展[J].中华中医药杂志,2018,33(4):1459-1462.
[ 4 ] 莫宗成,王敏,罗先钦,等.白花蛇舌草半枝莲配伍抗肿瘤作用研究[J].天然产物研究与开发,2016,28(2):210- 215.
[ 5 ] 石梦莹,卢小路,熊思会,等.半枝莲抗肿瘤药理研究进展[J].世界中医药,2016,11(4):741-743.
[ 6 ] 李艳,白明,宋亚刚,等.中药标准汤剂的研究与思考[J].中草药,2018,49(17):3977-3980.
[ 7 ] 代云桃,靳如娜,吴治丽,等.基于标准汤剂(物质基准)的经典名方制备工艺和质量标准研究[J].中国实验方剂学杂志,2020,26(2):164-174.
[ 8 ] HUANG Z Q,CHEN P,SU W W,et al. Antioxidant activity and hepatoprotective potential of quercetin 7-rhamnoside in vitro and in vivo[J]. Molecules,2018,23(5):1188.
[ 9 ] 国家药品监督管理局.关于发布《中药配方颗粒质量控制与标准制定技术要求》的通告[EB/OL].[2022-01-05].http://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210210145-
45318.html.
[10] 李艳荣,周维维,王子怡,等.山楂叶提取物抗氧化活性及谱效关系研究[J].中国药学杂志,2020,55(20):1673- 1679.
[11] 王琪,李晓琦,黄萌萌,等.基于指纹图谱及多成分含量的化学模式识别法评价不同产地栀子药材的质量[J].中草药,2019,50(11):2690-2699.
[12] 田宇柔,冯玉,麻景梅,等.半枝莲饮片标准汤剂质量评价体系的建立[J].中药新药与临床药理,2019,30(7):851- 857.
[13] 汪琛媛,段贤春,李瑛,等.半枝莲黄酮类化学成分分析[J].安徽医学,2019,40(8):848-851.
[14] 杨立伟,王海南,耿莲,等.基于标准汤剂的中药整体质量控制模式探讨[J].中国实验方剂学杂志,2018,24(8):1-6.
[15] SHENG J W,SUN Y L. Antioxidant properties of different molecular weight polysaccharides from Athyrium mul- tidentatum(Doll.)Ching[J]. Carbohyd Polym,2014,108:41-45.
[16] 夏云岭,张振凌,张洪坤,等. HPLC法同时测定半枝莲饮片中4种黄酮类成分的含量及主成分分析[J].中国药房,2019,30(20):2839-2844.
[17] 郑孟凯,唐映红,陈建真,等.基于HPLC指纹图谱及主成分分析、聚类分析研究不同地区市售麻黄药材的质量差异[J].中华中医药杂志,2016,31(4):1420-1426.
[18] 姜蔚.野黄芩苷药理作用及机制研究进展[J].中国药理学通报,2018,34(12):1634-1637.
[19] 王晶.黄芩素和野黄芩素的合成及其抗氧化性研究[D].无锡:江南大学,2012.
[20] 王继双,何焱,张文静,等.木犀草素的药理作用研究进展[J].生命科学,2013,25(6):560-565.
[21] 姚芳芳,张锐,傅瑞娟,等.槲皮素和芹菜素对高尿酸血症大鼠血尿酸及抗氧化能力的影响[J].食品科学,2011,32(5):287-290.
[22] 廖月霞.半枝蓮黄酮活性成分双向调节肿瘤免疫作用及机制[D].扬州:扬州大学,2014.
[23] 焦燕.半枝莲中黄酮类成分的研究[D].北京:首都师范大学,2009.
(收稿日期:2021-08-26 修回日期:2021-12-23)
(编辑:陈 宏)

