耻垢分枝杆菌MSMEG_4259的基因组维护功能研究
邓茗芝,许原原,吕亮东
复旦大学上海医学院基础医学院教育部/卫健委/医科院医学分子病毒学重点实验室,上海 200032
结核病(tuberculosis)是由结核分枝杆菌(Mycobacteriumtuberculosis)引起的传染性疾病,为全球十大死因之一[1]。近年来,随着耐药结核病患者的不断增多,结核病的防治形势越发严峻。现有研究表明,结核分枝杆菌不存在基因间水平转移,其耐药性的产生均由基因组突变所致[2]。因此,阐明结核分枝杆菌DNA复制与修复的机制对于深入认识结核分枝杆菌的致病机理和耐药性形成具有重要意义。Rv2191基因及其同源基因广泛存在于分枝杆菌属中,而大肠埃希菌中不存在该同源基因。由于Rv2191蛋白包含DEDDh核酸外切酶结构域,曾被认为是DNA复制体校正亚基DnaQ的同源蛋白,但研究发现,分枝杆菌DnaQ不具备DNA复制的校对功能[3]。同时,有研究发现在结核分枝杆菌慢性感染兔模型中,Rv2191在潜伏感染和复燃阶段的表达显著上调,提示Rv2191可能与细菌的持留状态和复苏有关[4]。然而,目前对Rv2191蛋白的生理功能还不清楚。
本研究通过比较结核分枝杆菌Rv2191与耻垢分枝杆菌(Mycolicibacteriumsmegmatis)MSMEG_4259(Rv2191的同源物;以下简写为Ms4259)的氨基酸序列和结构域,发现两者具有高度同源性。因此,以耻垢分枝杆菌为模式,构建Ms4259基因敲除(ΔMs4259)菌株,比较分析野生型与ΔMs4259菌株的生长速率、利福平(rifampicin,RIF)耐药突变频率、突变谱、DNA损伤应答和对DNA损伤剂的耐受性,以研究Ms4259的生理功能和特性,从而发现Ms4259参与分枝杆菌基因组维护及DNA氧化损伤应答,为进一步研究分枝杆菌致病和耐药突变的形成奠定了基础。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒耻垢分枝杆菌mc2155菌株、大肠埃希菌DH5α菌株和质粒pYUB854均为本实验室保存。
1.1.2 主要试剂Middlebrook 7H9、7H10培养基购自美国BD公司;胶回收试剂盒、质粒提取试剂盒、Phase Lock Gel购自中国TIANGEN公司;限制性核酸内切酶、DNase Ⅰ、Q5超保真聚合酶购自美国NEB公司;RNA纯化试剂盒购自美国Thermo Fisher Scientific公司;RNA提取试剂TRIzol购自美国Ambion公司;SuperScriptTMⅣ反转录试剂盒购自美国Invitrogen公司;实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,qRT-PCR)试剂盒TB Green®Premix Ex TaqTMGC(Perfect Real Time)购自日本TaKaRa公司;常用抗生素购自美国Sigma公司。
1.2 方法
1.2.1 引物本研究所用引物如表1所示。
1.2.2 细菌培养大肠埃希菌采用 LB液体培养基(37 ℃、220 r/min)和 LB固体培养基 (37 ℃静置)分别培养12~18 h;耻垢分枝杆菌采用含0.2%甘油、0.05%吐温80的 Middlebrook 7H9液体培养基(37 ℃、100 r/min)和含0.2%甘油的Middlebrook 7H10固体培养基(37 ℃静置)分别培养2~3 d。
1.2.3 敲除菌株及回补菌株的构建利用同源重组方法进行基因敲除。以耻垢分枝杆菌mc2155的基因组DNA为模板,通过引物 Ms4259KO-F1/Ms4259KO-R1和Ms4259KO-F2/Ms4259KO-R2分别扩增上下臂,获得的PCR产物经酶切后依次连接至质粒pYUB854,采用噬菌体转导方法[5]将重组质粒导入耻垢分枝杆菌mc2155,获得ΔMs4259菌株。然后,利用引物4259testF/4259testR来验证Ms4259基因是否敲除成功。为了能够充分回补,通过分析耻垢分枝杆菌核糖体图谱[6], 选择较高转录水平的基因groL1的转录调控区域作为回补基因的表达元件。以Rpro-F/Rpro-R为引物,通过PCR扩增该基因本身的18 bp及前290 bp,将PCR产物连接至pMV361质粒,命名为pMV361-Rpro。用引物MS4259-F/MS4259-R扩增回补基因片段Ms4259,而后连接至质粒pMV361-Rpro。将构建好的回补质粒电击转化ΔMs4259感受态细胞,获得ΔMs4259+Ms4259回补菌株。
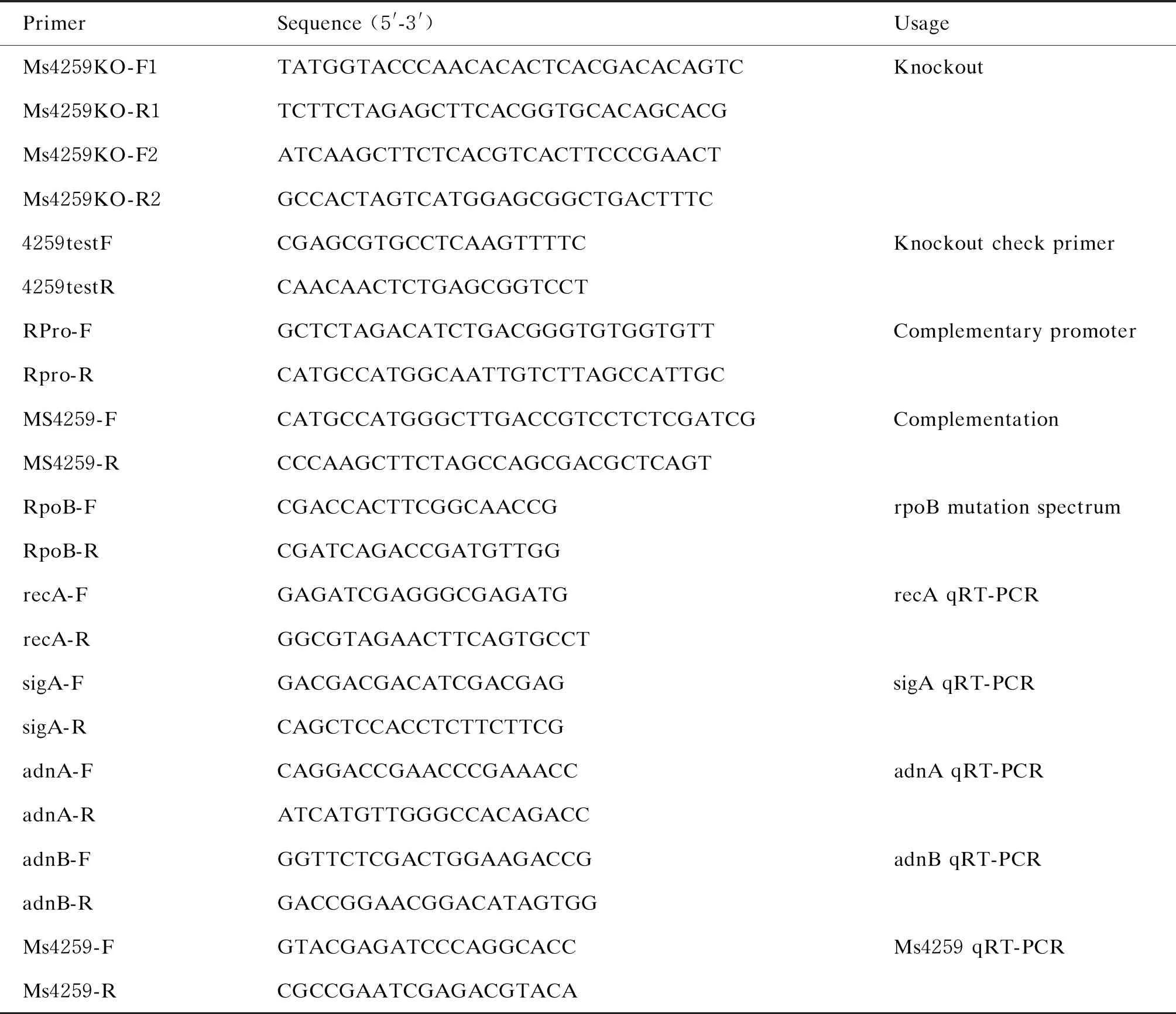
表1 PCR引物
1.2.4 生长曲线测定将 -80 ℃ 保存的野生型mc2155菌株与ΔMs4259菌株分别接种于2 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至稳定期。吹散混匀,以终吸光度值OD600=0.02接种于20 mL新鲜Middlebrook 7H9培养基,37 ℃、100 r/min 摇床培养。6 h后,每隔3 h测一次菌液OD600值,并记录汇总作图。
1.2.5 突变频率测定将-80 ℃保存的野生型mc2155菌株与ΔMs4259菌株分别接种于2 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至稳定期。以终OD600=0.02接种于10 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至OD600为0.6~0.8。用Middlebrook 7H9培养基稀释菌液至OD600=0.000 1,分装至30个细胞培养瓶(25 cm2),5 mL菌液/瓶,37 ℃、100 r/min培养至OD600值为0.6~1。吸取30 μL菌液,用含0.05%吐温80的磷酸盐缓冲液(phosphate buffered saline with 0.05% Tween 80,PBST)梯度稀释至105,分别吸取50 μL涂布于2个LBG平板(LB固体培养基+0.2%甘油),37 ℃培养3 d,记录单克隆数,并计算涂板菌液的菌落形成单位(colony forming unit,CFU)。CFU值=2×10×105×C,C为LBG平板长出的单菌落数。每个样品的2个LBG平板计算的CFU取平均值作为每1 mL涂板菌液的活菌数。将剩余菌液约4.5 mL转移至15 mL离心管,4 000 r/min离心6 min,收集菌体。将菌体用 100 μL Middlebrook 7H9培养基重悬,全部涂布于含有100 μg/mL利福平的Middlebrook 7H10平板,37 ℃ 培养4~5 d,记录单克隆数。利福平耐药突变频率=利福平平板上长出的单菌落数/计算的涂板菌液的总活菌数。
1.2.6 突变谱分析收集利福平耐药菌落,接种于200 μL含100 μg/mL利福平的Middlebrook 7H9培养基,37 ℃静置培养6~7 d。收集菌体,用200 μL ddH2O洗涤2次,重悬于20 μL ddH2O,98 ℃金属浴10 min以提取基因组DNA。4 000 r/min离心6 min,取上清液作为PCR模板,使用引物RpoB-F/RpoB-R扩增rpoB基因的I簇区域,PCR产物进行双向测序。
1.2.7 RNA提取将-80 ℃保存的野生型mc2155菌株与ΔMs4259菌株分别接种于2 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至稳定期。以OD600=0.02的浓度转接种子液至10 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至OD600值为0.6~0.8。室温、4 000 r/min离心5 min,收集菌体,用1 mL TRIzol[7]重悬,使TRIzol与细菌充分接触,将混合物转移至2 mL螺口管(含500 μL 0.1 mm二氧化锆珠),冰水浴3 min。均质仪裂解菌体步骤如下:5 000 r/min,破碎5次,每次35 s,冰上间隔至少1 min。破碎完成后,4 ℃、16 000 g离心5 min,吸取上层液体于Phase Lock Gel,加入300 μL氯仿,剧烈振荡20 s,室温放置10 min使之分层。4 ℃、16 000 g离心10 min,缓慢吸取上层溶液于新的1.5 mL离心管(RNase-free)中,加入等体积异丙醇,颠倒混匀10次,冰水浴30 min。4 ℃、20 000 g离心30 min,将沉淀物用1 mL预冷的70%乙醇洗涤1次。室温下干燥核酸沉淀,加入100 μL 1×DNase Ⅰ Buffer(含5 μL RNase-free DNase Ⅰ),37 ℃水浴30 min。最后利用RNA纯化试剂盒进行纯化,将获得的RNA保存于 -80 ℃。
1.2.8 qRT-PCR将提取的分枝杆菌RNA用SuperScriptTMⅣ First-strand Synthesis System试剂盒进行反转录,合成的cDNA用TB Green® Premix Ex TaqTMGC(Perfect Real Time)试剂盒进行 qRT-PCR,利用引物对sigA-F/sigA-R、recA-F/recA-R、adnA-F/adnA-R、adnB-F/adnB-R和Ms4259-F/Ms4259-R分别对sigA、recA、adnA、adnB和Ms4259基因进行检测和扩增。qRT-PCR的内参基因选用sigA,其转录在氧化压力条件下不受影响[8]。采用2-ΔΔCt法比较不同样本间目的基因的差异表达水平。ΔΔCt=(Ct处理样本目的基因-Ct处理样本内参基因) -(Ct对照样本目的基因-Ct对照样本内参基因)。
1.2.9 氧氟沙星杀菌曲线测定将 -80 ℃ 保存的野生型mc2155菌株与ΔMs4259菌株分别接种于2 mL Middlebrook 7H9培养基,37 ℃、100 r/min 培养至稳定期。以OD600=0.02转接种子液至10 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至OD600值为0.6~0.8。用Middlebrook 7H9培养基将菌液稀释至OD600=0.1,每个摇菌管分装1 mL,加入1.5 μg/mL氧氟沙星,于37 ℃恒温培养箱静置。在每个取样时间点吸取30 μL菌液于270 μL PBST中,梯度稀释,吸取5 μL点涂于LBG平板,37 ℃培养2~3 d,记录菌落数和稀释度,计算CFU值。CFU=2×100×a×c;其中a为稀释倍数,c为该稀释度下存活的单菌落数。
1.2.10 叔丁基过氧化氢(tert-butyl hydroperoxide,t-BHP)杀菌曲线测定将 -80 ℃ 保存的野生型mc2155菌株与ΔMs4259菌株分别接种于2 mL Middlebrook 7H9培养基,37 ℃、100 r/min 培养至稳定期。以菌液浓度OD600=0.02转接种子液至10 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至终浓度OD600值为0.6~0.8。每个摇菌管分装1 mL,加入1 mmol/L t-BHP,37 ℃、100 r/min振荡培养。在每个取样时间点吸取30 μL菌液于270 μL PBST中,梯度稀释,吸取5 μL点涂于LBG平板,37 ℃培养2~3 d,记录菌落数和稀释度,参照1.2.9小节方法计算CFU。
1.2.11 紫外线杀菌实验将-80 ℃保存的野生型mc2155菌株与ΔMs4259菌株分别接种于2 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至稳定期。以OD600=0.02的菌液浓度转接种子液至10 mL Middlebrook 7H9培养基,37 ℃、100 r/min培养至菌液浓度OD600值为0.6~0.8。用PBST调至菌液浓度OD600=0.1,梯度稀释至105,并点涂于不含抗生素的Middlebrook 7H10平板。待菌液晾干后,使用紫外交联仪(美国UVP公司,HL-2000)照射,紫外线辐射剂量为5、10、15、20 mJ/cm2。照射完毕,立即用铝箔纸包裹平板,于37 ℃培养箱避光培养2~4 d。记录平板上每个稀释梯度生长的单克隆数,计算CFU。
1.3 统计学分析
采用Graphpad Prism 8.0软件进行统计并作图。除rpoB突变谱分析使用卡方检验外,其余数据进行t检验,P<0.05为有统计学差异。
2 结果
2.1 分枝杆菌Ms4259的氨基酸序列分析
利用美国国家生物信息中心(National Center for Biotechnology Information,NCBI)生物大分子序列比对搜索工具BLAST比较耻垢分枝杆菌mc2155的Ms4259与结核分枝杆菌H37Rv的Rv2191的氨基酸序列,结果显示氨基酸序列一致性为64%,相似性为74%,表明两者具有高度同源性。因此,以耻垢分枝杆菌作为模式生物研究Ms4259的功能在一定程度上能够提示Rv2191在结核分枝杆菌中的作用(见图1)。利用生物信息学网站InterPro进行蛋白质功能预测和结构域注释,结果显示Ms4259含有一个在N端的DEDDh核酸外切酶结构域以及一个在C端的GIY-YIG核酸内切酶结构域, 后者为核苷酸切除修复途径中内切酶UvrC、Cho和类似蛋白所具有的催化结构域(见图1)。
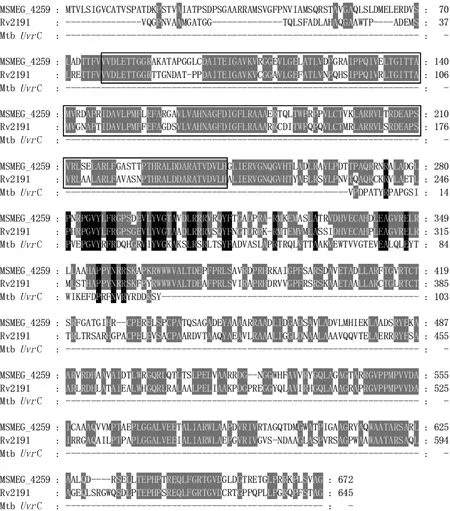
The black box is the DEDDh 3′-5′ exonuclease domain. Mtb UvrC is the N-terminal GIY-YIG endonuclease domain of Mycobacterium tuberculosis UvrC (residue 1-103).
2.2 Ms4259非耻垢分枝杆菌生长的必需基因
利用同源重组方法敲除耻垢分枝杆菌mc2155的Ms4259基因(见图2A),并用4259testF/4259testR引物验证基因敲除菌株的基因型。结果如图2B所示,野生型mc2155菌株能扩增出含目的基因Ms4259的片段(2 455 bp),ΔMs4259菌株能扩增出含hyg抗性基因的片段 (3 432 bp),空白对照无条带,证明ΔMs4259敲除菌株构建成功。通过测定野生型菌株和ΔMs4259菌株的生长曲线,发现两者生长能力没有差异(见图2C),提示Ms4259非耻垢分枝杆菌在富营养培养条件下生长的必需基因。

A: Schematic diagram of strain genotypes and process of construction. B: Verification of knockout strain by genotyping PCR with primer 4259testF and 4259testR. C: Growth curves of wild type and ΔMs4259 strains.
2.3 Ms4259参与分枝杆菌基因组稳定性的维护
氨基酸序列分析表明,Ms4259具有核酸外切酶和核酸内切酶结构域,提示其与DNA修复有关。为研究Ms4259对耻垢分枝杆菌基因组稳定性的影响,本研究测定了施加DNA损伤压力前后野生型菌株和ΔMs4259菌株的利福平耐药自发突变频率。图3A结果显示,在正常实验室条件培养下,与野生型菌株相比,ΔMs4259敲除菌株的利福平耐药自发突变频率升高约1.9倍(P<0.05),Ms4259回补菌株的自发突变频率无显著变化,即ΔMs4259敲除菌株的自发突变频率升高表型能通过表达野生型Ms4259来实现表型回补。用H2O2处理后,野生型菌株和ΔMs4259菌株自发突变频率分别升高约3.8和2.4倍(P<0.000 1),但两者之间无统计学差异。绝大多数利福平耐药突变发生在rpoB基因Ⅰ簇,因此本研究分别对野生型菌株和ΔMs4259菌株自发形成的利福平耐药菌落的rpoB基因Ⅰ簇区域进行测序。图3B结果显示,与野生型菌株相比,ΔMs4259菌株的A: T>C: G突变比率明显上升,增加约10倍。这些结果表明,Ms4259对维持分枝杆菌基因组的稳定性具有重要性。
2.4 Ms4259参与氧化损伤应答
利用荧光qRT-PCR来分析在正常生长状态和H2O2处理条件下野生型菌株和ΔMs4259菌株的DNA损伤修复基因表达情况。分枝杆菌的DNA损伤应答系统主要包括SOS应答途径以及PafBC介导的调控途径[9],本研究选用2个途径共同调控的recA以及单独被PafBC介导调控的adnA和adnB,作为DNA损伤应答基因[10]。结果显示,无论是在正常生长条件还是氧化压力条件下,野生型菌株与ΔMs4259菌株的DNA损伤修复基因转录水平无显著差异(见图4A)。用5 mmol/L H2O2处理30 min后,recA、adnA和adnB的转录情况在野生型菌株和ΔMs4259菌株中的上调水平相似,即两者在H2O2处理下具有相似的DNA损伤应答能力。此外,野生型菌株的Ms4259基因转录水平上调约7倍,表明Ms4259在转录水平参与了H2O2引起的氧化损伤应答(见图4B)。
2.5 Ms4259未参与耻垢分枝杆菌对DNA损伤剂的耐受
为进一步探讨Ms4259是否可介导耻垢分枝杆菌对 DNA 损伤剂的耐受, 本研究测定了野生型菌株和ΔMs4259菌株在不同DNA损伤剂处理下的存活率。氧氟沙星作为喹诺酮类杀菌药物,通过抑制DNA旋转酶来干扰DNA复制,从而达到杀菌效果。t-BHP是一种烷基氢有机过氧化物,能引起广泛的DNA氧化损伤。紫外线主要使同一条DNA链上的相邻嘧啶以共价键连成二聚体,从而导致DNA损伤。图5结果显示,野生型菌株与ΔMs4259菌株在氧氟沙星、t-BHP以及紫外线处理下的存活率无明显差异,提示Ms4259缺失不影响耻垢分枝杆菌对 DNA 损伤剂引起的 DNA 结构异常的耐受性。
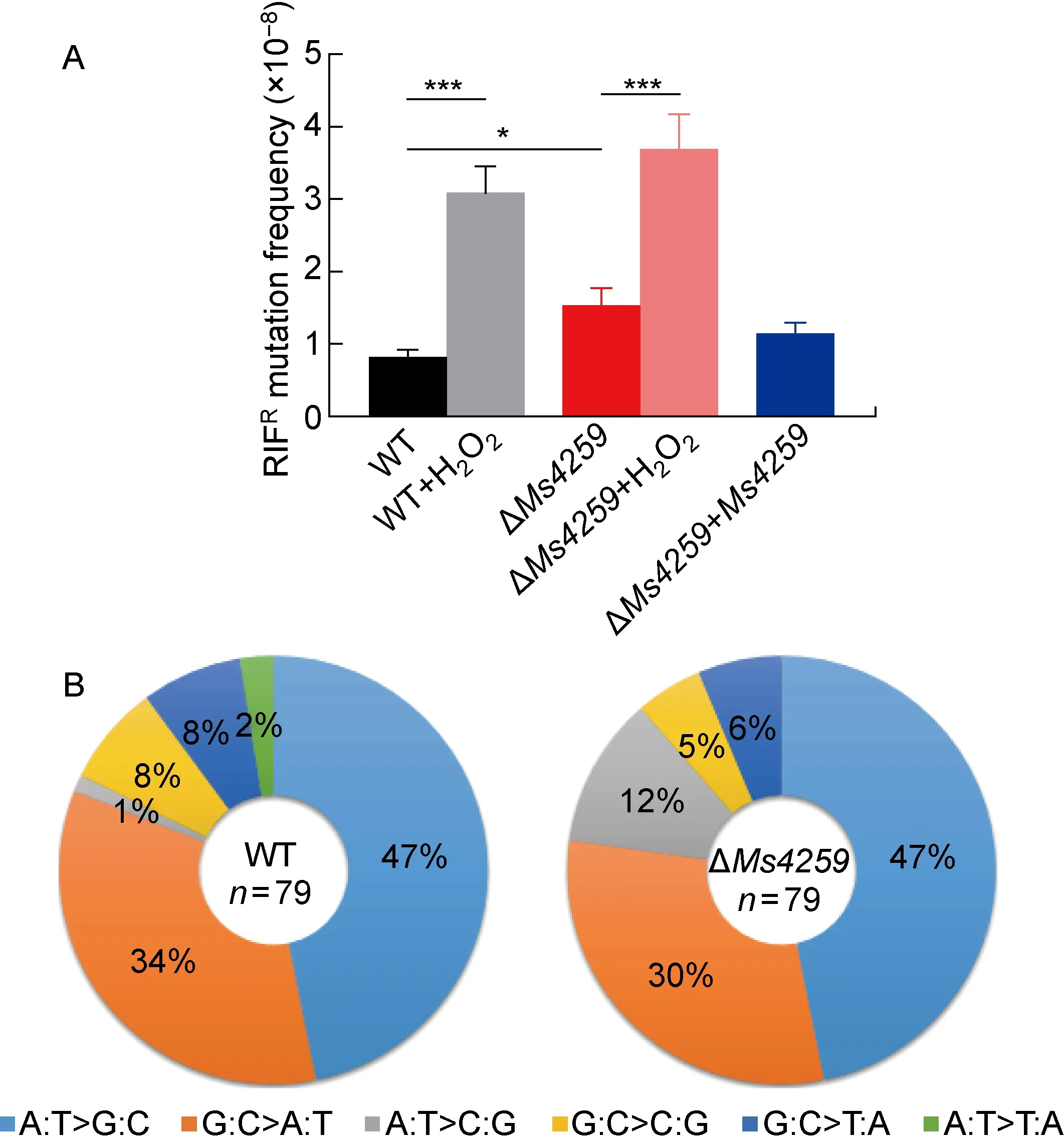
A: Spontaneous and H2O2-induced RIFR mutation frequency. Results shown are mean±SEM of at least 24 independent experiments. *P<0.05, ***P<0.001. B: Mutation spectra expressed in percentage relative to the total mutations identified in the cluster I region of rpoB gene. The number of RIFR colonies selected for sequencing were shown in the center of the ring.

A: qRT-PCR analyses of gene expression in logarithmic-phase strains. All values are normalized to wild type strains. B: qRT-PCR analyses of gene expression in logarithmic-phase strains after exposure to 5 mmol/L H2O2 for 30 min. All values are normalized to untreated samples. Data shown are mean±SEM of three independent experiments.

A: Ofloxacin (1.5 μg/mL). B: t-BHP (1 mmol/L). C: Ultraviolet (0, 5, 10, 15 and 20 mJ/cm2).
3 讨论
本研究发现,较于野生型菌株缺失Ms4259的耻垢分枝杆菌的利福平耐药自发突变频率显著上升,证实该基因参与耻垢分枝杆菌的基因组维护。但有研究通过波动试验比较耻垢分枝杆菌野生型与ΔMs4259菌株的突变率,结果显示无显著差异[3]。须注意的是,突变率是指单位时间内某种突变发生的概率,可表示为每个位点、每个基因、每个核苷酸或每个配子在每个世代或每次DNA复制时发生突变的概率,突变频率则是指群体内发生某种突变的细胞或个体数的比例[11],两者高度相关,但不相同。本研究结果与此并不冲突。
对筛选到的利福平耐药菌株的rpoB基因进行测序,发现A: T>C: G突变在ΔMs4259菌株中发生的概率比野生型高10倍,提示Ms4259的基因组维护功能与A: T>C: G突变形成有关。A: T>C: G突变是细胞中最常见的与DNA氧化损伤相关的突变类型,与氧化型鸟嘌呤8-oxo-dG在复制过程中错误地掺入基因组DNA有关,该碱基易与腺嘌呤(adenine, A)形成错配,导致A: T>C: G突变形成[12]。同时,本研究还发现Ms4259在氧化压力下转录表达上调了7倍。以上结果提示,Ms4259可能参与了DNA氧化损伤的修复,但目前还不清楚该修复过程是发生在DNA复制阶段还是复制后修复阶段。
目前,对Ms4259及其同源基因的相关研究非常少。有研究发现,结核分枝杆菌Rv2191在丝裂霉素C处理后能以PafBC介导途径调控的方式诱导表达[13],提示其与结核分枝杆菌的DNA损伤应答有关,与本研究结果一致。在结核分枝杆菌感染兔模型中,Rv2191在结核潜伏感染和复苏阶段表达水平提高,提示其可能参与了结核分枝杆菌的持留或复苏[4]。细菌在潜伏感染时处于一种相对静止代谢的状态(不发生复制),此状态下细菌基因组面临宿主细胞环境,即使DNA损伤也不会及时修复,因此细菌重新活化时须优先表达DNA损伤修复基因,从而去修复受损的基因组,避免直接复制导致更严重的双链断裂[14]。然而,目前对分枝杆菌复苏阶段DNA修复和复制的机制研究还十分欠缺。
Ms4259蛋白的N端具有3′-5′核酸外切酶结构域,C端有类UvrC内切酶结构域,提示其具有在同一个DNA序列上进行内切后再利用自身外切酶活性进行核苷酸切除的潜在能力。目前研究发现,分枝杆菌DNA损伤修复系统既复杂又冗余,具有碱基切除修复、核苷酸切除修复、非同源端连接、单链退火、双链DNA断裂修复和非经典的错配修复等修复方式,这些DNA修复过程都须通过DNA损伤应答途径来上调特定的DNA损伤修复基因的水平[15]。本研究发现,Ms4259缺失不会导致耻垢分枝杆菌突变频率大幅升高,也不影响耻垢分枝杆菌在DNA损伤条件下的存活率。本文结论提示Ms4259在耻垢分枝杆菌的DNA代谢系统中可能是冗余的,也可能与特定条件下(如细菌休眠与复苏)的DNA修复调控有关,相关机制有待进一步深入研究。
综上所述,本研究揭示了分枝杆菌Ms4259及其同源物的生理功能、突变谱特点及参与氧化压力应答转录调控的特点,为进一步探讨其作用机制奠定了基础。

