铜绿假单胞菌中exoU、lasI基因的表达及耐药性研究
张洁莉,王丽霞,安静,刘丹丹,翟文霞,吴琳乾,李妤蓉
邢台医学高等专科学校第二附属医院检验科,河北 邢台 054000
铜绿假单胞菌(Pseudomonasaeruginosa)是临床上最常见的致病菌之一,常在机体免疫力低下时导致各种急慢性感染,其院内感染发生率在革兰氏阴性菌中居前列,并呈逐年上升的趋势[1]。铜绿假单胞菌多重耐药导致临床抗感染治疗难度增加,而其感染的发生发展与其表达的多种毒力因子密切相关[2]。研究证实,Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)参与了铜绿假单胞菌的感染和致病过程,且T3SS分泌的多种效应蛋白多与急性感染有关。ExoU、ExoS、ExoT、ExoY是T3SS分泌的4种主要效应蛋白,特别是ExoU和ExoS的表达水平与感染和炎症的程度相关,对预后有显著影响[3]。此外,群体感应系统(quorum sensing,QS)广泛存在于铜绿假单胞菌,对其多种毒力基因表达有调控作用。Las系统是QS的重要组成部分,可调控外毒素A(exotoxin A)、LasA蛋白酶、碱性蛋白酶(alkaline protease)等多种蛋白及酶的合成,与细菌的致病性和耐药性密切相关[4]。因此,抑制QS进而对毒力因子释放进行有效调控,已成为铜绿假单胞菌感染治疗的重要研究方向。本研究通过分析铜绿假单胞菌中exoU、lasI基因表达差异与其耐药性之间的关系,以期为临床合理用药及抗感染药物研发提供新的方向。
1 材料和方法
1.1 菌株来源
选取2019年6月—2020年12月邢台医学高等专科学校第二附属医院收集和分离的640株铜绿假单胞菌,分别来自痰液标本(330株)、血液标本(142株)、脓液标本(97株)、穿刺液标本(23株)、引流液标本(36株)、胆汁标本(12株)。所有标本均严格按照《全国临床检验操作规程》(第4版)标准[5]进行验证,且将重复和不合格样本剔除。阳性质控菌株为铜绿假单胞菌ATCC 27853(购自温州市康泰生物科技有限公司)。
1.2 菌株鉴定与药敏试验
采用BD PhoenixTM-100全自动微生物分析仪(美国BD公司)鉴定所有铜绿假单胞菌。采用琼脂稀释法检测铜绿假单胞菌对常用抗生素的敏感性,药敏试验过程和结果均参照美国临床和实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI)标准。
1.3 聚合酶链反应(polymerase chain reaction,PCR)
采用细菌基因组提取试剂盒提取菌株DNA作为模板,并根据特异性引物进行PCR扩增。PCR引物序列均参考相关文献设计并委托上海华大基因科技有限公司合成制备,引物序列如表1所示。PCR反应体系共25 μL,主要包括2.5 μL 10×PCR缓冲液、2.5 μL dNTP混合物,以及浓度均为10 mmol/L的0.5 μL上游引物和0.5 μL下游引物,另加入16.9 μL无菌双蒸水、浓度为5 U/μL的0.1 μL DNA聚合酶和2.0 μL DNA模板。
PCR反应条件:95 ℃ 10 min;95 ℃ 1 min,退火30 s(exoU、exoS、lasI退火温度分别为58 ℃、54 ℃、56 ℃),72 ℃ 1 min,循环35次;72 ℃ 5 min。将PCR产物用10 g/L琼脂糖凝胶电泳进行凝胶成像并观察。
1.4 荧光定量PCR(quantitative PCR,qPCR)检测毒力基因表达
参照RNA提取试剂盒(美国Thermo Fisher Scientific公司)说明书提取铜绿假单胞菌总RNA,取1 μg用 PrimeScript RT reagent Kit(日本TaKaRa公司)反转录成cDNA,然后按SYBR Green qPCR Master Mix试剂盒(美国Thermo Fisher Scientific公司)说明书进行荧光qPCR,内参为rpoD基因。采用2-ΔΔct计算目标基因的相对表达量(relative quantification,RQ)[6]。
1.5 统计学分析

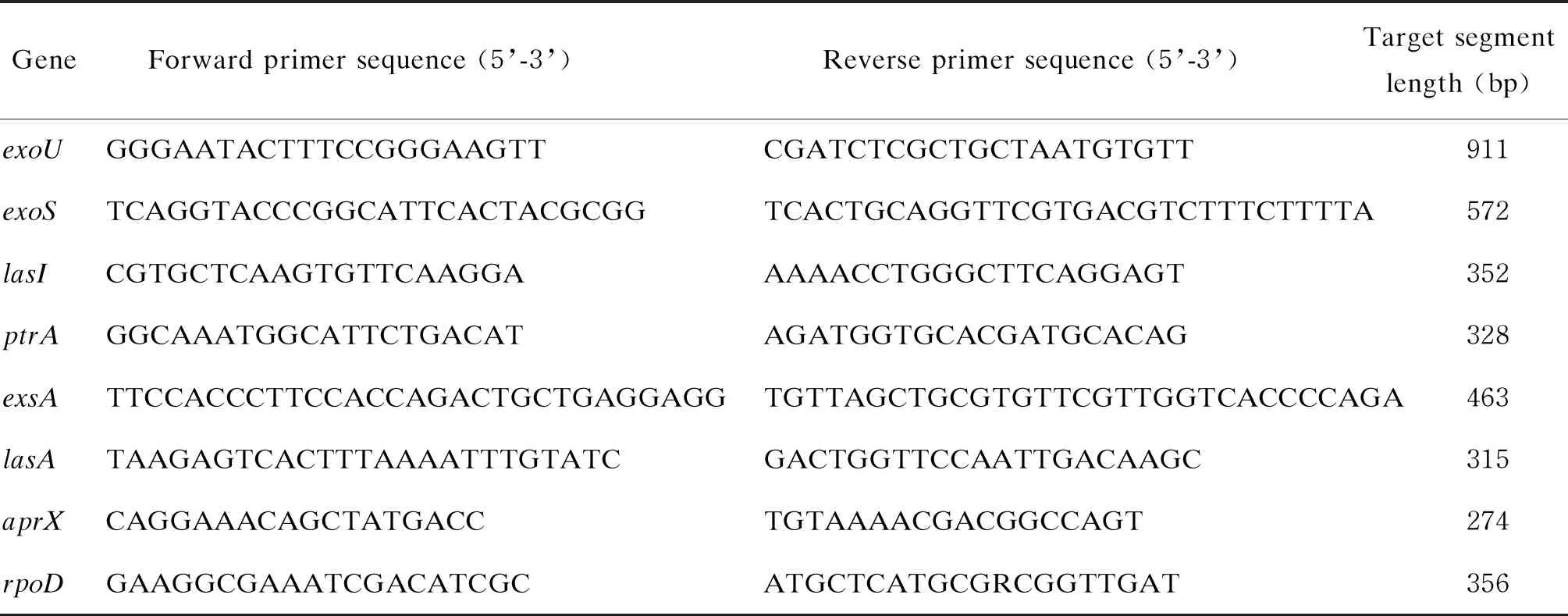
表1 PCR引物序列
2 结果
2.1 lasI、exoS、exoU基因片段扩增成功
利用琼脂糖凝胶电泳对lasI、exoS、exoU基因片段的PCR扩增产物进行检测,目的基因条带大小正确,检测结果如图1所示。
2.2 不同来源铜绿假单胞菌中各基因分布特征
640株铜绿假单胞菌主要来自痰液(51.56%)、血液(22.19%)及脓液(15.16%)标本。exoS+/exoU-基因组合在各标本中均检出率最高,其在痰液、血液和脓液标本中的检出率分别为56.97%(188/330)、71.83%(102/142)和67.01%(65/97)。结果如表2所示。
2.3 不同来源铜绿假单胞菌的药敏试验结果
药敏试验结果显示,640株铜绿假单胞菌对10种抗菌药物均有不同程度的耐药,且痰液来源的菌株对亚胺培南的耐药率高于血液、脓液及其他来源的菌株(P<0.001)。结果如表3所示。
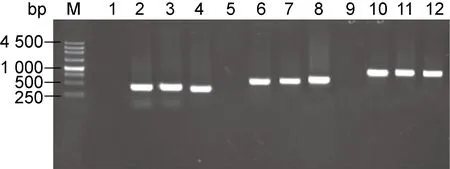
M: Marker; Lane 1: lasI gene-negative control; Lanes 2-4: lasI gene; Lane 5: exoS gene-negative control; Lanes 6-8: exoS gene; Lane 9: exoU gene-negative control; Lanes 10-12: exoU gene.

表2 不同标本来源铜绿假单胞菌中各基因分布特征

表3 不同标本来源铜绿假单胞菌的耐药性比较
2.4 不同基因型铜绿假单胞菌的耐药性比较
携带exoU铜绿假单胞菌对亚胺培南,庆大霉素、妥布霉素和阿米卡星等氨基糖苷类,左氧氟沙星和环丙沙星等氟喹诺酮类,以及阿奇霉素等大环内酯类抗菌药物均具有较高的耐药率(P<0.001),携带exoS的铜绿假单胞菌对氨曲南具有较高的耐药率(P<0.05),lasI缺失的铜绿假单胞菌对各抗菌药物的耐药率显著降低(P<0.001)。结果如表4所示。
2.5 基因表达水平及相关性分析
实时荧光qPCR结果显示,exoU缺失(exoU-)后,其转录调控相关基因ptrA、exsA的表达水平较于exoU未缺失(exoU+)下降(P=0.025,0.013,见图2);172株携带exoU的铜绿假单胞菌转录调控相关基因ptrA、exsA的表达水平与exoU的表达水平呈显著负相关(r=-0.645,r2=0.416,P<0.001;r=-0.587,r2=0.345,P<0.001,详见图3);423株携带exoS的铜绿假单胞菌转录调控相关基因ptrA、exsA的表达水平与exoS的表达水平也呈显著负相关(r=-0.618,r2=0.382,P<0.001;r=-0.532,r2=0.283,P<0.001,详见图4)。lasI缺失后,其下游毒力基因lasA、aprX表达水平显著降低(P<0.001,见图5),且lasA、aprX的表达水平与lasI表达水平呈显著正相关(r=0.489,r2=0.239,P<0.001;r=0.512,r2=0.262,P<0.001)。具体结果如图6所示。

表4 不同基因型铜绿假单胞菌的耐药性比较

图2 exoU+与exoU-铜绿假单胞菌中ptrA和exsA的表达水平

图3 ptrA、exsA表达水平与exoU表达水平的相关性

图4 ptrA、exsA表达水平与exoS表达水平的相关性
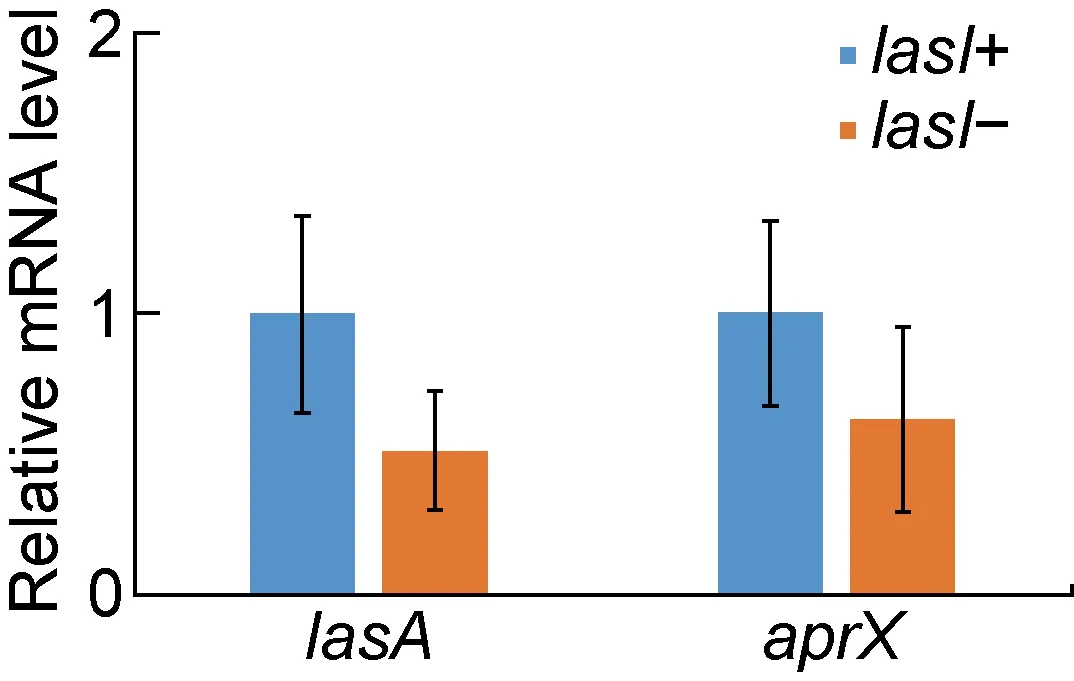
*P<0.001 compared with lasI+ group.
3 讨论
铜绿假单胞菌是广泛存在于人体皮肤以及呼吸道的致病菌,在机体抵抗力低下时可诱发感染和炎症反应。随着抗生素的大量和广泛使用,其耐药性呈上升趋势,且耐药机制较为复杂[7]。T3SS作为铜绿假单胞菌与外界交流、获取所需养分及将分泌的毒性蛋白传输至外界环境的重要途径,可分泌包括ExoU、ExoS在内的多种效应蛋白,从而发挥致病作用[8]。 ExoU 能导致细胞膜发生快速损伤和坏死,且具有腺苷酸环化酶及磷脂酶活性,是T3SS中最具破坏性的细菌毒素[9]。ExoS可显著抑制宿主细胞的吞噬作用,导致细胞凋亡,其毒力仅次于ExoU,还具有二磷酸腺苷核糖转移酶活性[10]。这两种主要毒力因子的表达对感染的严重程度和预后具有决定性作用。本研究的640株铜绿假单胞菌主要来源于痰液(51.56%)、血液(22.19%)及脓液(15.16%)标本。exoS+/exoU-基因组合在各标本中均检出率最高,其在痰液、血液和脓液标本中的检出率分别为56.97%(188/330)、71.83%(102/142)和67.01%(65/97),提示铜绿假单胞菌毒力基因表达与感染部位之间无明显的相关性。

图6 lasA、aprX表达水平与lasI表达水平的相关性
国外研究表明,ExoU不仅会引起宿主细胞发生损伤,使感染病灶中的铜绿假单胞菌大量繁殖,还能促使其他条件致病菌引发进一步的双重感染,从而加重病情,影响预后[11-12]。细菌毒力基因常与其耐药性密切相关。本研究发现,640株铜绿假单胞菌对10种抗菌药物均有不同程度的耐药,且痰液来源的铜绿假单胞菌对亚胺培南的耐药率高于血液、脓液及其他来源的菌株(P<0.001)。携带exoU的铜绿假单胞菌对亚胺培南,庆大霉素、妥布霉素和阿米卡星等氨基糖苷类,左氧氟沙星和环丙沙星等氟喹诺酮类,以及阿奇霉素等大环内酯类抗菌药物均具有较高的耐药率(P<0.001),耐药率40%以上;携带exoS的铜绿假单胞菌对氨曲南具有较高的耐药率(P<0.05)。携带exoS或exoU的铜绿假单胞菌对哌拉西林/他唑巴坦及头孢吡肟的耐药率均低于20%,可考虑将此类药物作为本地区铜绿假单胞菌感染的经验性治疗药物。值得关注的是,很少有研究报道携带exoU的铜绿假单胞菌对氨基糖苷类的耐药性,这可能是因为不同地区的抗生素使用习惯不同,导致细菌耐药性存在一定的差异,这可能与细菌基因位点变异有关,但具体机制须进一步探讨[13]。目前,关于T3SS分泌的效应蛋白表达调控机制的研究不多。铜绿假单胞菌中T3SS基因表达主要受转录调控蛋白ExsA的调控,而PtrA是近年来新发现的一种转录调控因子[14]。本研究发现,携带exoU或exoS基因的铜绿假单胞菌中转录调控相关基因ptrA、exsA的表达与exoU或exoS的表达呈显著负相关(P<0.001)。ptrA基因过表达时,会明显抑制exoU、exoS的表达,且exsA的表达也明显下降,提示PtrA可能通过调节ExsA表达而影响ExoU、ExoS等的表达,从而推测T3SS可能通过调控ptrA等负调控基因的表达来调节相关效应蛋白的表达[15]。
铜绿假单胞菌QS具有调控300多个毒力基因的能力,与细菌生物被膜形成及细菌致病性密切相关。研究证实,抑制铜绿假单胞菌QS可有效降低细菌的致病性及耐药程度[16],已成为目前临床细菌感染治疗及耐药性研究的重点。Las系统作为QS的重要组成部分,主要由lasI、lasR基因构成[17]。税剑等[18]的研究证实,缺乏lasI、lasR基因的铜绿假单胞菌的成膜能力显著下降,甚至不能形成生物膜,从而其对常规抗菌药物的敏感性大大提高。本研究结果显示,lasI缺失的铜绿假单胞菌对各类抗菌药物的耐药率显著降低(P<0.001),与鄂顺梅等[19]的研究结果一致。本文进一步研究发现,lasI缺失的铜绿假单胞菌下游毒力基因lasA、aprX的表达水平显著降低(P<0.001),且lasA、aprX的表达水平与lasI表达水平显著正相关(r=0.489,P<0.001;r=0.512,P<0.001),提示Las系统对其下游毒力基因具有一定的正反馈调节作用。铜绿假单胞菌QS具有级联调控和反馈机制:Las系统处于调控网络顶端,在感受到刺激信号后最先启动激活,并促使lasI表达上调。因此,Las系统为QS的正向调节因子,可调控下游毒力基因的表达[19-20]。
综上所述,exoU表达与铜绿假单胞菌的耐药性显著相关,ptrA可能是exoU表达的潜在负调控基因,而lasI缺失会明显抑制铜绿假单胞菌QS毒力基因的表达及耐药性的产生。

