指甲花香豆素类成分提取工艺优化及其抑菌活性评价
许亚丽,何念武
(1.商洛学院 生物医药与食品工程学院,陕西商洛 726000;2.西北大学 生命科学学院,陕西西安 710127)
指甲花,学名凤仙花(Impatiens balsamina),是一种天然植物染料,在民间常被用来染头发或指甲,亦可作为园艺观赏植物。与大部分药用植物一样,指甲花化学成分复杂,富含醌类、黄酮类和香豆素类等生物活性成分,还含有脂肪酸、挥发油等成分[1]。研究表明,指甲花具有抗真菌、抗氧化及消炎镇痛等临床作用[1-2],在医学上可用于祛风除湿及治疗风湿、痛风和甲癣等。指甲花还具有食疗价值,可炒食或制成保健饮料等[3]。
香豆素类成分主要包括白蜡树亭、东茛菪素和七叶亭等[4],存在于自然界许多植物中,作为植物化学成分之一常带有香味。龚蕾等[5]综述了提取香豆素的常用方法,主要有水蒸气蒸馏提取法、碱溶酸沉提取法、系统溶剂提取法和色谱提取法等,并简要分析各方法的优缺点,其中系统溶剂提取法具有操作简单和成本低等优势。袁园等[6]通过微波辅助溶剂提取法提取白芷(Angelica dahurica)中的香豆素,结果显示该方法具有高效、省时和便捷等优点。微波辅助溶剂提取法主要通过洗料、清洗、粉碎、分离、浓缩和干燥等步骤获得产品,既克服了系统溶剂提取法操作时间过长的缺点,又集合了微波辅助的优势,目前已被广泛应用于植物化学成分的提取[7]。
国内外学者在关注植物化学成分提取分离的同时,积极开展化学成分抗氧化、抗菌和消炎等生物活性的研究。黎秋华等[8]采用不同溶剂对指甲花花瓣进行粗提,并进行粗提物体外抑菌试验,结果显示不同溶剂粗提物均对细菌有抑制作用,其中75%丙酮提取物的抑菌效果最强。董晨虹等[9]通过药敏试纸(滤纸片)法比较指甲花不同部位的抑菌能力,结果表明指甲花花瓣对真菌生长有明显的抑制作用。米尔班古丽·阿卜杜如苏力等[10]对指甲花粗提液进行体外抑菌活性筛选试验,结果表明指甲花粗提液对常见致病菌大肠埃希菌(Escherichia co⁃li)和金黄色葡萄球菌(Staphylococcus aureus)等的抑菌活性随浓度的增大而增加。上述研究均表明指甲花有良好的抑菌活性,但并未明确指甲花抑菌活性成分。Malekzadeh 等[11]研究表明,指甲花的抗菌活性可能与其所含的活性成分2-羟基-1,4-萘醌,即指甲花醌类成分有关。为进一步了解指甲花的抑菌活性成分,本研究采用微波辅助溶剂提取法提取指甲花中的香豆素类成分,基于提取温度、提取时间、料液比及乙醇浓度4个单因素试验结果,采用正交试验设计进行工艺优化,并采用抑菌圈法考察指甲花香豆素类成分的体外抑菌活性,以期为指甲花资源的综合利用提供理论支撑。
1 材料与方法
1.1 材料与试剂
指甲花、香豆素(批号:20210310,上海迈坤化工有限公司)、乙醇、盐酸、氢氧化钠、牛肉膏、氯化钠、琼脂、蛋白胨、大肠埃希菌和金黄色葡萄球菌(由商洛学院生物医药与食品工程学院微生物学实验室提供)。
1.2 指甲花香豆素检测波长
采用紫外全波长扫描仪检测香豆素对照品和待测样品的最大吸收波长,确定后续香豆素类成分提取率的检测波长[12]。准确吸取香豆素对照品溶液2.5 mL 和供试品溶液1.5 mL 于10.0 mL 容量瓶中,无水乙醇定容,倒置摇匀,在200 ~500 nm 波长下分别扫描对照品和供试品溶液,找出最大吸收峰,确定检测波长。
1.3 指甲花香豆素类成分提取率测定
1.3.1 绘制标准曲线
对照品溶液配制:准确称取香豆素对照品25.0 mg,采用无水乙醇溶解,定容于500.0 mL 容量瓶中,得到50.0 μg/mL香豆素对照品溶液。
供试品溶液制备:称取2.0 g 指甲花粉末(粉碎机打粉,过80 目筛),置于150.0 mL 容量瓶中,加入60.0 mL 无水乙醇,微波辅助加热冷凝回流90 min,提取温度60 ℃,放冷后过滤;滤渣中加入30.0 mL无水乙醇,按照上述条件重复提取1 次,过滤;将两次滤液合并后置于150.0 mL 容量瓶中,无水乙醇定容,倒置摇匀。精确吸取0.5 mL 溶液置于10.0 mL容量瓶中,无水乙醇定容,得到供试品溶液。
标准曲线绘制:分别吸取0.2、0.3、0.5、0.7 和1.0 mL对照品溶液至10.0 mL容量瓶中,无水乙醇定容,稀释成不同浓度的香豆素对照品溶液。以无水乙醇为空白对照,在一定波长处检测各组吸光值。
1.3.2 方法学考察
精密度试验:准确吸取香豆素对照品溶液0.5 mL于10.0 mL 容量瓶中,无水乙醇定容,在测定波长处连续测定5 次吸光度,计算相对标准偏差(relative standard deviation,RSD),判断仪器的精密度。

式中,S为标准偏差为吸光度均值。
稳定性试验:取指甲花提取液在室温下分别放置2、4、8、12、24 和30 h,在确定的波长下测定不同时间下的吸光度,计算RSD,判断指甲花提取液在30 h内的稳定性。
重复性试验:称取2.0 g指甲花粉末,置于150.0 mL圆底烧瓶中,加入60.0 mL 95%乙醇,回流提取1.5 h,提取温度60 ℃,冷却后过滤;滤渣中加入30.0 mL 95%乙醇,按照上述条件重复提取1 次,过滤;将两次滤液合并后置于150.0 mL 容量瓶中,吸取0.5 mL置于10.0 mL 容量瓶中,无水乙醇定容,得到指甲花粗提液。重复6 次。在确定的波长下,测定待测液的吸光度,计算RSD,判断该方法的重复性。
1.3.3 香豆素类成分提取率计算
设置检测波长为270 nm,按照回归方程计算指甲花乙醇提取液的浓度,再根据提取率公式计算指甲花香豆素类成分的提取率(%)。

式中,C为指甲花提取液的浓度(g/mL);V为提取液的体积(mL);M为指甲花粉末的质量(g)[6]。
1.4 方法
1.4.1 乙醇浸提指甲花中香豆素类成分的单因素试验
以指甲花粉末为原料,采用冷凝回流法,以总香豆素量为指标,考察提取时间、提取温度、料液比和乙醇浓度对香豆素类成分提取率的影响。
(1)提取温度对提取效果的影响
准确称取3.0 g 指甲花粉末6 份,分别置于100.0 mL 圆底烧瓶中,加入60.0 mL 50%乙醇,加热回流90 min,分别调节水浴锅的温度为40、50、60、70、80 和90 ℃,放冷后过滤;滤渣中加入30.0 mL 50%乙醇,按照上述条件重复提取1 次,过滤;将两次滤液合并后置于150.0 mL 容量瓶中,无水乙醇定容,摇匀。准确吸取0.5 mL 溶液,无水乙醇稀释并定容至10.0 mL。测定吸光度,计算各组香豆素类成分提取率。
(2)提取时间对提取效果的影响
准确称取3.0 g 指甲花粉末6 份,分别置于150.0 mL 圆底烧瓶中,加60.0 mL 70%乙醇,调节水浴锅温度为60 ℃,分别加热回流50、60、90、110、120和150 min,放冷后过滤;滤渣中加入30.0 mL 70%乙醇,按照上述条件重复提取1 次,过滤;将两次滤液合并后置于150.0 mL 容量瓶中,无水乙醇定容,摇匀。准确吸取0.5 mL 溶液,无水乙醇稀释并定容至10.0 mL。测定吸光度,计算各组香豆素类成分提取率。
(3)料液比对提取效果的影响
准确称取3.0 g 指甲花粉末6 份,分别置于100.0 mL 圆底烧瓶中,分别按照1∶10、1∶15、1∶20、1∶30、1∶40 和1∶50 的料液比(指甲花粉末与提取溶剂之比,mg∶mL)加入50%乙醇,加热回流提取90 min,调节水浴锅温度为60 ℃,放冷后过滤;滤液置于150.0 mL容量瓶中,无水乙醇定容,摇匀。准确吸取0.5 mL溶液,无水乙醇稀释并定容至10.0 mL。测定吸光度,计算各组香豆素类成分提取率。
(4)乙醇浓度对提取效果的影响
准确称取3.0 g 指甲花粉末6 份,分别置于100.0 mL圆底烧瓶中,分别加入60.0 mL体积分数分别为10%、30%、50%、70%和95%的乙醇,加热回流提取90 min,调节水浴锅温度为60 ℃,放冷后过滤;滤渣中加入30.0 mL 对应浓度乙醇,按照上述条件重复提取1次,过滤;将两次滤液合并后置于150.0 mL容量瓶中,无水乙醇定容,摇匀。准确吸取0.5 mL溶液,无水乙醇稀释并定容至10.0 mL。测定吸光度,计算各组香豆素类成分提取率。
1.4.2 正交试验优化指甲花中香豆素类成分提取工艺条件
根据上述4 个单因素试验结果,选择适宜的提取温度、提取时间、料液比及乙醇浓度,设置4 个单因素的正交试验(表1)。
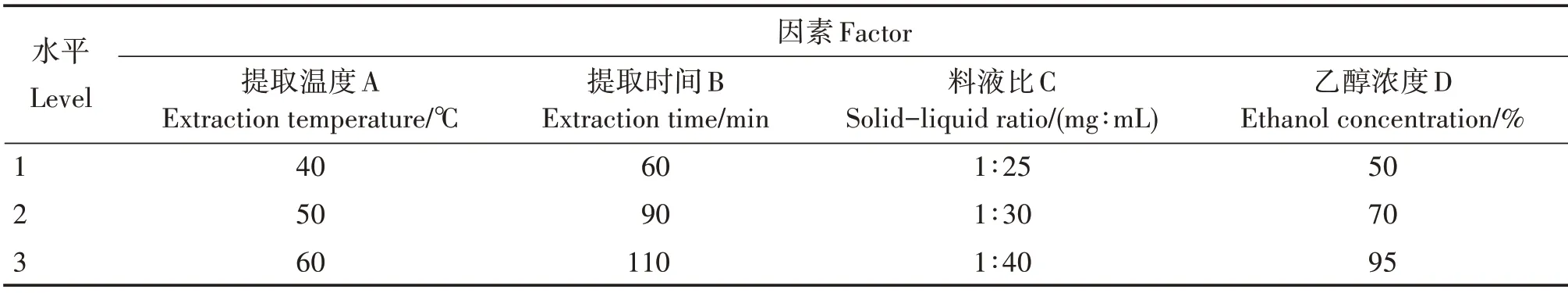
表1 正交试验设计因素水平Tab.1 Factor levels of orthogonal experimental design
1.5 抑菌圈法测定指甲花香豆素类成分抑菌活性
1.5.1 培养基制备
配置牛肉膏蛋白胨琼脂培养基。称取10.0 g 牛肉膏、10.0 g蛋白胨、5.0 g氯化钠和20.0 g琼脂,溶解于1 000.0 mL蒸馏水中,调节pH为7.0 ~7.2,设置高压灭菌锅的时间为20 min,灭菌后干燥保存备用。
1.5.2 菌悬液和滤纸片制备
将大肠埃希菌等细菌在斜面培养基中活化;将已活化的细菌于无菌条件下接种于50.0 mL 细菌培养液中,置于培养箱中,在37 ℃条件下培养24 h。用打孔器将定性滤纸制成直径为6 mm的圆片,进行高压蒸汽灭菌,保存备用[9]。
1.5.3 指甲花香豆素提取物抑菌活性检测
称取适量指甲花香豆素提取物,配置成1.0 g/mL的供试品溶液。取适量供试品溶液,用盐酸和氢氧化钠分别调节指甲花香豆素提取液的pH 为4、5、6、7、8 和11,将直径为6 mm 的滤纸片放入溶液中浸润20 min,晾干后贴在培养皿内,加入灭菌的牛肉膏蛋白胨琼脂培养基,混匀;待平板凝固后,取预先配置好的0.1 g/mL 大肠埃希菌和金黄色葡萄球菌混悬液100.0 mL分别加入平板中央,均匀涂布;无菌水为对照。平板凝固后,在37 ℃生化培养箱中培养24 h,观察细菌生长情况,测量抑菌圈的直径,重复3 次。记录数据,计算各pH 条件下3 个培养皿抑菌圈直径的均值。一般而言,抑菌圈直径大于1 cm,说明有抑菌效果;小于或等于1 cm,说明没有抑菌效果;抑菌圈直径越大,抑菌效果越强[8-10]。
1.6 数据处理
采用Excel 2016 软件进行数据处理;采用SPSS 18.0软件进行统计分析。
2 结果与分析
2.1 检测波长
对照品溶液在269 nm 处有最大吸收峰,此时吸光度为0.49;供试品溶液在270 和271 nm 处有最大吸收峰,此时吸光度为0.78;两者最大吸收峰相近(图1)。因此,本研究将检测波长确定为270 nm。
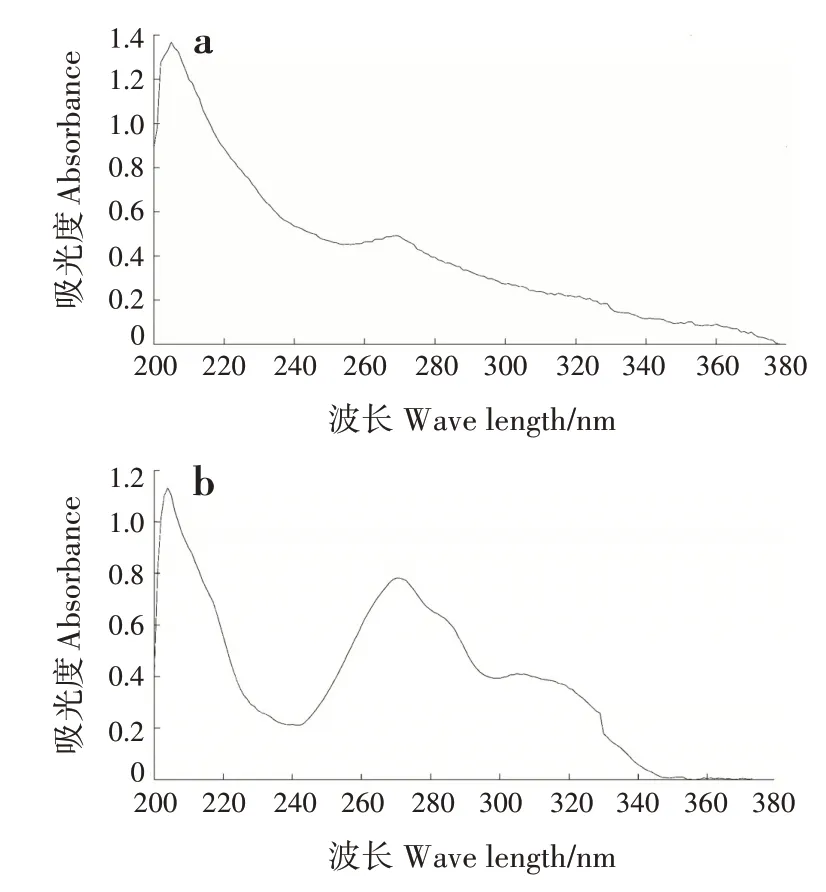
图1 香豆素对照品及供试品溶液紫外扫描图Fig.1 UV scans of coumarin reference substance and test substance solutions
2.2 标准曲线绘制
以香豆素浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程y = 0.026 4 x +0.506 1,R2=0.994 3(图2)。
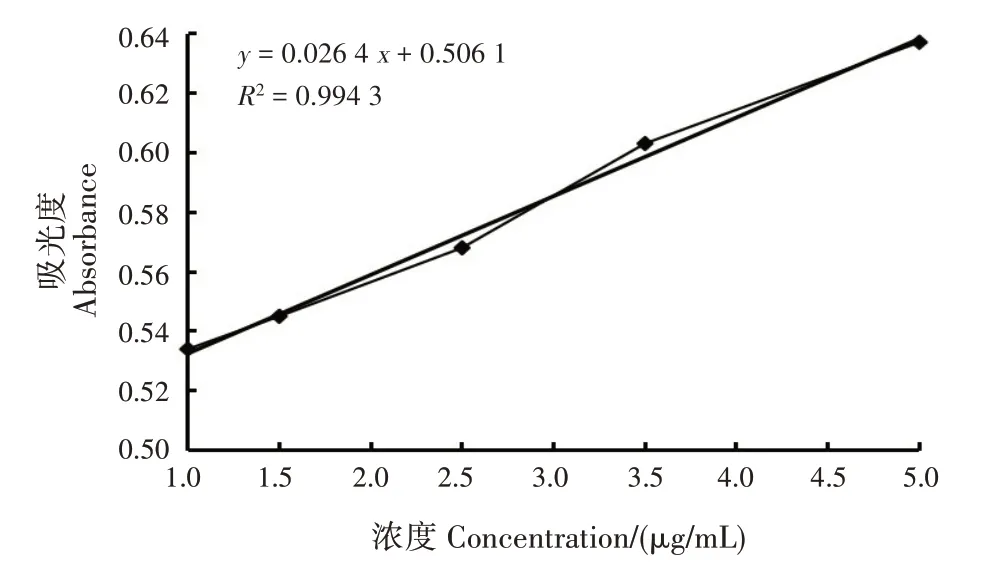
图2 香豆素对照品溶液标准曲线Fig.2 Standard curve of coumarin reference substance solution
2.3 方法学考察结果
2.3.1 精密度试验
在270 nm 的检测波长处,连续5 次对香豆素对照品溶液的吸光度进行测定(n=5),RSD 为1.03%,说明所使用的紫外分光光度计精密度良好。
2.3.2 稳定性试验
在270 nm 的检测波长处,分别在2、4、8、12、24和30 h 测定指甲花提取物的吸光度,RSD 为1.36%,说明指甲花提取液在30 h内较稳定。
2.3.3 重复性试验
在270 nm 的检测波长处,测定并记录吸光值,RSD为1.25%,说明该提取方法有较好的重复性。
2.4 单因素试验结果
2.4.1 提取温度对香豆素类成分提取率的影响
随提取温度增加,指甲花香豆素类成分提取率呈先升后降的趋势;提取温度为60 ℃时,提取率最高(0.12%);温度上升至90 ℃时,提取率较低,可能是高温破坏了香豆素类成分活性成分的结构(图3)。基于单因素试验结果,正交试验最佳提取温度初步确定为60 ℃。
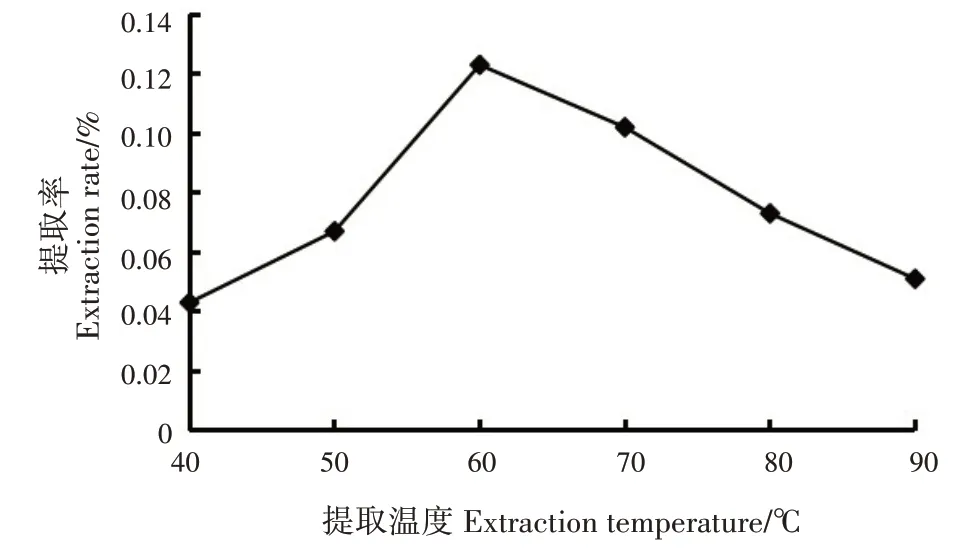
图3 提取温度对香豆素类成分提取率的影响Fig.3 Effects of extraction temperatures on extraction rate of coumarins
2.4.2 提取时间对香豆素类成分提取率的影响
随提取时间延长,指甲花香豆素类成分提取率呈先升后降的趋势;提取时间为90 min时,提取率最高(0.13%)(图4)。基于单因素试验结果,正交试验最佳提取时间初步确定为90 min。
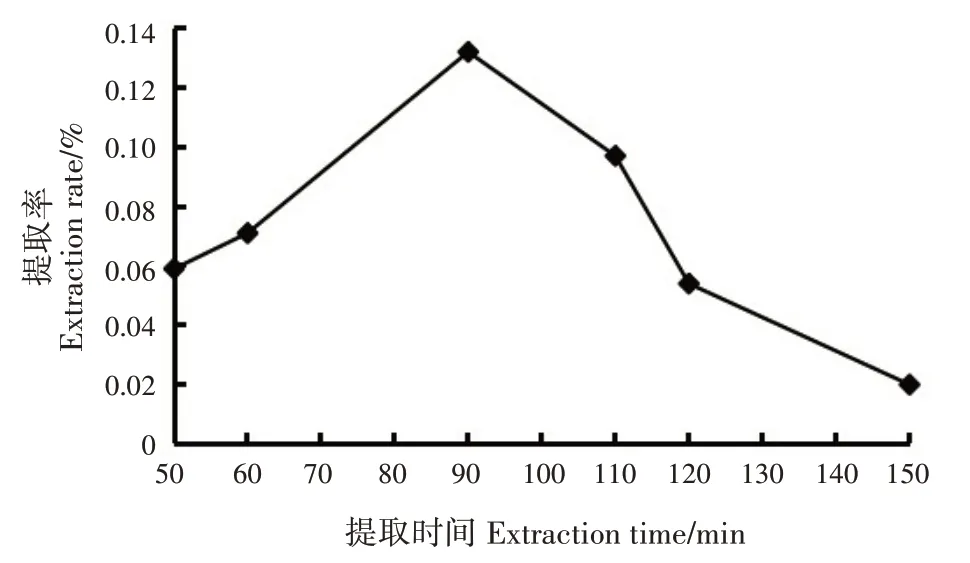
图4 提取时间对香豆素类成分提取率的影响Fig.4 Effects of extraction time on extraction rate of coumarins
2.4.3 料液比对香豆素类成分提取率的影响
随料液比增加,指甲花香豆素类成分提取率呈先升后降的趋势;料液比为1∶30 时,提取率最高(0.13%)(图5)。基于单因素试验结果,正交试验最佳料液比初步确定为1∶30。
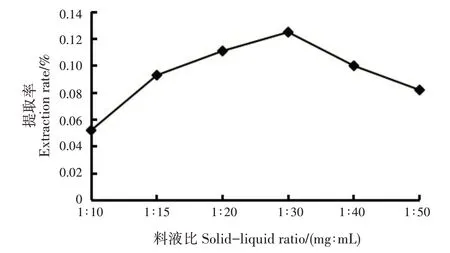
图5 料液比对香豆素类成分提取率的影响Fig.5 Effects of solid-liquid ratios on extraction rate of coumarins
2.4.4 乙醇浓度对香豆素类成分提取率的影响
随乙醇浓度增加,指甲花香豆素类成分提取率呈先升后降的趋势;乙醇浓度为50%时,提取率最高(0.10%)(图6)。基于单因素试验结果,正交试验最佳乙醇浓度初步确定为50%。
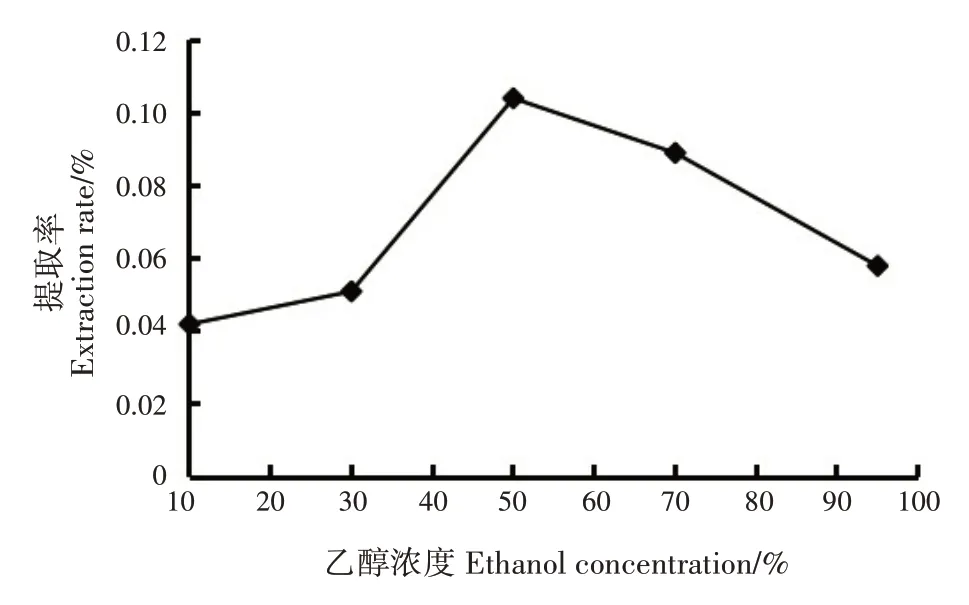
图6 乙醇浓度对香豆素类成分提取率的影响Fig.6 Effects of ethanol concentrations on extraction rate of coumarins
2.5 正交试验优化结果及分析
2.5.1 正交试验结果
从单因素试验结果可以看出,不同的提取温度、提取时间、料液比及乙醇浓度对指甲花香豆素类成分提取率的影响程度不同,基于单因素试验结果选取各因素较优水平进行正交试验优化(表1)。香豆素类成分提取率为0.04% ~ 0.16%;处理7(A3B1C3D2)的提取率最高(0.16%)(表2)。通过极差分析,各因素对香豆素类成分提取率的影响为料液比>乙醇浓度>提取温度>提取时间,最佳组合为A3B2C3D2,即提取温度60 ℃、提取时间90 min、料液比1∶40和乙醇浓度70%。
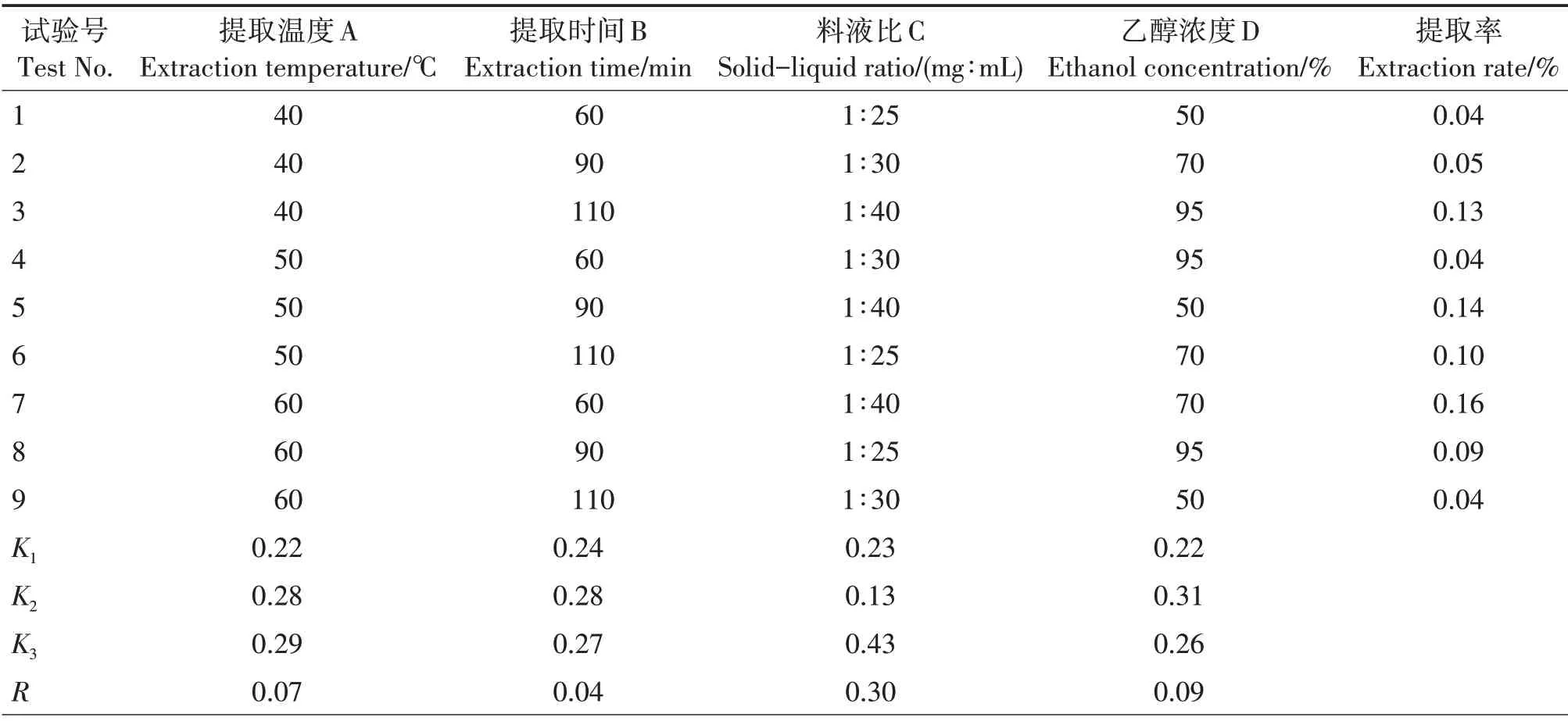
表2 正交试验结果与极差分析Tab.2 Results and range analysis of orthogonal experiment
2.5.2 验证试验
将实际最优组合和理论最优组合进行同步3 次验证试验(表3)。在理论最优组合下,香豆素类成分平均提取率为0.185%,高于实际最优组合。

表3 验证试验结果Tab.3 Results of validate experiment (%)
2.6 不同pH条件下香豆素类成分提取液抑菌活性
酸性条件下,指甲花香豆素类成分提取液抑菌效果较强,碱性条件下次之,中性条件下较弱(表4)。随pH 增加,香豆素类成分提取液的抑菌效果呈降低趋势;pH 为11 的近强碱性条件下,抑菌效果又有所增强。原因可能是在强酸或强碱的极端条件下,大肠埃希菌等细菌的生长受到抑制,抑菌圈较大[13]。与对照相比,指甲花香豆素类成分提取液对大肠埃希菌和金黄色葡萄球菌的生长均有显著抑制作用(P<0.05);大肠埃希菌的抑菌圈平均直径为11.74 mm,金黄色葡萄球菌的抑菌圈平均直径为13.77 mm。
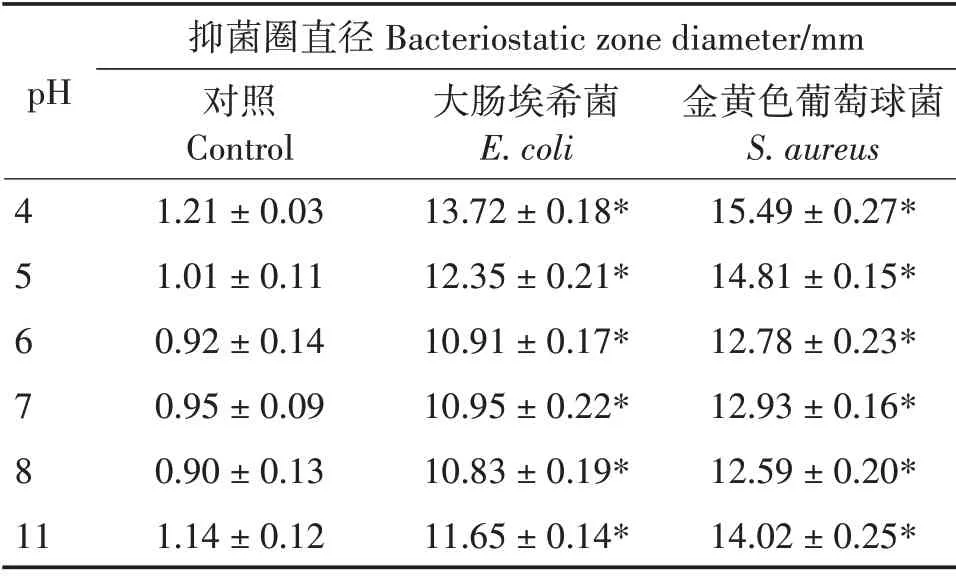
表4 不同pH条件下指甲花香豆素类成分提取液抑菌效果Tab.4 Antibacterial effects of coumarins extracts from I.balsamina in different pH conditions
3 讨论与结论
本研究选用微波辅助溶剂提取法提取指甲花中的香豆素类成分,既克服了系统溶剂提取法操作时间过长的缺点,又结合了微波辅助的优势[7]。抑菌活性研究采用抑菌圈法,通过测量抑菌圈的直径大小来判断抑菌效果。还可通过平板菌落计数法计算抑菌率,但平板菌落计数法待测样品菌液往往不宜完全分散成单个细胞,形成的菌落有可能来自样品中的2 ~3 个或更多个细胞,试验结果准确度偏低。
本研究以提取指甲花香豆素类成分和研究其抑菌活性为出发点,对提取工艺进行优化,得到的最佳提取工艺条件为提取温度60 ℃、提取时间90 min、料液比1∶40 和乙醇浓度70%。最佳提取工艺提高了有效成分的含量,提取率为0.185%。抑菌活性试验结果表明,指甲花香豆素类成分提取液有一定程度的抑菌效果,大肠埃希菌的抑菌圈平均直径为11.74 mm,金黄色葡萄球菌的抑菌圈平均直径为13.77 mm。
我国中药资源丰富,大部分中药材中均含有潜在的抑菌成分[14-16],筛选植物天然抑菌活性成分并探究其抑菌机理已成为植物化学领域的研究热点。指甲花在我国南北方地区均有分布,多以园艺观赏为主,易于成活且生存能力强,种植成本较低,醌类、香豆素类和黄酮类活性成分含量较高,具有较强生物活性[17-18],在抑菌方面有广阔前景,在供园艺观赏的同时有望成为制备抗菌洗液等日用品的化工原料。本研究未对深层次的指甲花香豆素类成分抑菌机理进行探讨,可在后续工作中进一步研究。

